1,25(OH)2VD3对Zucker糖尿病肥胖大鼠肝线粒体损伤的保护作用
李艳艳,冯里茹,张红敏,谭洪兴,朱李佳,王 俊
(深圳市慢性病防治中心,广东 深圳 518020)
糖尿病(diabetes mellitus,DM)是当前严重威胁人类健康的代谢性疾病,长期的代谢紊乱可引起全身多器官病变。肝是糖脂代谢的主要场所,也是胰岛素作用的重要靶器官,肝损伤在DM发生发展进程中发挥重要作用[1]。
糖尿病肝损伤机制复杂,其中活性氧簇(reactive oxygen species,ROS)介导的氧化应激被认为是肝损伤的关键机制并贯穿始终[2]。线粒体是细胞内的能量供应中心,参与多种生理活动,然而,线粒体也是内源性ROS产生的主要部位[3]。糖尿病状态下,高糖高脂加重了线粒体负荷,在呼吸链电子传递中产生的过量ROS将自身作为首要靶标导致线粒体结构破坏和功能障碍,进一步加剧ROS的积聚导致肝严重损伤,从而加重糖脂代谢的紊乱,形成恶性循环[4 - 5]。因此,减轻线粒体损伤、修复线粒体结构和功能对于防治糖尿病肝损伤具有重要意义。
线粒体生物合成(mitochondrial biogenesis)是核基因及线粒体基因协同调控下的重要生理活动,在线粒体结构修复及功能维持过程中发挥关键作用[6]。在糖尿病肝线粒体损伤情况下,增加线粒体生物合成对于恢复肝细胞正常糖脂代谢尤为重要。维生素D(vitamin D,VD)是一种脂溶性维生素,经肝、肾转化成活性形式1,25(OH)2VD3后与维生素D受体(vitamin D receptor,VDR)结合发挥多种生物学效应,在糖脂代谢过程中亦发挥重要的调节作用[7]。然而,维生素D能否通过线粒体生物合成改善糖尿病肝损伤及相关机制目前鲜有研究。因此,本研究以维生素D缺乏状态下的Zucker糖尿病肥胖(Zucker diabetic fatty,ZDF)大鼠为对象,探讨1,25(OH)2VD3对糖尿病肝线粒体损伤的保护作用机制。
1 材料和方法
1.1 实验动物
SPF级雄性自发性肥胖型2型糖尿病大鼠(ZDF大鼠)20只,体重(127.1±13.7) g,5~6周龄;SPF级雄性Zucker瘦型(Zucker lean,ZL)大鼠10只,体重(114.3±7.2) g,5~6周龄,购于维通利华实验动物技术有限公司[SCXK (京) 2016-0011],动物饲养于华中科技大学实验动物中心[SYXK (鄂) 2016-0057]。本研究通过华中科技大学同济医学院实验动物医学伦理委员会审批(IACUC Number:432)。
1.2 主要试剂与仪器
1,25(OH)2VD3(Cayman);2.5%戊二醛固定液(谷歌生物);血清ALT、AST检测试剂盒(南京建成);MDA、GSH测定试剂盒(南京建成);DHE荧光探针(南京碧云天);线粒体提取试剂盒(碧云天);四甲基罗丹明甲酯(tetramethylrhodamine methyl ester,TMRM)(Sigma-Aldrich);RIPA裂解液(碧云天);总蛋白提取试剂盒(南京碧云天);蛋白定量试剂盒(Bio-Rad);SIRT1抗体、PGC-1α抗体、TFAM抗体、NRF1抗体(Abcam);HRP标记抗小鼠IgG抗体、HRP标记抗兔IgG抗体(CST);ECL化学发光剂(Millipore)。倒置显微镜(奥林巴斯);透射电子显微镜(Hitachi);化学发光成像仪(Bio-Rad);荧光分光光度计(Thermo)。
1.3 实验方法
1.3.1 动物分组
所有大鼠在喂养过程中均按实验动物使用的3R原则给予人道的关怀。适应性喂养1周后,瘦型鼠为对照组(ZL),胖型鼠按照体重随机分为2组:模型组(ZDF)和维生素D干预组(ZDF + VD),胖型鼠体重为105~152 g,分为105~110 g、111~120 g、121~130 g、130~140 g、141~152 g五个等级,然后将每个等级的大鼠随机分为2组。喂养Zucker大鼠专用饲料Purina #5008(北京科奥协力饲料有限公司提供),在原饲料配方基础上去除添加的维生素D;1,25(OH)2VD3溶于玉米油中根据体重每两天灌胃1次,剂量为每千克体重5 μg(剂量根据预实验确定);ZL组与ZDF组大鼠灌胃等体积的玉米油。各组大鼠喂养至12周龄,喂养结束后,眼眶取血,迅速剥离肝,进行电镜及病理观察的固定,其他肝组织分装于-80℃保存。
1.3.2 肝损伤指标检测
按照血清ALT、AST检测试剂盒操作步骤检测各组大鼠血清中谷丙转氨酶(ALT)、谷草转氨酶(AST)水平;HE染色观察肝病理改变;硫代巴比妥酸(TBA)比色法测定心脏丙二醛(MDA)水平,二硫代二硝基苯甲酸(DTNB)比色法测定心脏谷胱甘肽(GSH)水平;肝ROS检测:肝组织冰冻切片孵育DHE荧光探针,荧光显微镜观察红色荧光强度并拍照。
1.3.3 肝超微结构观察
动物处死1 min内迅速切取截面积为1 mm2的5 mm肝组织长条,用2.5%的戊二醛缓冲液固定,经过处理后的切片用透射电子显微镜观察肝超微结构,尤其是线粒体的损伤。
1.3.4 线粒体膜电位测定
取100 mg新鲜肝组织用线粒体提取试剂盒提取线粒体,使用100 nmol/L TMRM荧光染料孵育(37℃,30 min)后,用荧光分光光度计读取荧光强度。
1.3.5 线粒体生成相关蛋白的检测
Western blot检测肝线粒体生成相关蛋白NRF1、TFAM表达量及上游调节蛋白SIRT1、PGC-1α的表达。称取100 mg左右肝组织,加入10倍体积的RIPA裂解液提取总蛋白。蛋白浓度用BCA试剂盒测定。利用SDS-PAGE电泳分离蛋白后,通过湿转法将蛋白转移到PVDF膜上。根据抗体说明书进行一抗和经HRP标记的二抗孵育。最后,加入ECL化学发光试剂进行显色,利用化学发光成像系统进行拍照和灰度统计。
1.4 统计学方法
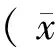
2 结果
2.1 1,25(OH)2VD3改善ZDF大鼠肝损伤
血清ALT、AST是反映肝损伤的敏感指标。如图1A所示:与ZL组相比,ZDF组大鼠肝细胞ALT、AST释放水平显著升高,血清ALT、AST水平约分别增加了8.3倍和6.8倍。1,25(OH)2VD3干预后明显减轻了ZDF大鼠肝细胞ALT、AST的释放。
喂养结束后,较ZL组相比,ZDF组大鼠肝出现明显的病理改变,肝体积明显增大,颜色变浅偏黄,HE染色结果显示,ZL组大鼠肝小叶清晰,肝细胞索以小叶中央静脉为中心呈放射状排列,没有出现脂滴以及脂肪变性,细胞核为圆形,位于细胞中央;而ZDF组大鼠肝出现明显的脂肪病变,弥漫性小泡脂滴几乎占满整个肝细胞;1,25(OH)2VD3干预有效缓解了ZDF大鼠肝病变。如图1B所示。
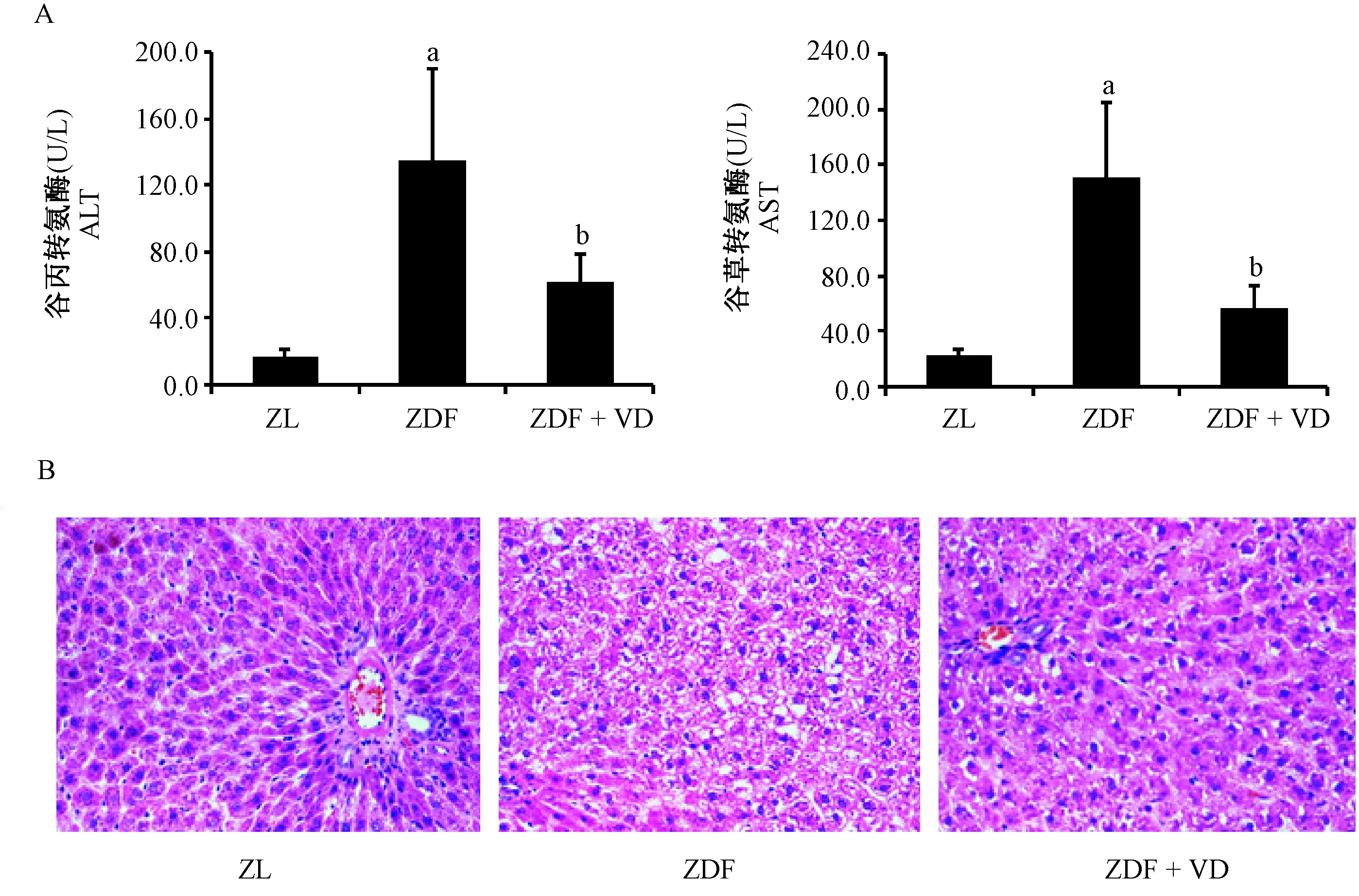
注:A:大鼠血清转氨酶水平。与ZL组比较,aP< 0.05;与ZDF组比较,bP< 0.05。B:大鼠肝组织HE染色(× 200)。图1 1,25(OH)2VD3对大鼠血清ALT、AST及肝病理损伤的影响Note. A: Serum transaminases of Zucker rats. Compared with the ZL group,aP< 0.05. Compared with the ZDF group,bP< 0.05. B: Liver histology.HE staining (× 200).Figure 1 Effect of 1,25(OH)2VD3 on serum transaminases and liver histology in the Zucker rats
2.2 1,25(OH)2VD3改善ZDF大鼠肝氧化损伤
图2A展现的是肝ROS水平,较ZL组,ZDF组大鼠肝组织孵育DHE探针后红色荧光显著增强,ROS的产生明显升高。脂质过氧化产物——丙二醛(MDA)的水平能够反映脂质氧化损伤程度,谷胱甘肽(GSH)则反映机体抗氧化水平,如图2B所示,与ZL组相比,ZDF组大鼠肝MDA水平显著上升而GSH水平明显降低,1,25(OH)2VD3干预后,MDA水平降低了约25%,GSH水平升高了约41%,显著缓解了ZDF大鼠肝氧化损伤。

注:A:大鼠肝组织ROS水平(× 200)。B:大鼠肝谷胱甘肽及丙二醛水平。与ZL组比较,aP< 0.05;与ZDF组比较,bP< 0.05。图2 1,25(OH)2VD3对大鼠肝氧化损伤的影响A: Liver ROS detected under a fluorescence microscope (× 200). B: Liver GSH and MDA detected by spectrophotometry. Compared with the ZL group,aP< 0.05. Compared with the ZDF group,bP< 0.05.Figure 2 Effect of 1,25(OH)2VD3 on oxidative damage in the ZDF rat liver
2.3 1,25(OH)2VD3对ZDF大鼠肝线粒体结构及功能的影响
图3A电镜结果显示:ZL组大鼠肝线粒体呈椭圆形、短棒状或者圆形,大小均一;ZDF组大鼠肝细胞胞浆中出现大小不一的脂滴,线粒体肿胀、形态异常并伴有空泡化;1,25(OH)2VD3干预后线粒体形态基本恢复正常。线粒体膜电位(mitochondrial membrane potential,MMP)是反映线粒体膜损伤及功能的重要指标,与ZL组相比,ZDF组大鼠肝MMP下降了约43%,1,25(OH)2VD3逆转了线粒体膜通透性的改变,减轻了线粒体损伤(图3B)。
2.4 1,25(OH)2VD3改善ZDF大鼠肝线粒体生物合成
线粒体生物合成对于机体维持和修复线粒体结构和功能具有重要意义。介导线粒体生物合成最重要的是PGC-1α及其下游转录因子NRF1和TFAM。如图4所示,ZDF组大鼠肝组织中PGC-1α、NRF1及TFAM的表达比ZL组约分别降低了58%、38%及62%,此外,PGC-1α上游调节蛋白SIRT1的表达也显著降低;1,25(OH)2VD3能够上调线粒体生成相关调控蛋白SIRT1、PGC-1α及其下游NRF1和TFAM的表达,缓解ZDF大鼠肝线粒体稳态失衡。

注:A:大鼠肝超微结构(× 3500),红色箭头指示线粒体。B:大鼠肝线粒体膜电位水平。与ZL组比较,aP< 0.05;与ZDF组比较,bP< 0.05。图3 1,25(OH)2VD3对ZDF大鼠肝线粒体损伤的保护作用Note. A: Liver ultrastructure of Zucker rats observed by transmission electron microscopy (× 3500). Red arrows indicate mitochondria.B: Liver mitochondrial membrane potential. Compared with the ZL group,aP< 0.05. Compared with the ZDF group,bP< 0.05.Figure 3 Protective effect of 1,25(OH)2VD3 on hepatic mitochondrial injury in the ZDF rats
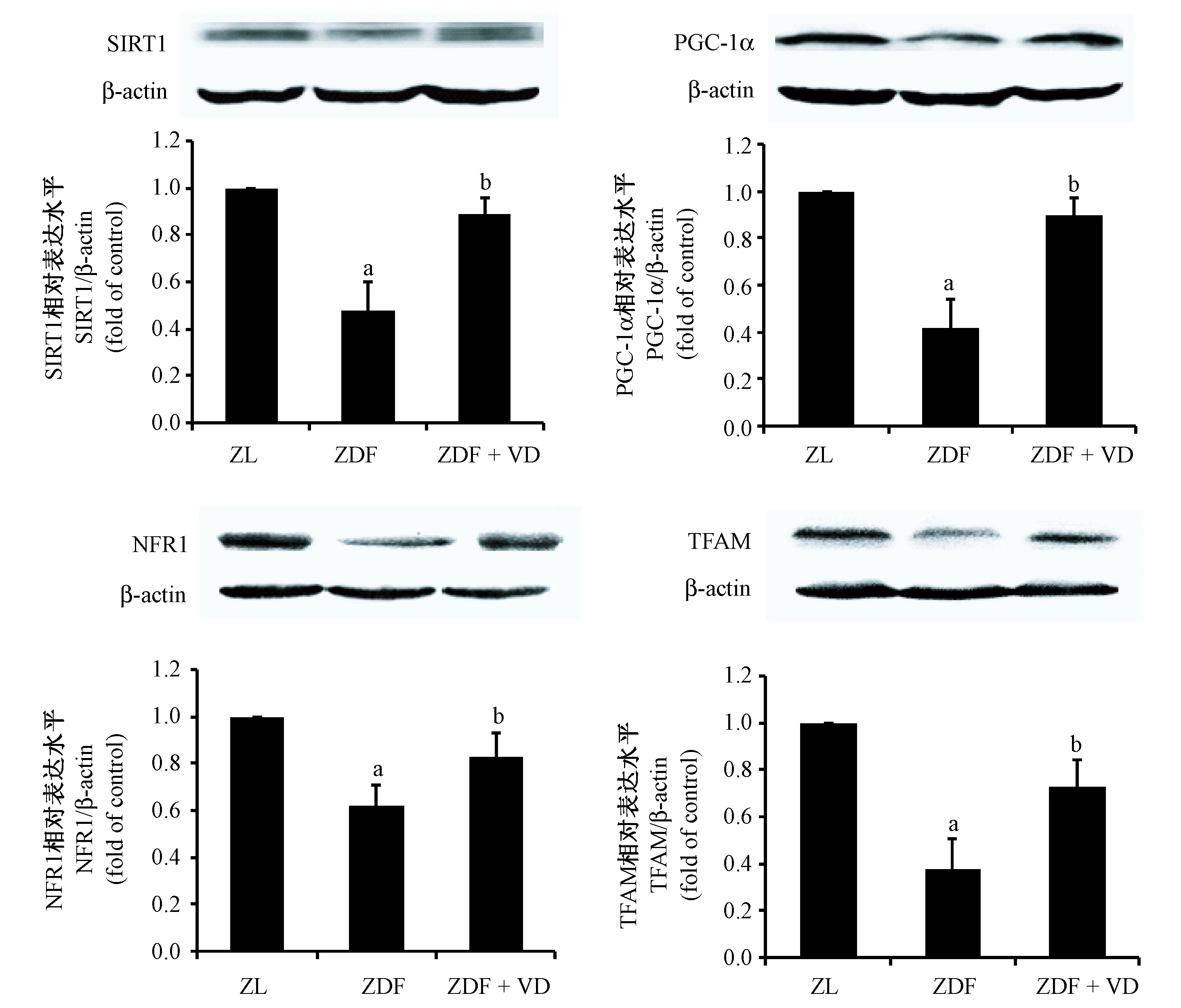
注:与ZL组比较,aP< 0.05;与ZDF组比较,bP< 0.05。图4 1,25(OH)2VD3对ZDF大鼠肝线粒体合成的影响Note. Compared with the ZL group,aP< 0.05. Compared with the ZDF group,bP< 0.05.Figure 4 Protective effect of 1,25(OH)2VD3 on hepatic mitochondrial biogenesis in the ZDF rats
3 讨论
糖尿病是以高血糖为特征的代谢性疾病,可导致全身多个器官损害,肝损伤就是其中主要的损伤之一。研究发现,约50%的糖尿病患者合并肝病变,肝损伤在糖尿病的发生发展进程中发挥着重要作用[8]。ZDF大鼠是从出现糖尿病表型的Zucker大鼠中筛选并近亲杂交培育出的一种自发性糖尿病模型鼠[9],ZDF大鼠经高血脂高血糖、糖耐量异常、胰岛素抵抗等程序化发展为2型糖尿病,被认为是2型糖尿病及并发症研究的理想动物模型[10-11]。本研究发现,ZDF大鼠血清ALT、AST水平异常升高,肝出现损伤,组织病理切片显示,ZDF大鼠肝细胞出现严重的脂肪变性。
糖尿病肝损伤机制复杂,ROS介导的氧化应激备受关注。在高糖高脂状态下,过量的ROS会攻击蛋白质、脂质和核酸等生物大分子,导致肝细胞脂质过氧化,引起肝的病变[12]。研究认为,线粒体是细胞内ROS产生的主要场所,病理状态下,呼吸链电子传递过程中大量产生的ROS将线粒体自身作为首要靶标,造成线粒体结构与功能的异常,加速ROS的生成,导致细胞严重的氧化损伤[13]。本研究电镜结果显示,ZDF大鼠线粒体出现肿胀、变性、空泡化,线粒体膜电位也随之降低。与此同时,ZDF大鼠肝ROS产生显著增多、脂质过氧化产物MDA含量升高,最严重的是肝的抗氧化能力却逐渐下降,表现为GSH耗竭,这些结果提示ZDF大鼠肝出现明显的氧化损伤。与以往研究结果相似,在STZ诱导的糖尿病大鼠肝细胞出现线粒体功能障碍及氧化损伤[14],这些结果提示,线粒体结构及功能障碍可能在糖尿病肝损伤中起着关键作用。
线粒体生物合成是线粒体结构和功能修复的重要生理活动。介导线粒体生成最重要的调控因子为PGC-1α[15],对机体线粒体生物合成及氧化应激的调控具有重要意义。此外,PGC-1α下游转录因子NRF1和TFAM也是调控线粒体合成与功能的关键分子,参与线粒体DNA的复制与转录[16]。研究显示,在糖尿病大鼠视网膜病变中,线粒体损伤及ROS的增加与PGC-1α下降密切相关[17]。2型糖尿病ob/ob小鼠心肌细胞PGC-1α、NRF1及TFAM表达显著降低并伴随线粒体mtRNA拷贝数的减少与ROS产生的增加[18]。研究发现,SIRT1可通过乙酰化作用激活PGC-1α从而促进线粒体生物合成[19]。然而,在STZ诱导的糖尿病及db/db糖尿病小鼠模型肾组织中SIRT1表达与活性均显著降低,上调能够缓解氧化损伤、凋亡等病理改变[20]。本研究发现,伴随着氧化应激及线粒体功能损害,ZDF大鼠肝线粒体生物合成关键分子PGC-1α及其下游NRF1及TFAM的表达明显下降,PGC-1α的上游调控因子SIRT1的表达也显著降低,提示ZDF大鼠肝损伤与线粒体生物合成受阻相关。
近年来,维生素D已成为糖尿病发生发展的重要影响因素。维生素D经肝、肾转化成活性形式1,25(OH)2VD3后与维生素D受体(VDR)结合,参与糖脂代谢,调节胰岛素敏感性,在糖尿病及其并发症的防治中具有重要意义[7]。此外,研究显示,1,25(OH)2VD3可通过抗氧化、抗炎等多种机制缓解非酒精性肝损伤。我们前期研究发现,维生素D缺乏会加速和加重ZDF大鼠的病情[21],本实验结果显示,维生素D缺乏状态下的ZDF大鼠肝出现了严重的氧化损伤及线粒体损害,1,25(OH)2VD3干预后肝损伤明显缓解,ROS产生减少,线粒体结构及功能趋于正常。其他研究也发现,1,25(OH)2VD3能够调节骨骼肌线粒体功能及其酶活性[22]。然而,目前关于1,25(OH)2VD3改善线粒体功能的相关机制鲜有报道。本研究显示,1,25(OH)2VD3能够上调线粒体生物合成关键蛋白SIRT1、PGC-1α及下游NRF1和TFAM的表达,修复ZDF大鼠肝由于高糖高脂引起的线粒体结构和功能损伤,同时缓解了肝氧化损伤。
综上所述,1,25(OH)2VD3可通过上调SIRT1/PGC-1α通路增强线粒体生物合成,修复线粒体结构与功能,从而缓解了ZDF大鼠肝氧化损伤。本实验为1,25(OH)2VD3防治糖尿病及肝损伤提供了新的理论基础,1,25(OH)2VD3是如何调控SIRT1及更深入的机制需进一步实验研究。

