大黄素对ApoE基因敲除小鼠脂肪棕色化的影响
程 龙,董世芬,袁悦莹,马 丹,宋敬怡,孙建宁,张硕峰
(北京中医药大学中药学院中药药理系,北京 100029)
肥胖是一种多因素引起的慢性代谢疾病,是引发糖尿病、动脉粥样硬化、高脂血症等相关疾病的主要因素,肥胖的发生与血瘀相关,活血化瘀方药在治疗肥胖过程中取得良好疗效[1-3]。哺乳动物的脂肪组织主要由储脂为主的白色脂肪组织(white adipose tissue,WAT)与产热为主的棕色脂肪组织(brown adipose tissue,BAT)组成。肥胖发生时,体内白色脂肪组织与棕色脂肪组织比例失衡,白色脂肪组织过度堆积或分布异常。中医学认为肥胖是由于多种因素导致体内膏脂堆积过多,进而引发脾虚气亏、瘀血、气滞、痰湿等证候特征。研究表明,白色脂肪棕色化及活化棕色脂肪能增加机体产热,调节能量代谢,是肥胖治疗的有效环节之一[4-5]。
大黄来源于蓼科植物掌叶大黄(RheumpalmatumL)、唐古特大黄(RheumtanguticumMaxim. ex Balf)或药用大黄(RheumofficinaleBaill)的干燥根及根茎,性苦、寒,具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄之功效[6],具有降血脂、抗氧化、抗炎等作用[7 - 8]。大黄素(emodin),学名1,3,8-三羟基-6-甲基蒽醌(1,3,8-trihydroxy-6-methylanthraquinone),是大黄的主要有效成分之一,为蒽醌类衍生物,具有降血糖及降血脂[9]、抗衰老[10]、抗炎[11]等药理作用。研究发现,大黄素可以降低高脂饮食诱导的肥胖模型大鼠体重、血脂水平、动脉粥样硬化指数,减少白色脂肪中脂质聚集和减小白色脂肪细胞直径,改善能量代谢紊乱[12]。ApoE基因敲除小鼠因载脂蛋白E基因缺失,易出现脂质代谢异常和白色脂肪堆积,是研究肥胖及相关代谢疾病的较佳模型[13-14]。因此,本研究以ApoE基因敲除小鼠为研究对象,观察大黄素对ApoE基因敲除小鼠脂肪棕色化的影响,探讨其治疗肥胖等血瘀状态的作用机制。
1 材料和方法
1.1 实验动物
8周龄SPF级雄性ApoE-/-小鼠24只,具有相同遗传背景且同周龄的SPF级雄性C57BL/6J小鼠8只,体重(20±2) g,由南京大学模式动物研究所提供[SCXK (苏) 2015-0001],合格证号:201606277。所有小鼠饲养于北京中医药大学屏障环境动物实验室[SYXK (京) 2016-0038],室温(25±2)℃、45%相对湿度,12 h/12 h光暗周期,饲养期间小鼠自由进食及饮水,并按实验动物使用的3R原则给予人道的关怀,本研究由北京中医药大学医学与实验动物伦理委员会审批准,编号:BUCM-4-2016121001-4020。
1.2 主要试剂与仪器
大黄素(emodin),购于北京华威锐科化工有限公司,纯度为98%,批号16HC0215-2;辛伐他汀,购于杭州默沙东制药有限公司,批号M029946;基础饲料及高脂饲料,购于北京科澳协力有限公司[SCXK (京) 2014-0010];总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测试盒均由贝克曼库尔特实验系统实验系统(苏州)有限公司提供,批号分别为AUZ4678、AUZ3692、AUZ4573、AUZ4289;UCP1抗体购于Abcam公司,批号GR3188478-6;山羊抗兔二抗购于无锡傲锐东源生物科技有限公司,批号K172414D。半自动轮转式切片机(RM2245,德国徕卡(Leica)仪器有限公司);全自动真空脱水机(ASP3005,德国徕卡(Leica)仪器有限公司);分体式包埋机(EG1150,德国徕卡(Leica)仪器有限公司);多功能染色盖片工作站(ST5020/CV5030,德国徕卡(Leica)仪器有限公司);正置智能型显微镜(BX53,奥林巴斯(中国)有限公司);全自动生化分析仪(CX4 Pro,美国贝克曼公司);小动物超声影像系统(Vevo TM 2100,加拿大Visual Sonics公司)。
1.3 实验方法
1.3.1 动物造模、分组及给药
ApoE-/-小鼠小鼠喂食高脂饲料(77.5%的基础饲料,1.5%胆固醇,21%猪油)12周,之后随机分为3组,即ApoE-/-模型组、辛伐他汀5.7 mg/kg组、大黄素80 mg/kg组,每组8只。C57BL/6J小鼠为正常对照组,全程喂食普通饲料。模型组和给药组小鼠持续喂食高脂饲料至实验结束。小鼠至13周开始给药,模型组和正常对照组每日给予相同溶媒(饮用水)灌胃,辛伐他汀和大黄素分别按照5.7 mg/kg、80 mg/kg剂量[15]灌胃给药,给药体积为0.1 mL/10 g,连续干预18周,每周记录各组小鼠体重。
1.3.2 心功能指标检测
将小鼠气体麻醉、剃毛,用小动物超声影像系统检测小鼠心脏的射血分数(EF)、短轴缩短率(FS)。
1.3.3 取材
干预18周后,禁食12 h,称取小鼠体重,取血约1.5 mL,3500 r/min,离心10 min,分离血清。取血后,解剖分离皮下腹股沟白色脂肪及肩胛区棕色脂肪,并称重,腹股沟白色脂肪组织放在10%中性福尔马林固定液中固定。
1.3.4 脂肪重量/体重的测定
精确称重小鼠皮下腹股沟白色脂肪重量、肩胛部棕色脂肪重量,计算腹股沟白色脂肪重量(iWAT)/体重(WB)和肩胛区棕色脂肪重量(BAT)/体重(WB)的比值。
1.3.5 血脂的检测
按照说明,采用生化试剂盒测定血清中TC、TG、LDL-C及HDL-C的含量。
1.3.6 腹股沟白色脂肪HE染色
将固定在10%中性福尔马林固定液中的腹股沟白色脂肪取出,常规石蜡包埋;切片;切片用二甲苯脱蜡,经各级乙醇至水洗;苏木素液染色;水洗;盐酸乙醇分色;自来水浸泡;伊红染色;自来水冲洗;常规脱水;透明;封片;正置智能显微镜观察脂肪细胞形态学变化。
1.3.7 腹股沟白色脂肪免疫组织化学染色
组织切片常规脱蜡、脱水;抗原修复;阻断内源性过氧化物酶;封闭;加UCP1一抗4℃过夜;过夜后,PBS清洗,滴加二抗;DAB显色;终止显色后苏木素复染,流水返蓝;常规脱水;透明;中性树胶封片。棕黄色着色即为阳性细胞抗原存在位置。
1.3.8 腹股沟白色脂肪组织UCP1蛋白表达的影响
使用图像分析软件(Image-Pro Plus 6.0),选取棕黄色处为阳性着色,对阳性表达处进行AOD分析。
1.4 统计学方法

2 结果
2.1 大黄素对ApoE-/-小鼠体重的影响
如图1所示,在整个实验期间,与正常对照组比较,ApoE-/-小鼠体重显著增加(P< 0.01);与ApoE-/-模型组比较,自给药第12周开始至实验结束,大黄素组、辛伐他汀组小鼠体重显著降低(P< 0.05或P< 0.01)。

注:与ApoE-/-模型组比较,*P < 0.05,**P < 0.01。图1 大黄素对ApoE-/-小鼠体重的影响Note. Compared with the ApoE-/- model group,*P< 0.05,**P< 0.01.Figure 1 Effect of emodin on body weight of the ApoE-/- mice
2.2 大黄素对ApoE-/-小鼠脂肪重量/体重比值的影响
如图2A、2B所示,与正常对照组比较,ApoE-/-模型组小鼠皮下腹股沟白色脂肪组织(iWAT)重量/体重(BW)的比值显著降低(P< 0.01),棕色脂肪组织(BAT)重量/体重(BW)的比值显著降低(P< 0.01);与ApoE-/-模型组相比,大黄素组、辛伐他汀组小鼠iWAT/BW显著降低(P< 0.05),BAT/BW的比值显著增加(P< 0.05或P< 0.01)。
2.3 大黄素对ApoE-/-小鼠血清TG、TC、LDL-C和HDL-C水平的影响
如图3所示,与正常对照组比较,ApoE-/-模型组小鼠血清中TG、TC、LDL-C含量显著升高(P< 0.01),HDL-C含量差异无显著性(P> 0.05);与ApoE-/-模型组比较,大黄素组小鼠血清中TG、TC含量显著降低(P< 0.05);LDL-C含量具有降低趋势,HDL-C含量增加,但差异均无显著性(P> 0.05);辛伐他汀组小鼠血清中TG、TC、LDL-C含量显著降低(P< 0.05或P< 0.01),HDL-C含量显著增加(P< 0.05)。
2.4 大黄素对ApoE-/-小鼠心脏的射血分数、短轴缩短率的影响
如图4A、4B所示,与正常对照组比较,ApoE-/-模型组小鼠心脏的EF、FS百分率显著降低(P< 0.05),提示心功能损伤;与ApoE-/-模型组比较,大黄素组、辛伐他汀组小鼠心脏的EF、FS百分率显著增加(P< 0.01)。
2.5 大黄素对ApoE-/-小鼠皮下腹股沟白色脂肪组织形态的影响
如图5所示,正常对照组小鼠腹股沟白色脂肪呈现出较大空泡状,形状近似圆形,组织比较致密(图5A);ApoE-/-模型组小鼠皮下腹股沟白色脂肪呈现出大空泡的脂肪室,且形状不规则,细胞核、细胞器及胞浆被挤到一侧呈薄环,白色脂肪特征明显(图5B);与模型组相比,大黄素组(图5C)、辛伐他汀组(图5D)小鼠皮下腹股沟白色脂肪细胞出现多室,细胞变小、变圆,组织变的更加致密,具有棕色化趋势。
2.6 大黄素对ApoE-/-小鼠iWAT部位UCP1蛋白表达的影响
观察小鼠腹股沟白色脂肪组织免疫组织化学染色切片,棕黄色着色即为阳性细胞抗原存在位置。与ApoE-/-模型组比较(图6B),大黄素组(图6C)、辛伐他汀组(图6D)iWAT中UCP-1阳性表达显著。利用Image-Pro Plus 6.0对其AOD进行分析。图7结果显示,与正常对照组比较,ApoE-/-模型组小鼠皮下股沟脂肪组织AOD的值降低,但差异无显著性(P> 0.05);与ApoE-/-模型组比较,大黄素组、辛伐他汀小鼠皮下腹股沟脂肪组织AOD的值显著增加(P< 0.01),进一步提示其增加iWAT脂肪细胞棕色化特征。
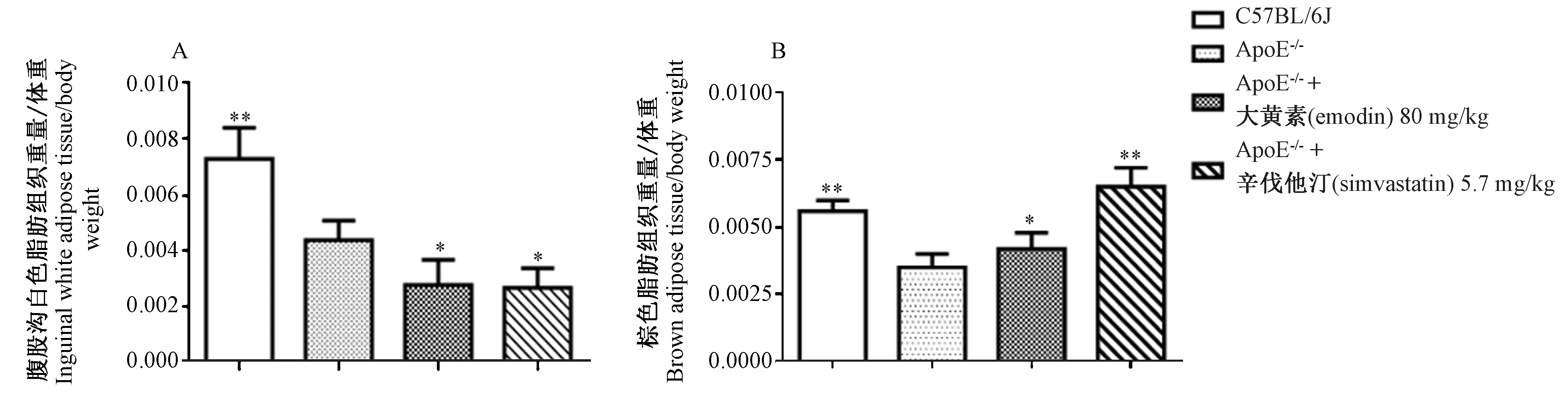
注:与ApoE-/-模型组比较,*P < 0.05,**P < 0.01。图2 大黄素对ApoE-/-小鼠脂肪重量/体重比值的影响Note. Compared with the ApoE-/- model group,*P< 0.05,**P< 0.01.Figure 2 Effect of emodin on fat weight/body weight ratio in the ApoE-/- mice
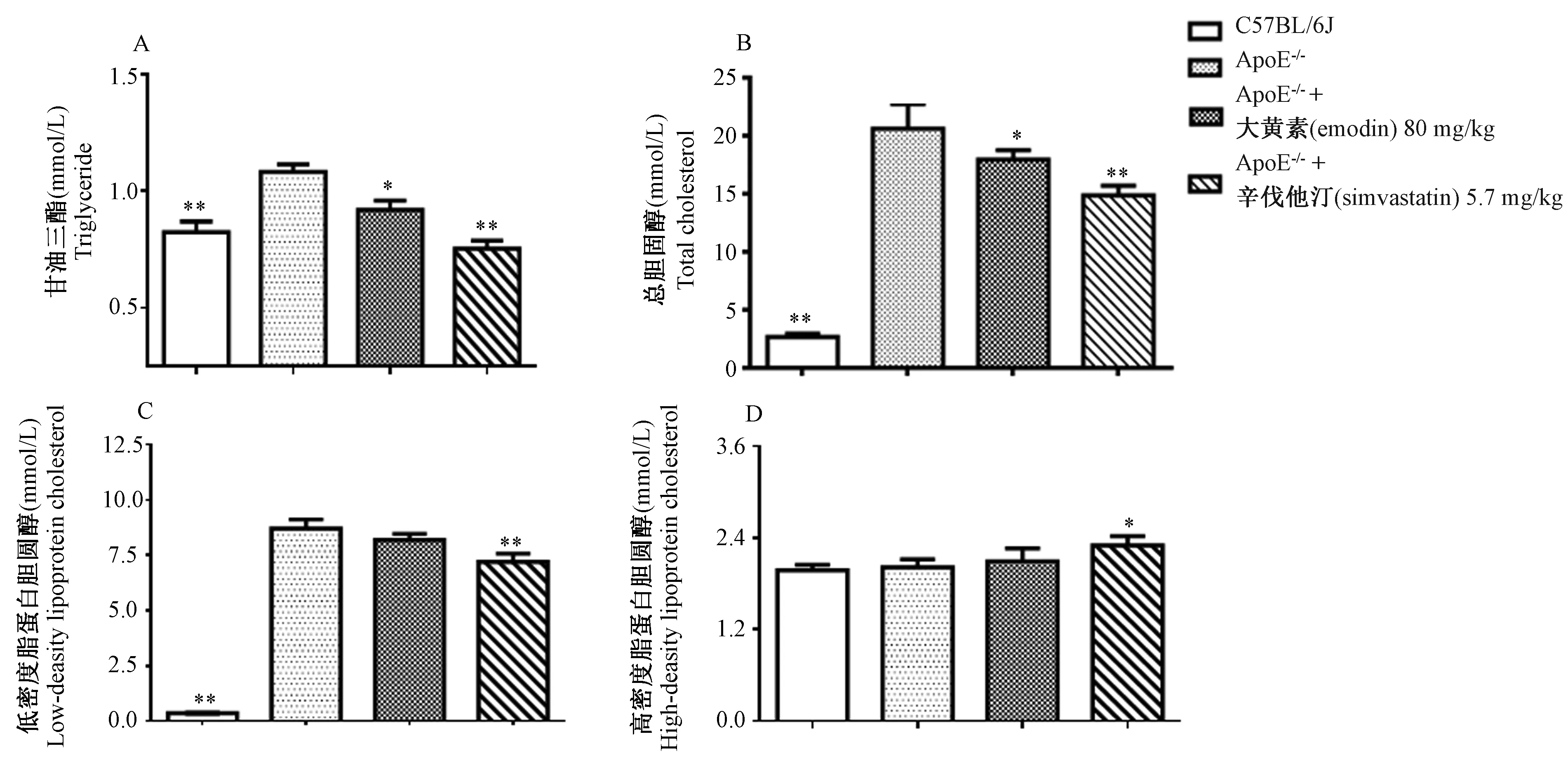
注:与ApoE-/-模型组比较,*P < 0.05,**P < 0.01。图3 大黄素对ApoE-/-小鼠血清TG、TC、LDL-C、HDL-C水平的影响Note. Compared with the ApoE-/- model group,*P< 0.05,**P< 0.01.Figure 3 Effects of emodin on the levels of serum TG, TC, LDL-C, and HDL-C in the ApoE-/- mice

注:与ApoE-/-模型组比较,*P < 0.05,**P < 0.01。图4 大黄素对ApoE-/-小鼠心脏EF、FS的影响Note. Compared with the ApoE-/- model group,*P< 0.05,**P< 0.01.Figure 4 Effect of emodin on changes of heart EF and FS in the ApoE-/- mice
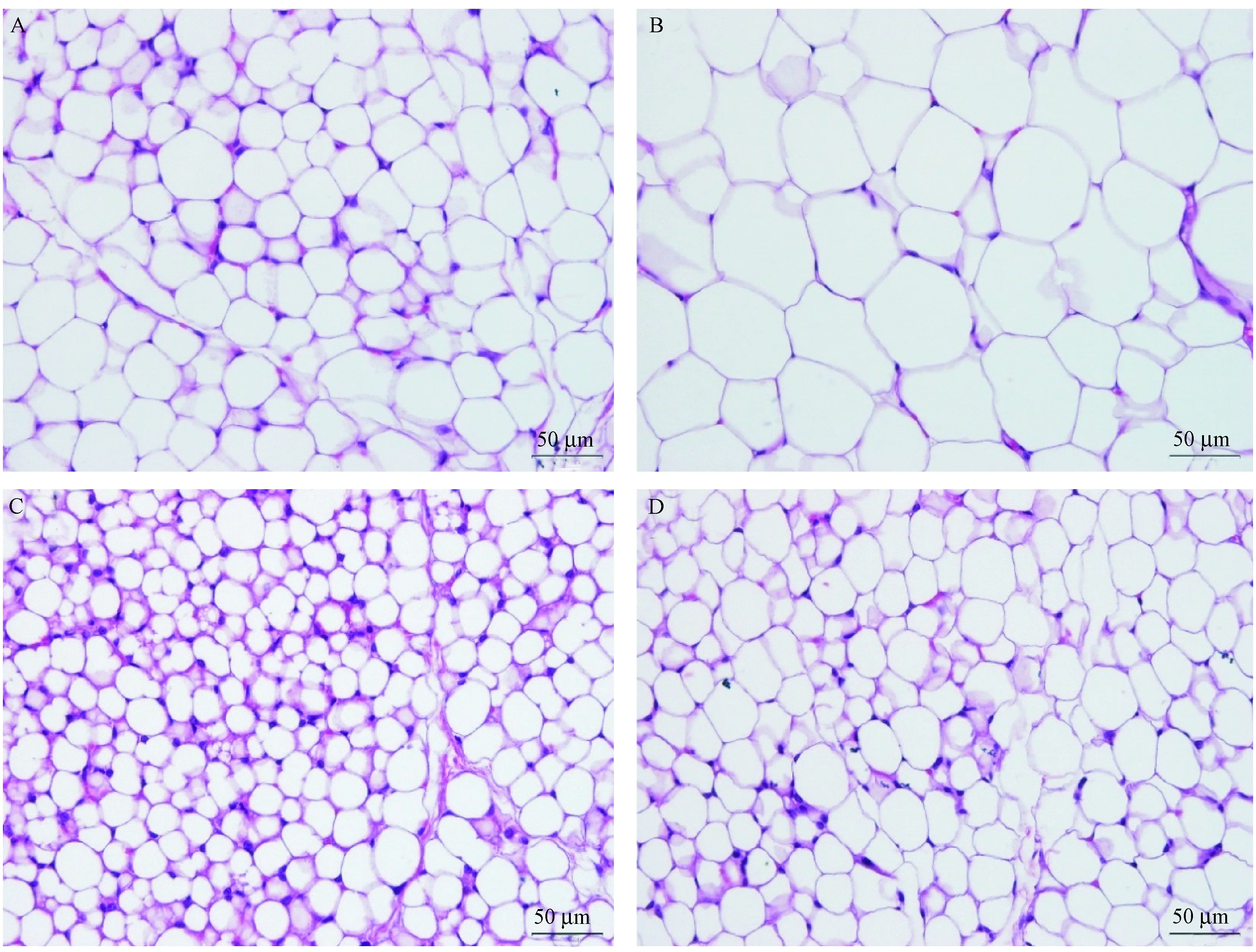
注:A:正常对照组;B:ApoE-/-模型组;C:大黄素80 mg/kg组;D:辛伐他汀5.7 mg/kg组。图5 大黄素对ApoE-/-小鼠腹股沟白色脂肪组织形态的影响(HE染色,× 400)Note. A: Control group; B: ApoE-/-model group; C: 80 mg/kg emodin group; D: 5.7 mg/kg simvastatin group. Figure 5 Effect of emodin on the histology of white adipose tissue in the inguinal region of ApoE-/- mice. HE staining

注:A:正常对照组;B:ApoE-/-模型组;C:大黄素80 mg/kg组;D:辛伐他汀5.7 mg/kg组。图6 大黄素对ApoE-/-小鼠皮下腹股沟白色脂肪组织UCP1免疫组织化学染色的影响(× 400)Note. A: Control group; B: ApoE-/-model group; C: 80 mg/kg emodin group; D: 5.7 mg/kg simvastatin group. Figure 6 Effect of emodin on immunohistochemical staining of UCP-1 in white adipose tissue of the ApoE-/- mice
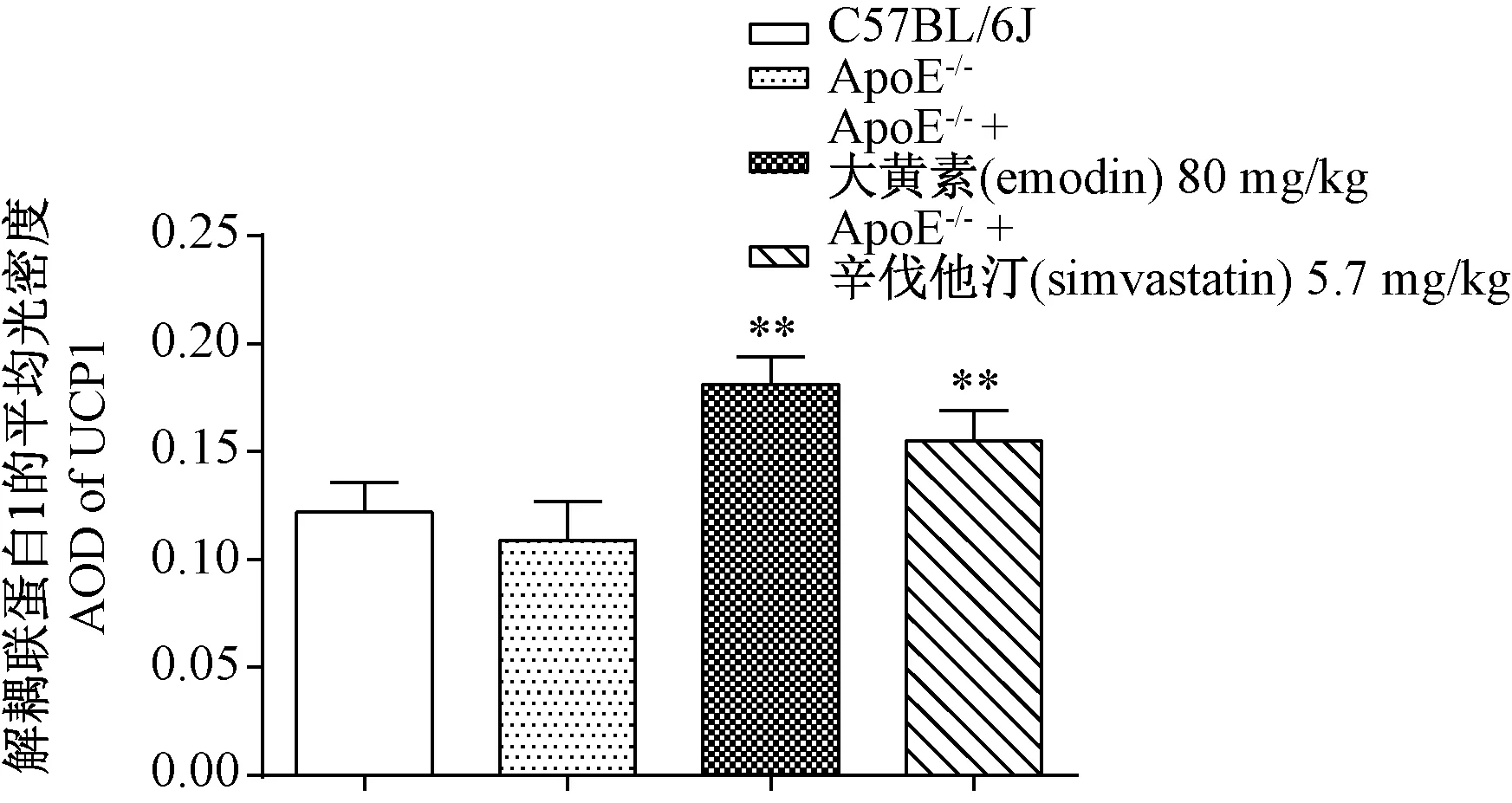
注:与ApoE-/-模型组比较,*P < 0.05,**P < 0.01。图7 大黄素对ApoE-/-小鼠皮下腹股沟白色脂肪组织UCP1蛋白表达AOD的影响Note. Compared with the ApoE-/- model group,*P< 0.05,**P< 0.01.Figure 7 Effect of emodin on the protein expression of UCP1 in the inguinal white adipose tissue of ApoE-/- mice
3 讨论
哺乳动物的脂肪组织主要由白色脂肪组织(white adipose tissue,WAT)与棕色脂肪组织(brown adipose tissue,BAT)组成。WAT不仅是能量储存的器官,同时也是重要的内分泌器官,可通过内分泌及旁分泌众多细胞因子或脂肪因子影响机体的糖脂代谢平衡、血压水平、炎症反应等,与血瘀证包括高血糖、高血压、高脂血症、动脉粥样硬化等的发生、发展密切相关。BAT的细胞主要由多泡脂肪构成,其细胞内含有大量线粒体,主要功能是消耗脂肪并发挥非颤抖产热作用[16]。BAT的线粒体中含有特异性载体蛋白即UCP1。UCP1可以将H+从线粒体内膜渗漏到线粒体基质中,减少ADP磷酸化形成ATP,将能量以热能的形式散失[17]。研究证实,当机体交感神经兴奋时(如冷刺激[18]、β-肾上腺素受体激动[19]),皮下白色脂肪组织中UCP1表达显著增加,出现BAT的典型特征,如许多散在的小脂滴、线粒体数目增多、棕色脂肪的标志基因[如诱导细胞死亡DNA片断化因子α样效应因子(cell death-inducing DNA fragmentation factor alpha like effector,CIDE)、过氧化物酶体增殖物激活受体γ辅助激活因子-1α(peroxisome proliferator activated receptor γ coactivator-1α,PGC-1α)、PR结构域蛋白16(positive regulatory domain-containing 16,PRDM16)等]表达增多等,与血糖、血脂调控和体重减轻有关。
大黄素能降低高脂饮食诱导小鼠的体重及血脂,减少白色脂肪组织的堆积,增强胰岛素敏感性,抑制高脂饮食诱导的肥胖和改善相关代谢疾病的紊乱[20-22]。本研究发现大黄素能显著降低高脂饮食ApoE基因敲除小鼠体重(P< 0.05)、白色脂肪重量/体重比值(P< 0.05)以及血清中TG和TC含量(P< 0.05),同时其能显著增加棕色脂肪重量/体重比值(P< 0.05)及左心室的射血分数和短轴缩短率(P< 0.01),具有减少白色脂肪堆积、改善脂质代谢和心功能的作用此外,在脂肪棕色化过程中,小鼠腹股沟白色脂肪比附睾脂肪更加容易转化[23]。通过对各组小鼠皮下腹股沟白色脂肪组织HE染色发现,与ApoE-/-模型组比较,大黄素组小鼠腹股沟白色脂肪出现典型的棕色脂肪细胞表型(如细胞出现多室,细胞变小、变圆等)。已有报道证实大黄素可通过增强腺嘌呤核糖核苷酸活化蛋白激酶的磷酸化及其主要下游靶向乙酰辅酶A羧化酶,上调肉毒碱棕榈酰转移酶1的基因表达,下调甾醇调节元件结合蛋白1,进而减少白色脂肪组织中的脂质积累[12]。本研究结果显示,大黄素可显著增加ApoE-/-小鼠腹股沟白色脂肪组织UCP1蛋白表达,进一步明确其促进白色脂肪棕色化的作用。
综上所述,大黄素可通过降低ApoE基因敲除小鼠体重、血清中甘油三酯、总胆固醇及低密度脂蛋白胆固醇含量和白色脂肪重量/体重比值,减少白色脂肪堆积,同时增加棕色脂肪重量/体重比值、左心室的射血分数和短轴缩短率和皮下腹股沟白色脂肪组织UCP1蛋白的表达,促进ApoE基因敲除小鼠皮下腹股沟白色脂肪棕色化,从而有效抑制肥胖,可能与其逐瘀作用有关。

