GFP/Luc双标食管癌细胞动物模型建立及其活体成像观察
柏 文,彭晓清,王佩文,鞠前前,史 辉,蒋茂荣*
(南通大学 1.实验动物中心; 2.医学院; 3.附属医院心胸外科,江苏 南通 226001)
中国是食管癌的高发地区,发病率位居世界第一。随着以手术切除为主的系列治疗的开展,食管癌的控制率有了显著提高,但是食管癌的预后仍然很差。动物肿瘤模型是介于体外细胞实验和临床试验之间的重要环节,弥补了实验室与临床的差距。其中,利用免疫缺陷动物建立皮下、原位和转移肿瘤模型是阐明食管癌的分子机制以及抗癌药物开发的重要工具。然而,传统的动物实验研究无法实时监测肿瘤的生长状况和治疗效果,特别是对于从外部看不到的肿瘤。
活体发光成像技术是非侵入性监测体内肿瘤生长的一种方法,实时连续动态监测体内的各种生物学过程,可以直接在活体动物体内观察肿瘤的发生、发展和转移等一系列生物学特性变化,以及抗肿瘤药物在动物体内的分布、代谢及疗效。主要采用生物发光和荧光发光两种技术。生物发光是将编码萤火虫荧光素酶(luciferase,Luc)基因标记的肿瘤细胞移植到相应动物体内,并将酶底物注入动物体内。借助小动物活体成像系统,研究人员可以观测活体动物体内肿瘤的生长及转移等生物学过程[1]。由于硬件的进步,尤其是高灵敏冷却CCD相机,可以灵敏地检测活体肿瘤模型动物体内微小病灶的生物发光,保证动物的安全和测量结果的准确可靠,使得该技术成为临床前肿瘤学研究极有价值的工具[2]。
本研究采用慢病毒转染方法,构建了稳定表达绿色荧光蛋白(GFP)和Luc的人食管癌细胞系(ECA109-Luc-GFP),并分析比较该细胞与正常ECA109细胞生物学特性的差异。通过小动物活体成像系统观察了利用该细胞建立的食管癌动物模型的生长、转移,为肿瘤动物模型的推广应用和临床食管癌防治研究提供了实验基础。
1 材料和方法
1.1 实验材料
1.1.1 人食管癌细胞系
人食管癌细胞系ECA109,购自中国科学院细胞库。
1.1.2 实验动物
5周龄SPF级雄性BALB/c裸鼠10只,体重18~22 g,购自中国科学院上海实验动物中心(SLACCAS)[SCXK (沪) 2017-0005]。实验和饲养于南通大学实验动物中心SPF屏障环境内[SYXK (苏) 2017-0046],实验和饲养条件严格遵守标准化操作规程的规范要求(南通大学实验动物使用与管理委员会批准号:20170303-004)。并按实验动物使用的3R原则给予人道的关怀。
1.1.3 质粒构建、质粒提取和细胞转染相关试剂
重组慢病毒载体pCDH-CMV-ffluc-EF1α-CopGFP由江苏大学于峰惠赠。
1.2 主要试剂与仪器
RPMl-l640培养基、胎牛血清及0.25%胰蛋白酶均购自美国Gibco公司;DH5α感受态细胞、质粒提取试剂盒购自德国Qiagen公司;DNA电泳标记物(Marker)购自日本Takara公司;Lipofectamine 2000购自美国Invitrogen公司;聚凝胺(polybrene)和MTT购自美国Sigma公司;Annexin V-FITC凋亡检测试剂盒和碘化丙啶(PI)均购自上海碧云天生物技术有限公司;D-荧光素(D-Luciferin)购自上海翊圣生物科技有限公司;复合麻醉剂(10 mg/kg甲苯噻嗪,95 mg/kg氯胺酮,0.7 mg/kg乙酰丙嗪)。小动物活体成像系统(IVIS Lumina XR Series III)购自美国珀金埃尔默(PerkinElmer)公司;酶标仪(ELX-800)购自美国Bio-Tek公司;倒置荧光显微镜(Eclipse TS100)购自日本尼康公司。
1.3 实验方法
1.3.1 GFP/Luc双标的人食管癌ECA109细胞系(ECA109-Luc-GFP)的建立
载体构建和慢病毒包装:重组慢病毒载体pCDH-CMV-ffluc-EF1α-CopGFP转化DH5α感受态细胞,根据试剂盒说明书,提取重组DNA。将293T细胞提前一天接种于6孔板的培养孔中,将慢病毒载体pCDH-CMV-ffluc-EF1α-CopGFP、pMD2G和pSPAX2与Lipofectamine2000脂质体混合,室温静置20 min,加入培养基中,6 h后更换新鲜培养基,继续培养。
慢病毒感染:转染4 d后,收集细胞培养上清,并进行病毒滴度测定。将正常ECA109接种于6孔板中,第二天每孔加入6×106单位病毒颗粒。病毒感染后48 h,荧光倒置显微镜下直接观察各孔中GFP的表达。
活体成像系统体外检测Luc的表达:稳定转染细胞(ECA109-Luc-GFP)培养至对数生长期,直接在荧光显微镜下进行观察和检测。同时胰酶消化计数,每孔2×104个ECA109-fluc-GFP细胞和正常ECA109细胞接种于96孔板,正常ECA109细胞作为对照,每孔加入终浓度150 μg/mL的荧光素酶底物(D-荧光素),2~3 min后,置于活体成像系统内成像,检测细胞在体外的Luc的表达情况。
1.3.2 ECA109-Luc-GFP和正常ECA109细胞生物学特性的比较
MTT分析法检测两种细胞活力的差异:每孔1×104个ECA109-Luc-GFP细胞和正常ECA109细胞接种于96孔板,置于5% CO2培养箱孵育48 h,弃上清液,每孔加入MTT(终浓度5 mg/mL)10 μL,置于5% CO2培养箱继续孵育4 h后,每孔加入DMSO 100 μL。酶标仪(吸收波长570 nm)上检测各孔OD值。实验重复3次。
流式细胞仪分析法检测两种细胞增殖和凋亡的差异:每孔5×105个ECA109-Luc-GFP细胞和正常ECA109细胞接种于6孔板,置于5% CO2培养箱孵育48 h后。胰酶消化细胞,并用PBS洗两遍,加入5 μL Annexin V-FITC和10 μL PI,室温避光放置20 min,用流式细胞仪进行细胞凋亡检测。同样的方法,只用10 μL PI染色,进行细胞周期分析。
划痕实验检测两种细胞迁移能力的差异:每孔1×105个ECA109-Luc-GFP细胞和正常ECA109细胞接种于24孔板,置于5% CO2培养箱培养至融合度达90%,用100 μL移液器枪头在培养孔中央划一条直线,继续培养48 h后,置于倒置显微镜下观察拍照。实验重复三次。
1.3.3 肿瘤模型的构建及活体成像观察
食管癌皮下移植瘤构建和活体成像观察:消化ECA109-Luc-GFP细胞,计数,用无菌PBS悬浮,制成单细胞悬液,调整细胞密度为1×107/mL。每只裸鼠右侧腋背部皮下接种0.2 mL细胞(约2×106)。待皮下移植瘤体积达到约100 mm3时,每只裸鼠经腹腔注射复合麻醉剂麻醉后,再按照150 mg/kg的D-荧光素/体重浓度进行腹腔注射。10 min后,放入活体成像仪暗箱内观察。
食管癌转移瘤构建和活体成像观察:消化ECA109-Luc-GFP细胞,计数,用无菌PBS悬浮,制成单细胞悬液,调整细胞密度为1×107/mL。每只裸鼠尾静脉接种0.2 mL细胞(约2×106)。接种10 d后,每只裸鼠经腹腔注射复合麻醉剂麻醉后,再按照150 mg/kg的D-荧光素/体重浓度进行腹腔注射。10 min后,放入活体成像仪暗箱内观察。
1.4 统计学方法
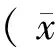
2 结果
2.1 GFP/Luc双标的人食管癌ECA109细胞系(ECA109-Luc-GFP)的建立
利用编码GFP和Luc慢病毒感染人食管癌细胞ECA109,来建立GFP/Luc双标的ECA109细胞系(ECA109-Luc-GFP)。GFP/Luc双标的ECA109-Luc-GFP细胞生长较快,倒置荧光显微镜下观察可见细胞内绿色荧光信号较强,绿色荧光均匀分布于整个细胞内,GFP表达率高于90%,如图1A所示。通过活体成像系统体外检测ECA109-Luc-GFP细胞内Luc的表达,检测结果显示:ECA109-Luc-GFP细胞内可观察到明显的Luc表达,正常ECA109细胞内观察不到Luc表达信号,具体如图1B所示。
2.2 ECA109-Luc-GFP和正常ECA109细胞生物学特性的比较
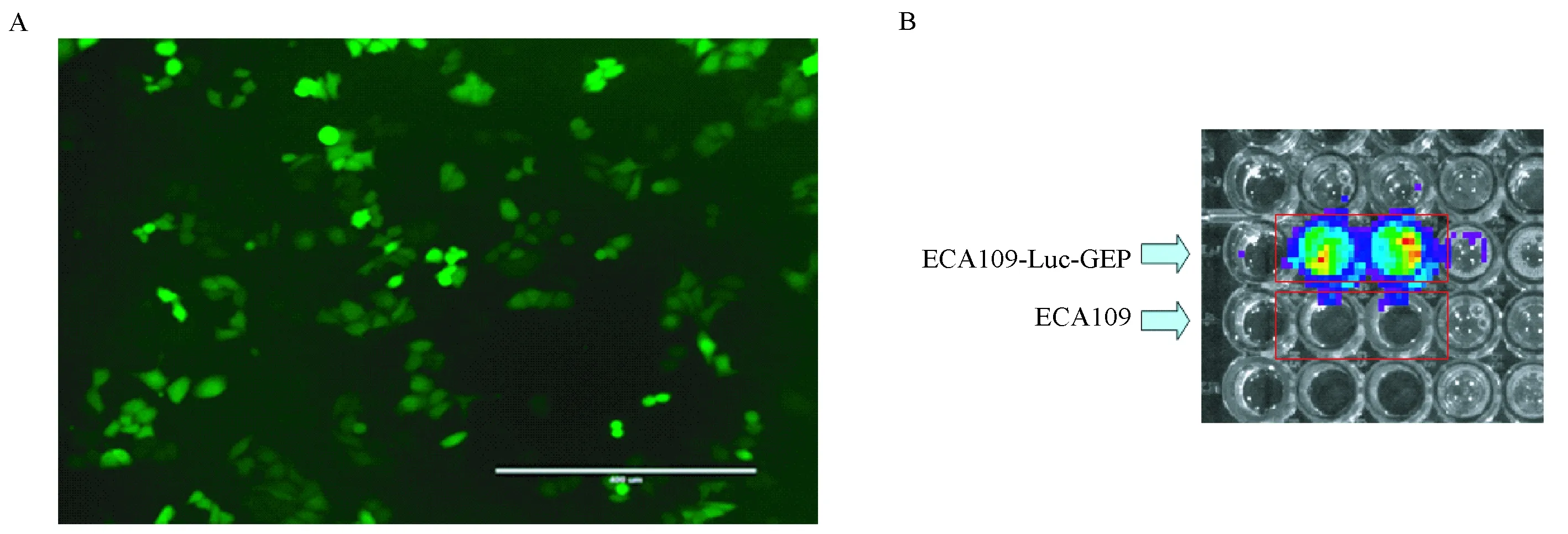
首先通过MTT分析法比较ECA109-Luc-GFP和正常ECA109细胞活力的差异。统计结果显示:与正常ECA109相比,ECA109-Luc-GFP细胞的细胞活力差异无显著性(P>0.05),结果见图2A。其次通过流式细胞仪分析法比较两种细胞细胞周期和凋亡的差异。细胞周期分析结果显示:ECA109和ECA109-Luc-GFP细胞的G1期、S期和G2期所占比例分别约为39%、48%和13%,两者相比差异无显著性(P>0.05),结果见图2B。细胞凋亡分析结果显示:两种细胞的凋亡率均为4%左右,两者相比差异无显著性(P>0.05),结果见图2C。最后,通过划痕实验分析两种迁移能力的差异。划伤48 h后,分析结果显示:两种细胞的愈合率均为45%左右,两者相比差异无显著性(P>0.05),结果见图2D。以上分析结果均显示,GFP/Luc双标的ECA109-Luc-GFP细胞与正常ECA109细胞相比,细胞生物学特性无差异,说明GFP/Luc双标没有改变ECA109细胞的生物学特性。
注:A:倒置荧光显微镜下ECA109-Luc-GFP细胞观察GFP的表达,标尺为400 μm。B:活体成像系统体外检测ECA109-Luc-GFP细胞内Luc的表达。图1 GFP/Luc双标的人食管癌ECA109细胞系(ECA109-Luc-GFP)的建立Note. A: GFP expression in ECA109-Luc-GFP cells was observed under an inverted fluorescence microscope. Bar=400 μm. B: Luc expression in ECA109-Luc-GFP cells was observed by in vivo imaging.Figure 1 Establishment of a GFP/Luc double-labeled esophageal cancer cell line (ECA109-Luc-GFP)
注:A:MTT分析法比较ECA109-Luc-GFP和正常ECA109细胞活力的差异。B:流式细胞仪分析法比较ECA109-Luc-GFP和正常ECA109细胞周期的差异。C:流式细胞仪分析法比较ECA109-Luc-GFP和正常ECA109细胞凋亡的差异。D:划痕实验比较ECA109-Luc-GFP和正常ECA109细胞迁移能力的差异。标尺为400 μm。图2 ECA109-Luc-GFP和正常ECA109细胞生物学特性的比较Note. A: MTT assay was used to analyze the difference in cell viability of ECA109-Luc-GFP and parental cells. B: Flow cytometry was used to analyze the difference in the cell cycle of ECA109-Luc-GFP and parental cells. C: Flow cytometry was used to analyze the difference in apoptosis of ECA109-Luc-GFP and parental cells. D: Wound healing assay was used to analyze ECA109-Luc-GFP and parental cells. Bar=400 μm.Figure 2 Comparison of the biological characteristics of ECA109-Luc-GFP and parental cells
2.3 肿瘤模型的构建及活体成像观察
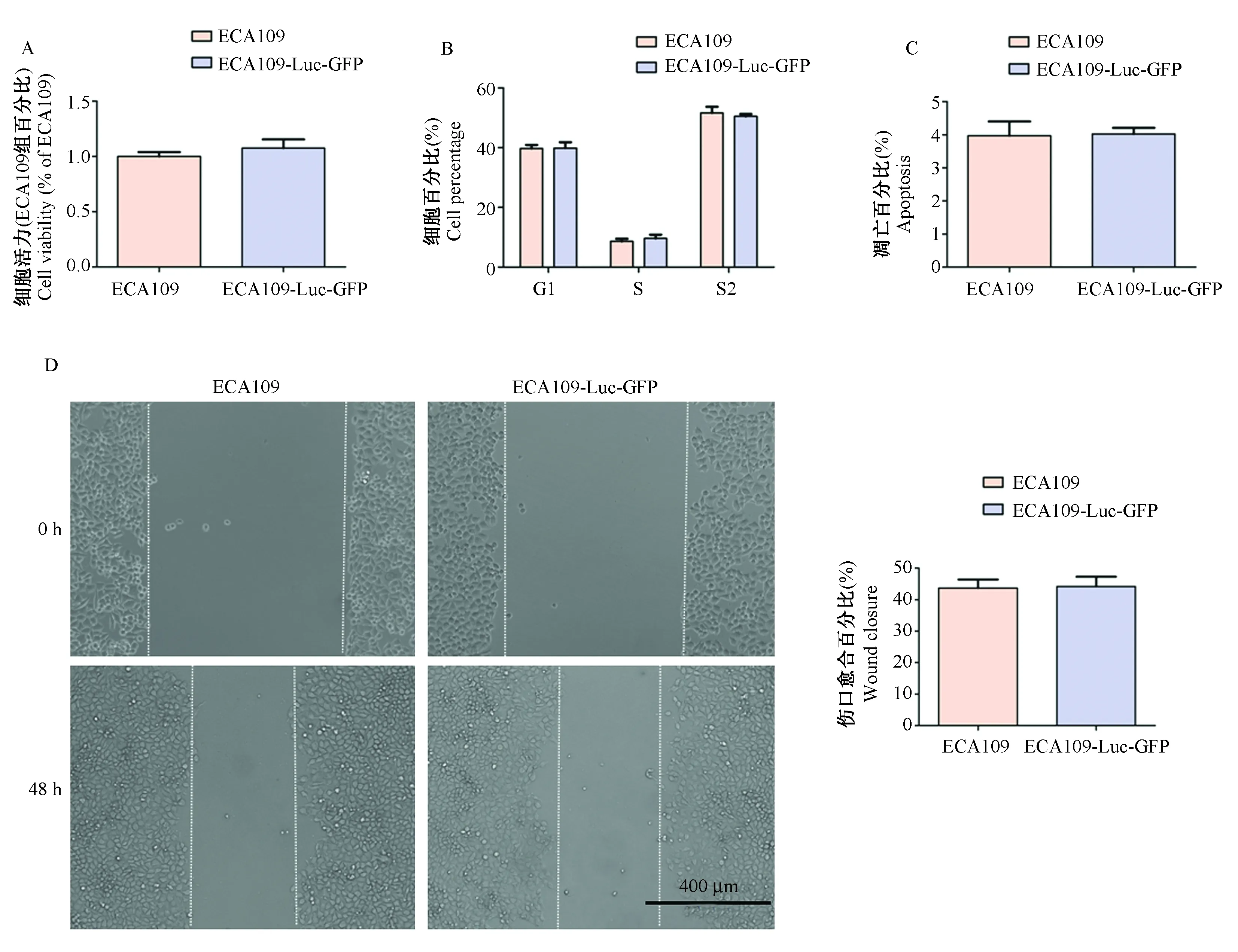
食管癌皮下移植瘤构建后活体成像观察结果显示:裸鼠皮下种植ECA109-Luc-GFP细胞后,当皮下移植瘤体积达到约100 mm3时,可以明显地观察到强烈荧光,而移植正常ECA109细胞的裸鼠未见荧光信号。具体见图3A。食管癌转移瘤构建后活体成像观察结果显示:裸鼠经尾静脉注射ECA109-Luc-GFP细胞后10 d,可以观察到小鼠肺部出现强烈荧光信号,而注射正常ECA109细胞的裸鼠未观察到荧光信号,结果见图3B。结果提示,食管癌细胞经尾静脉注射后,主要转移集中生长于小鼠肺部。
注:A:食管癌皮下移植瘤构建后活体成像观察结果。B:食管癌转移瘤构建后活体成像观察结果。左侧裸鼠为注射正常ECA109细胞,右侧裸鼠为注射ECA109-Luc-GFP细胞。图3 肿瘤模型的构建及活体成像观察Note. A: Observation by in vivo imaging of esophageal cancer xenografts established by subcutaneous injection. B: Observation by in vivo imaging of esophageal cancer xenografts established by tail vein injection. The left nude mouse was injected with parental ECA109 cells. The right nude mouse was injected with ECA109-Luc-GFP cells.Figure 3 Cancer xenograft establishment and observation by in vivo imaging
3 讨论
我们通过慢病毒转导构建了稳定表达Luc和GFP的人食管癌ECA109细胞系,用于皮下肿瘤模型以及肿瘤转移模型的构建。实际上,原位肿瘤模型与人类肿瘤微环境相近,与人类疾病进展密切相关,是最理想的动物模型。但由于小鼠食管的解剖位置以及建立原位模型的技术难度,往往难以实现[3]。绿色荧光蛋白基因(GFP)和荧光素酶基因(Luc)作为常用的报告基因(即其表达产物非常容易鉴定),可在异源组织中表达并发光,是理想的标记物[4]。由于自身发光特性的缺陷,其应用往往具有一定的局限性。其中,GFP单标需要光的激发才能发出波长较长的可见光,并且由于生物体内发光的干扰,不能保证特异性,仅可用于浅表组织的检测。同时,除了荧光素酶及其底物之外,还需要氧和ATP,因此仅能标记代谢活性肿瘤细胞。通过将GFP标记技术与Luc标记技术相结合,一定程度上弥补了其局限性。
在本研究中,我们用携带Luc-GFP的慢病毒感染人食管癌细胞,48 h后观察GFP表达情况,GFP感染效率可达80%以上,我们挑选表达GFP的单克隆株进行培养增殖,并通过体外活体成像实验检测到生物发光信号,证明用慢病毒转染方法,能够构建稳定表达GFP和Luc的人食管癌细胞系(ECA109-Luc-GFP)。实验所采取的ECA109-Luc-GFP细胞均为感染后传5代以上的细胞,GFP/Luc双标的ECA109-Luc-GFP细胞系非常稳定,并且显微镜下观察传代后2种发光信号的强度没有发生变化。
本研究中,活体成像技术准确直观的反映了肿瘤的生长和转移,为肿瘤负荷的测量提供了快速而有效的方法。在体内食管癌模型研究中,活体成像与传统方法相比具有明显优势,首先,作为一种非侵入性成像技术,活体成像技术可以采集同一动物的动态数据,减少了实验动物数量。其次,三只甚至五只小鼠可以同时成像。但是在整个身体仅出现微弱荧光信号时,为了提高灵敏度,每次只能成像一个或两个动物,并且将动物放置在靠近相机的位置[5]。第三,与其他检测手段相比,提供了治疗效果的相对评估,因为它仅代表代谢活性肿瘤细胞,而不是肿瘤体积[6]。第四,可以作为肿瘤细胞是否成功植入的指标,从而排除了可能由于异种移植不成功所导致药物的不良反应。
活体成像技术为肿瘤的早期发展,治疗反应,肿瘤复发,转移性肿瘤和自发性肿瘤等动态生物学过程提供了一种良好的研究平台,并且是监测体内抗肿瘤药物治疗效果的理想方法。活体成像技术应用潜力很大,本实验中所提供的方法,有待进一步完善。活体成像技术仅在二维平面上以表面加权的方式收集肿瘤信号,这意味着靠近表面的较弱的光源与深层组织中较强的光源将具有相同的光强度[7]。因此,可以尝试配合生物发光断层扫描(BLT),重建三维生物发光分布,监测肿瘤进展期间的立体形态和发光信号变化[8]。由于生物组织具有强散射和低吸收的特性,从而表现出各种光学行为,包括吸收、散射、反射和传播等,导致图像分辨率较低。通过改进现有的成像系统和降噪方法可以帮助获得更高分辨率的图像[9]。底物荧光素可通过腹腔、静脉或皮下注射。每一种方法都有其优点和缺点,应针对不同情况,采用不同的注射方法[10]。静脉注射可以使生物发光快速产生,因为底物能立即达到最大的血液浓度。然而,在处理动物时,静脉注射在技术上具有一定难度。腹腔内注射操作简单,在大多数肿瘤模型中,在5~10 min内可以获得生物发光峰值。皮下注射也可用于全身传递,但生物发光缓慢。Genevois等人提出了iRFP/Luc双标技术用于活体成像监测,同样结合了两种报告基因的优势,扩大了活体成像的应用范围[11]。
本文将GFP/Luc双标技术与活体成像技术相结合,对食管癌裸鼠肿瘤模型进行活体的动态示踪,清晰了解食管癌的生物学行为及特性,快速准确、简便灵敏,为抗食管癌药物研发、基因治疗效果验证提供了新思路。

