牡丹叶片红色消退过程中色素变化及相关基因表达分析
段晶晶,罗建让,李 想,张庆雨,张延龙
(西北农林科技大学 风景园林艺术学院,陕西杨陵 712100)
植物器官,比如花瓣、果实和叶片的呈色主要是由于植物体中积累的色素所导致的。植物体中主要有3类色素:类黄酮、叶绿素和类胡萝卜素[1-2]。叶绿素包括叶绿素a和叶绿素b,是植物绿色器官呈色的主要色素。类胡萝卜素通常和叶绿素共同存在于植物的叶片中,使植物呈现黄色至橘色[3-5]。类黄酮主要包括花青素、黄酮醇、原花青素等[1],它们能使植物的花瓣、叶片、果实、种子及其他组织呈现橘黄、红色至蓝色等一系列的颜色。其中,花青素是主要的色素物质,黄酮醇作为辅助色素也发挥着重要作用[6-7]。
类黄酮的合成代谢主要受两类基因控制:一类是结构基因,它们直接编码类黄酮生物合成酶类物质,其中包括查耳酮合成酶基因(CHS)、查耳酮异构酶基因(CHI)、黄烷酮羟化酶基因(F3H)、类黄酮羟化酶基因(F3′H)、二氢黄酮醇还原酶基因(DFR)、花青素合成酶基因(ANS)、黄酮醇合成酶基因(FLS)、无色花青素还原酶基因(LAR)、花青素还原酶基因(ANR)等;另一类是调节基因(转录因子基因),它们能够调节类黄酮生物合成结构基因表达的强度、程式以及色素在空间和时间上的积累[8]。近年来的研究表明,类黄酮的生物合成过程主要受转录水平的调控。主要有3大类转录因子参与了类黄酮合成的调控,它们分别为 MYB、bHLH、WD40。在这3类转录因子中,MYB是调控类黄酮生物合成的主要转录因子,而bHLH、WD40通常作为辅助转录因子,与MYB蛋白形成复合体,增强MYB转录因子对类黄酮合成的调控能力[9-10]。
牡丹(Paeoniasuffruticosa)是中国的十大传统名花之一,享有国色天香的美誉。然而牡丹花期短且集中,因此具有更长观赏时间的彩色叶牡丹品种培育将是今后牡丹育种的一个重要方向。作为春色叶植物,牡丹新生叶片呈现紫红色,随着叶片的发育,紫红色逐渐褪去。通过对牡丹春季叶片红色消退机制的研究将有助于人们采取相应措施干扰该过程,进而培育红色叶牡丹品种。目前,在牡丹上,人们的研究多集中在牡丹花瓣类黄酮色素成分分析及相关基因克隆[11-14]、籽油成分分析及籽油提取工艺研究[15-16],而对牡丹春季叶片红色消退过程中色素水平及相关基因的研究未见报道。
本研究以牡丹品种‘满园春光’叶片为材料,通过紫外分光光度法,测定了牡丹春季叶片红色消退过程中不同时期叶片中花青素、原花青素、黄酮醇、叶绿素及类胡萝卜素含量,根据课题组前期转录组数据筛选得到的类黄酮合成相关结构基因与转录因子基因的序列设计引物,利用荧光定量PCR检测类黄酮生物合成相关结构基因与转录因子基因的表达量,明确二者在牡丹叶片红色消退过程中与相应色素含量的相关性,探究类黄酮生物合成相关基因的表达对牡丹春季叶片红色消退的影响,为全面解析牡丹春季叶片红色消退分子机制的研究提供基础数据,也为日后采用分子手段进行红色叶牡丹品种定向培育提供基因资源。
1 材料和方法
1.1 植物材料
本试验以生长在西北农林科技大学牡丹资源圃中的牡丹品种‘满园春光’为研究材料。于2017年3月至4月采集牡丹‘满园春光’4个不同叶色时期(S1,叶正面、叶背面均为紫红色;S2,叶正面仅叶边缘为紫红色,叶基部有黄绿色显现,叶背面为紫红色;S3,叶正面紫红色完全消失,叶背面仅叶边缘为紫红色;S4,叶片完全呈现出黄绿色)的叶片样本。为避免其他生物体(节肢动物、真菌、细菌)对基因表达的影响,仅采集健康的、无菌无病虫害的组织。所有的叶片样本采集后用锡箔纸包好,立即用液氮冷冻,然后保存在-80 ℃冰箱用于后续RNA提取以及叶片中色素含量的测定。
1.2 叶色表型测定
分别使用英国皇家园艺学会比色卡(Royal Horticultural Society Colour Chart,RHSCC)及色差仪(CR-400,Japan)对牡丹‘满园春光’不同时期的叶片颜色进行定性和定量分析。通过测定颜色参数明度(L*)、红度(a*)及蓝度(b*)值,计算出色度(C*),计算公式为C*=[(a*)2+(b*)2]1/2。每个时期的叶片重复测定3次。
1.3 叶片色素的提取与测定
1.3.1叶绿素及类胡萝卜素称取约0.1 g 的叶片样品,将叶片于液氮中研磨成粉末,加入10 mL 80% 丙酮,超声波提取30 min,然后置于4 ℃冰箱密闭黑暗萃取24 h,12 000 r/min离心10 min,取上清液,过滤定容至10 mL。用酶标仪测定440、645和663 nm波长下的吸光度值,并计算叶绿素、类胡萝卜素的含量。设置3个生物学重复。
1.3.2花青素及黄酮醇用1%盐酸甲醇配制0.1 mg·mL-1矢车菊素-3-葡糖苷(Cy-3)标准液和2 mg·mL-1芦丁(Rutin)标准液,准确吸取标准液0、0.1、0.2、0.4、0.6、0.8、1.0 mL置于10 mL离心管中,1%盐酸甲醇定容至10 mL,以0 号为空白,分别测定上述标准溶液在波长530和350 nm处的吸光度。以标准液浓度为x轴,吸光度值为y轴,绘制标准曲线。
将叶片于液氮中研磨成粉末,称取约0.1 g叶片样品,加入10 mL 1% 盐酸甲醇 ( 97 mL 甲醇+3 mL 36% 盐酸),超声波提取30 min,然后置于4 ℃冰箱密闭黑暗萃取24 h,12 000 r/min离心10 min,取上清液,过滤定容至10 mL。用酶标仪测定530和350 nm波长下的吸光度,根据标准曲线,计算花青素及黄酮醇的含量。设置3个生物学重复。
1.3.3原花青素将叶片置于研钵中,用液氮将其研磨成粉末,称取约0.1 g叶片粉末,加入1 mL 60%乙醇,用超声提取法进行提取,超声功率300 W,破碎5 s,间歇8 s,提取30 min,25 ℃ 12 000 r/min离心10 min,吸取上清液,过滤,60%乙醇定容至1 mL。用60%乙醇提取液将原花青素标准品配成10 mg·mL-1母液,标准液梯度稀释为5、2.5、1.25、0.625、0.312 5、0.156、0.078、0.039、0.02、0.01 mg·mL-1的标准溶液。根据植物原花青素含量检测试剂盒(Solarbio)使用说明书,分别对空白管(40 μL H2O+160 μL工作液)、标准管(40 μL标准液+160 μL工作液)、测定管(40 μL样本+160 μL工作液)和对照管(40 μL样本+160 μL H2O)加样,工作液为11%盐酸与香草醛1∶1混合液。混匀后,30 ℃水浴30 min,立即于96孔板中检测500 nm处吸光度值,计算ΔA测定=A测定管-A对照管,ΔA标准=A标准管-A空白管。以ΔA标准为y轴,标准溶液浓度为x轴绘制标准曲线。根据标准曲线得到样品浓度,计算出原花青素含量。设置3个生物学重复。
1.4 牡丹叶片总RNA提取与cDNA合成
采用北京天根公司的RNAprep Pure多糖多酚植物总RNA提取试剂盒,对牡丹‘满园春光’4个不同时期的叶片进行总RNA提取。分光光度计测定其浓度及凝胶电泳检测其完整性之后,以1 μg总RNA为模板,参照PrimeScriptTMRT reagent Kit with gDNA Eraser的说明书进行反转录,合成cDNA第一链。首先,加入2 μL 5×gDNA Eraser Buffer、1 μL gDNA Eraser以及相应体积的RNA,ddH2O补足至10 μL,42 ℃ 2 min以去除基因组DNA;第二步,进行反转录反应,加入10 μL第一步反应液,1 μL PrimeScriptRTEnzyme Mix I,1 μL RT Primer Mix,4 μL 5×PrimeScript Buffer 2,4 μL RNase-Free dH2O,总反应体系为20 μL,PCR程序设置为:37 ℃ 15 min;85 ℃ 5 s;4 ℃保存。
1.5 qRT-PCR表达分析
为研究牡丹‘满园春光’叶片类黄酮生物合成途径中结构基因与转录因子基因的表达对叶色的影响。根据课题组前期转录组数据筛选的可能与叶片类黄酮合成相关的5个转录因子(PsMYB113、PsMYB4、PsMYBF1、PsbHLH1、PsWD40-1)基因序列以及注释为CHS、CHI、F3H、F3′H、DFR、ANS、FLS、LAR、ANR的基因序列[17],设计实时定量PCR特异性引物,以Ubiquitin为内参基因,进行实时定量PCR(表1)。以反转录得到的牡丹‘满园春光’不同时期叶片(S1~S4)的cDNA作为模板,参照TaKaRa公司的荧光定量试剂盒SYBR®Premix ExTaqTMⅡ说明书,在Step One Plus荧光定量PCR仪上检测牡丹‘满园春光’不同时期叶片中的转录因子基因与结构基因的相对表达量。反应体系(20 μL)为:SYBR®Premix ExTaqTMⅡ 10 μL,PCR上游、下游引物(10 μmol·L-1)各0.8 μL,cDNA模板0.8 μL,ROX染液0.4 μL,ddH2O 7.2 μL,反应程序为:95 ℃,30 s;95 ℃ 5 s,55 ℃ 30 s,72 ℃ 30 s,40个循环。溶解曲线由软件自动生成,使用2-ΔΔCT方法计算基因相对表达水平,设置3个生物学重复。
2 结果与分析
2.1 牡丹‘满园春光’春季叶色特征
牡丹‘满园春光’的叶片在春季呈现出明显的颜色变化,其新生叶片为紫红色,随着叶片发育,紫红色消失,黄绿色逐渐形成,并且叶正面和叶背面呈现出2种不同的颜色变化(图1)。为明确牡丹不同时期的叶色表型,分别采用RHSCC和色差仪对牡丹‘满园春光’4个不同发育时期的叶片颜色进行定性和定量描述,其中L*为明度,L*值越大表示亮度越高;a*为红度,+a*表示偏红,-a*表示偏绿;b*为蓝度,+b*表示偏黄,-b*表示偏蓝,结果如表2所示。叶背面与叶正面的L*、a*、b*、C*值基本呈现出一致的变化趋势。其中,两者的L*、b*值随着叶片的发育逐渐升高,在S4时期达到最高,而叶片b*值的升高则表明随着叶片的发育叶片颜色逐渐变黄;叶片a*值呈现出逐渐降低的趋势,并在叶片发育初期时最大,叶片颜色最红,随着叶片发育a*值降低,叶片颜色也逐渐变绿,这与肉眼所见的颜色变化规律基本一致;叶片C*值随着叶片发育则呈现出先降低后升高的趋势,在S4时期最高。总体而言,牡丹‘满园春光’叶背面的L*、a*值要高于叶正面,而b*、C*值则低于叶正面(表2)。

表1 牡丹‘满园春光’荧光定量表达分析所用引物

S1.叶正面、叶背面均为紫红色;S2.叶正面仅叶边缘为紫红色,叶基部有黄绿色显现,叶背面为紫红色;S3. 叶正面紫红色完全消失,叶背面仅叶边缘为紫红色;S4.叶片完全呈现出黄绿色;下同图1 牡丹‘满园春光’不同叶色时期的叶片表型S1. Both the adaxial (upper) and abaxial (lower) surface of leaves were purplish-red; S2. The abaxial (lower) surface of leaves and the edge on the adaxial (upper) surface of leaves were purplish-red, the leaf base on the adaxial (upper) surface of leaves were yellow-green; S3. The purplish-red on the adaxial (upper) surface of leaves was completely disappeared, only the edge on the abaxial (lower) surface of leaves were purplish-red; S4. The leaves were completely appeared yellow-green. The same as belowFig.1 The leaf phenotype of P. suffruticosa ‘Manyuan Chunguang’ in different leaf color stages
2.2 牡丹春季叶片不同发育时期各类色素含量
对牡丹‘满园春光’不同发育时期叶片中叶绿素、类胡萝卜素、花青素、原花青素及黄酮醇含量测定,结果如图2所示。首先,牡丹‘满园春光’叶片中的黄酮醇含量呈现先上升后略微下降的趋势,其含量从S1至S3时期逐渐升高,并且在S3时期达到最高(10.34 mg·g-1);S4时期的黄酮醇含量低于S3时期,但仍显著高于前2个时期。其次,叶片花青素含量在前2个叶色时期都相对较高,且在S2时期最高(1.37 mg·g-1),而在后2个时期(S3、S4)相对较低,并以S4时期最低(0.18 mg·g-1),S2时期叶片中花青素含量约为S4时期的7.6倍,这与肉眼所观察到的叶片颜色变化基本一致,表明叶片颜色表型的变化与叶片中花青素含量的变化正相关。再次,叶片中原花青素含量从S1至S4时期呈现出逐渐下降的趋势,其含量在S1最高,S4最低,且各叶色时期之间均差异显著。最后,牡丹叶片叶绿素和类胡萝卜素含量均随着牡丹叶片的发育而逐渐升高,并在S4时期达到最高值,分别为2.23和0.41 mg·g-1。可见,牡丹‘满园春光’春季叶片发育初期呈现紫红色是由于叶片中含有大量的花青素,而含少量叶绿素和类胡萝卜素;在叶片发育后期,由于叶片中花青素合成减少,叶绿素、类胡卜素及黄酮醇的大量合成,从而导致紫红色褪去,黄绿色显现。
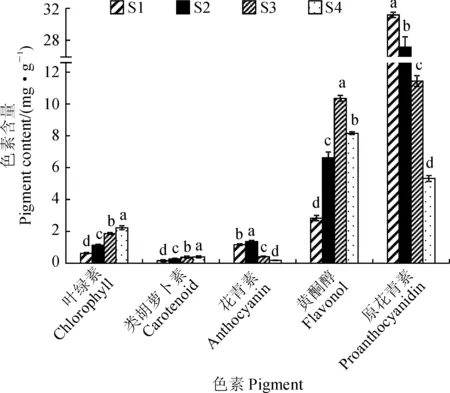
不同小写字母表示叶色时期间Duncan检验在0.05水平有显著性差异;下同图2 牡丹‘满园春光’不同叶色时期叶片中的色素含量The different normal letters indicate significant difference among stages at 0.05 level by Duncan test. The same as belowFig.2 The pigment contents at different color stages of P. suffruticosa ‘Manyuan Chunguang’ leaves
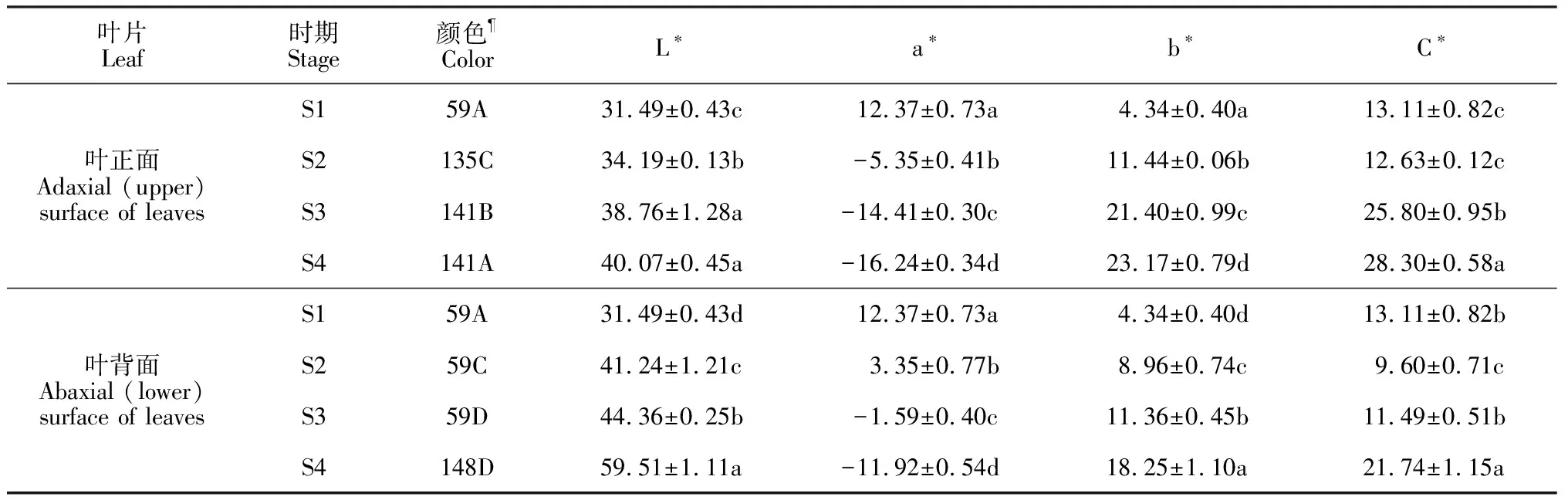
叶片Leaf时期Stage颜色ColorL∗a∗b∗C∗叶正面Adaxial (upper) surface of leavesS159A31.49±0.43c12.37±0.73a4.34±0.40a13.11±0.82cS2135C34.19±0.13b-5.35±0.41b11.44±0.06b12.63±0.12cS3141B38.76±1.28a-14.41±0.30c21.40±0.99c25.80±0.95bS4141A40.07±0.45a-16.24±0.34d23.17±0.79d28.30±0.58a叶背面Abaxial (lower) surface of leavesS159A31.49±0.43d12.37±0.73a4.34±0.40d13.11±0.82bS259C41.24±1.21c3.35±0.77b8.96±0.74c9.60±0.71cS359D44.36±0.25b-1.59±0.40c11.36±0.45b11.49±0.51bS4148D59.51±1.11a-11.92±0.54d18.25±1.10a21.74±1.15a


2.3 类黄酮合成相关结构基因在牡丹不同时期叶片中的表达模式
为探究类黄酮合成相关结构基因与牡丹叶色之间的关系,利用实时荧光定量PCR测定了类黄酮生物合成途径中9个结构基因在不同时期叶片中的表达量,结果见图3。首先,PsCHS、PsCHI、PsF3H、PsF3′H、PsDFR、PsANS基因相对表达量在牡丹叶片不同发育时期均基本呈现出相同的先升高后降低的变化趋势,并均在S2时期达到最大值。其中PsCHS、PsCHI、PsDFR、PsANS基因表达量均在S4时期最低,且除PsCHI外均显著低于前3个时期的表达量,而PsF3H、PsF3′H的表达量在S1时期最低,均显著低于后期(S2~S4)的表达量。PsDFR、PsANS在S2时期表达量最高,其次为S1和S3时期,S4时期的表达量最低,这与叶片花青素含量的变化趋势一致,且呈极显著正相关(表3),表明PsDFR、PsANS可能是牡丹叶片花青素合成的重要结构基因。其次,PsANR基因的表达量从S1到S4时期呈现出逐渐降低的趋势,与原花青素含量的变化趋势一致,呈极显著正相关,而与黄酮醇含量、花青素含量呈极显著负相关(表3),说明PsANR可能是牡丹叶片中原花青素合成的重要结构基因。再次,PsLAR基因的相对表达量从S1到S4时期呈现出逐渐上升的趋势,其表达量在S1时期最低,S4时期最高,且各发育时期间差异显著。同时,PsLAR基因的相对表达量与花青素含量、原花青素呈极显著负相关(表3)。另外,PsFLS基因的表达量从S1到S3逐渐升高,在S4时期时低于S3时期,但是高于前2个时期,且与叶片中黄酮醇含量的变化趋势呈极显著正相关,而与花青素含量、原花青素含量呈显著负相关(表3),表明PsFLS可能是牡丹叶片黄酮醇合成的重要结构基因。
2.4 类黄酮合成相关转录因子基因在牡丹不同时期叶片中的表达模式
由图4可知,PsMYBF1相对表达量在S1时期最低,在S3时期的表达量最高,S3时期的表达量约为S1时期的2.5倍,S4时期的表达量略低于S3时期。PsMYBF1表达量在叶片不同发育时期的变化趋势与叶片中黄酮醇含量、PsFLS表达量的变化呈显著正相关(表4),这表明PsMYBF1可能在牡丹叶片黄酮醇生物合成过程中有重要调控作用。同时,PsMYB113的表达量在牡丹叶片发育过程中呈现先上升后下降的趋势,并在S2时期最高,在S4时期表达量最低,S2时期的表达量约为S4时期的25倍,而S1、S3时期的表达量显著低于S2时期,但显著高于S4时期。总体而言,PsMYB113在牡丹叶片红叶期的表达量相对较高,而在绿叶期的表达量相对较低,其表达模式与牡丹叶片中花青素含量、PsDFR、PsANS表达量的变化趋势一致,且呈显著正相关(表4),表明PsMYB113可能对牡丹叶片花青素合成起正向调控作用。再次,PsMYB4的表达量从S1到S4时期呈现出逐步上升的趋势,其表达量在S1时期最低,S4时期最高,S4时期的表达量约为S1时期的5倍,与叶片中花青素、PsDFR、PsANS表达量呈良好的负相关性(表4),表明PsMYB4可能对牡丹叶片花青素合成起负向调控作用。另外,PsbHLH1在S2时期的表达量最高,在S1和S3时期的表达量差异不显著,但均显著高于S4时期。PsWD40-1的表达量在S3时期最高,S4时期最低,总体呈现先升高后下降的趋势,且在各叶色时期间均差异显著。
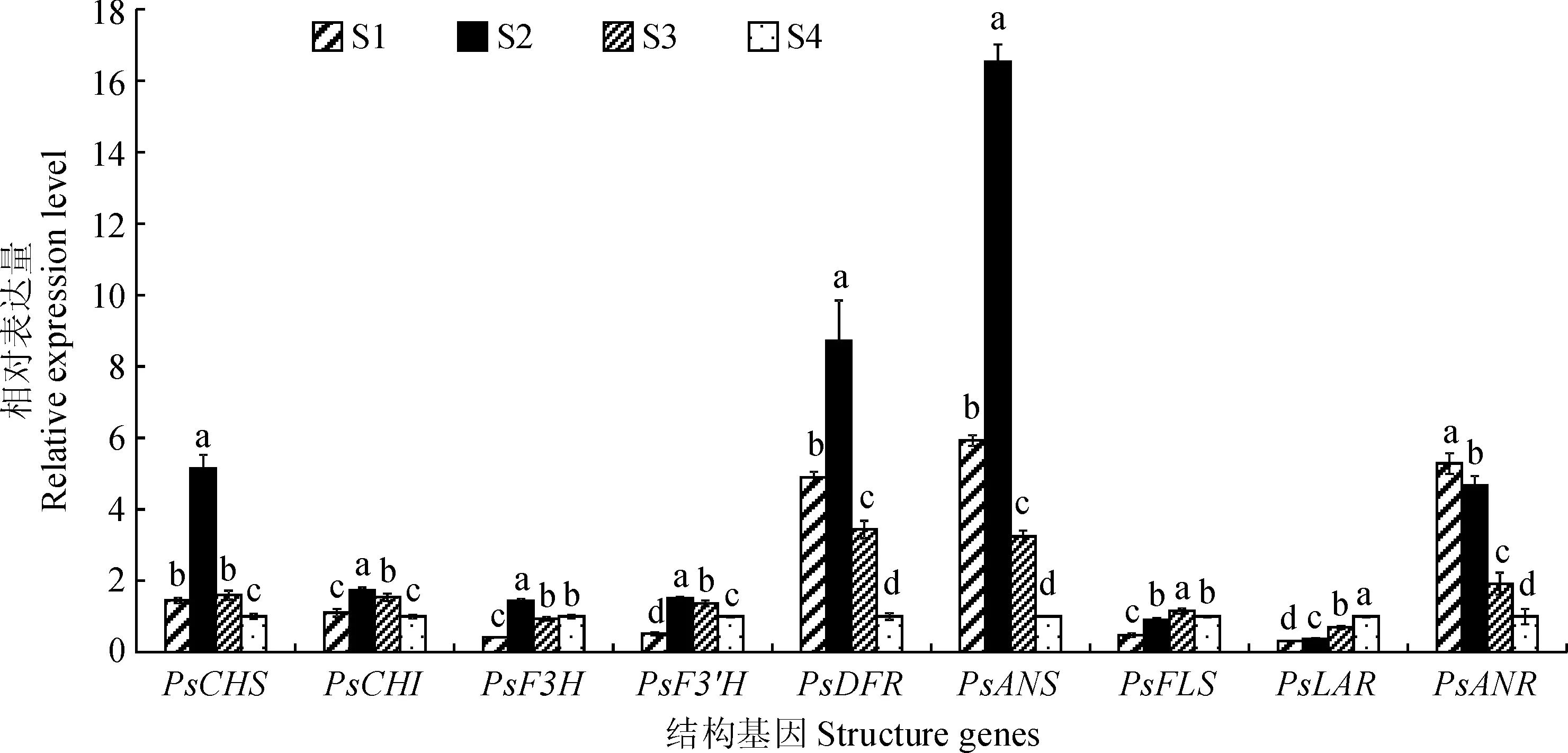
图3 牡丹‘满园春光’不同叶色时期叶片中类黄酮合成结构基因的相对表达量Fig.3 Expression pattern of structure genes involved in flavonoid synthesis at different color stages in P. suffruticosa ‘Manyuan Chunguang’ leaves

类黄酮Flavonoid结构基因Structure genePsCHSPsCHIPsF3HPsF3′HPsDFRPsANSPsFLSPsLARPsANR黄酮醇 Flavonol0.0800.317 0.523 0.714∗∗-0.339-0.281 0.984∗∗0.677∗-0.809∗∗花青素Anthocyanin 0.714∗∗0.442 0.078-0.190 0.913∗∗ 0.860∗∗-0.607∗-0.948∗∗-0.949∗∗原花青素Proanthocyanidin 0.5020.259-0.201-0.262 0.685∗ 0.686∗-0.668∗-0.977∗∗0.990∗∗
注:**和*分别表示在0.01和0.05水平上显著相关;下同
Note:**and * indicate significant correlation at 0.01 and 0.05 levels, respectively. The same as below
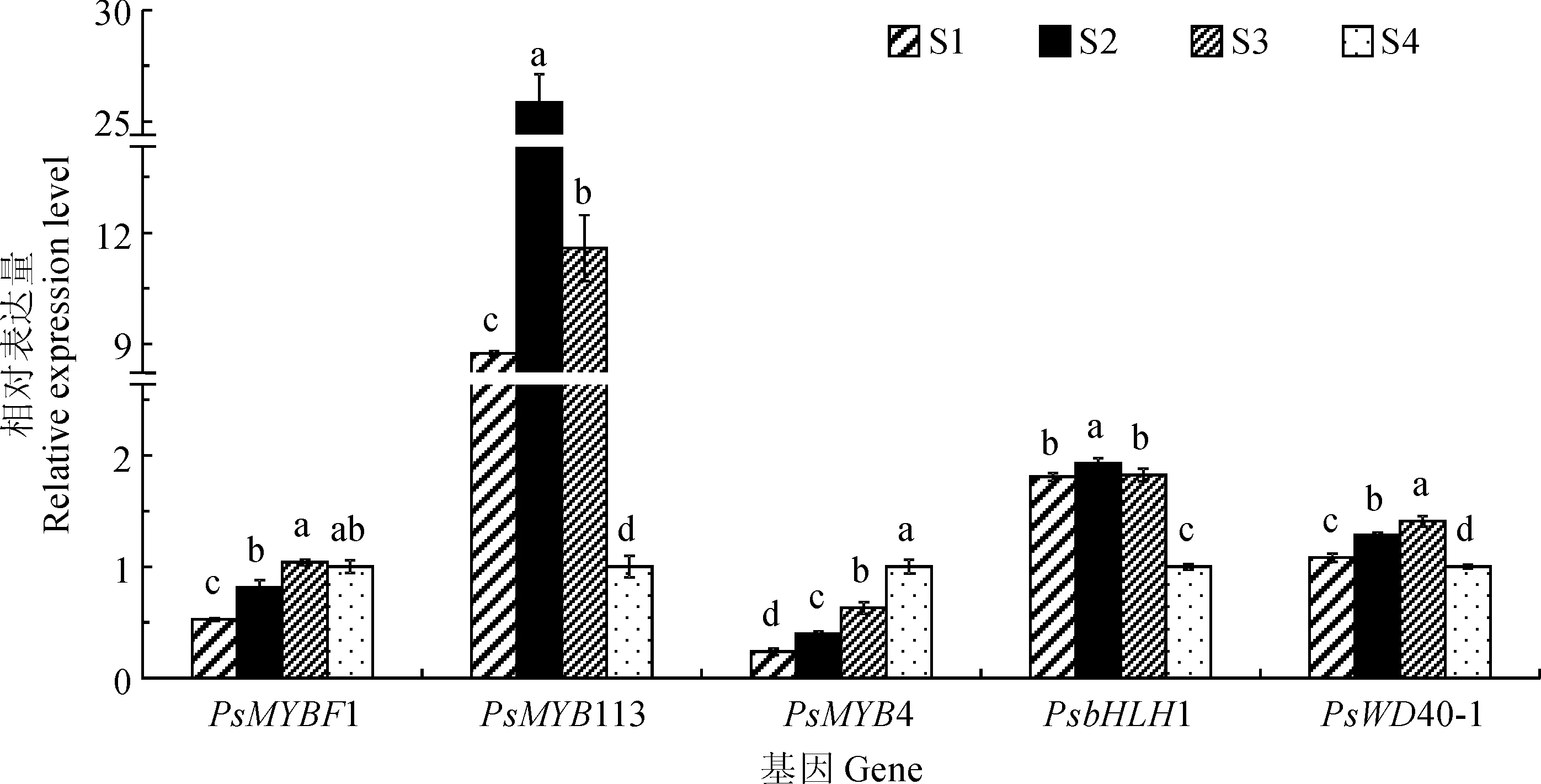
图4 牡丹‘满园春光’不同叶色时期叶片中转录因子基因的表达量Fig.4 Expression pattern of transcription factor gene at different color stages in P. suffruticosa ‘Manyuan Chunguang’ leaves
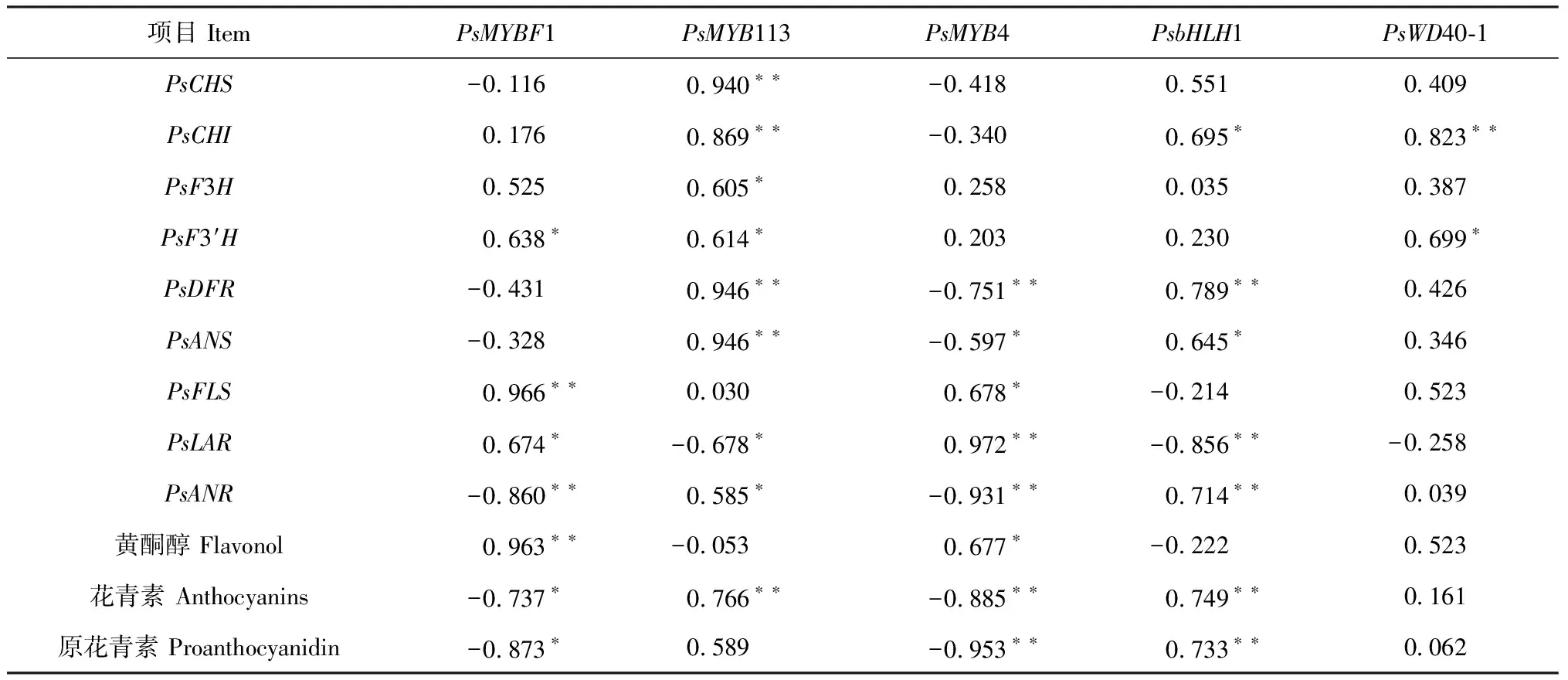
项目 ItemPsMYBF1PsMYB113PsMYB4PsbHLH1PsWD40-1PsCHS-0.1160.940∗∗-0.4180.5510.409PsCHI0.1760.869∗∗-0.3400.695∗0.823∗∗PsF3H0.5250.605∗0.2580.0350.387PsF3′H0.638∗0.614∗0.2030.2300.699∗PsDFR-0.4310.946∗∗-0.751∗∗0.789∗∗0.426PsANS-0.3280.946∗∗-0.597∗0.645∗0.346PsFLS0.966∗∗0.0300.678∗-0.2140.523PsLAR0.674∗-0.678∗0.972∗∗-0.856∗∗-0.258PsANR-0.860∗∗0.585∗-0.931∗∗0.714∗∗0.039黄酮醇 Flavonol0.963∗∗-0.0530.677∗-0.2220.523花青素 Anthocyanins-0.737∗0.766∗∗-0.885∗∗0.749∗∗0.161原花青素 Proanthocyanidin-0.873∗0.589-0.953∗∗0.733∗∗0.062
3 讨 论
类黄酮代谢过程受多个结构酶基因的控制,如CHS、CHI、F3H、F3′H、FLS、DFR、ANS等。其中,FLS催化二氢黄酮醇合成相对应的黄酮醇类物质,DFR催化二氢黄酮醇形成无色花青素,ANS催化无色花青素形成有色花青素。现有研究表明,DFR、ANS等类黄酮合成后期结构基因是控制花青素合成的关键基因,而FLS是控制黄酮醇合成的关键基因[18-19]。FLS和DFR之间存在着竞争关系,二者竞争同一底物二氢黄酮醇(图5)。大量研究表明,DFR和FLS基因的表达,关系着花青素合成途径和黄酮醇合成途径对代谢流的竞争,影响各自支路的代谢强弱,最终影响着花青素苷和黄酮醇的生成量[20]。在矮牵牛(Petuniahybrida)中,将FLS基因反义表达,降低了矮牵牛花瓣中的黄酮醇含量,同时增加了花青素的含量[21]。在烟草中过表达海棠(Maluscrabapple)、玫瑰(Rosarugosa)、桃(Prunuspersica)、金花茶(Camellianitidissima)中的FLS基因,其转基因植物体内黄酮醇含量显著升高,而花青素含量则显著降低,颜色变浅,而过表达DFR基因则会下调内源FLS基因的表达量,降低黄酮醇含量,同时增加了花青素含量,使植物体颜色变深[22-23]。由此推测,PsDFR、PsANS在牡丹叶片发育后期的低表达,影响了叶片中花青素的合成与积累。同时,PsFLS在后期的高表达促使大部分二氢黄酮醇朝着黄酮醇途径的方向发展,叶片中合成大量的黄酮醇类物质。
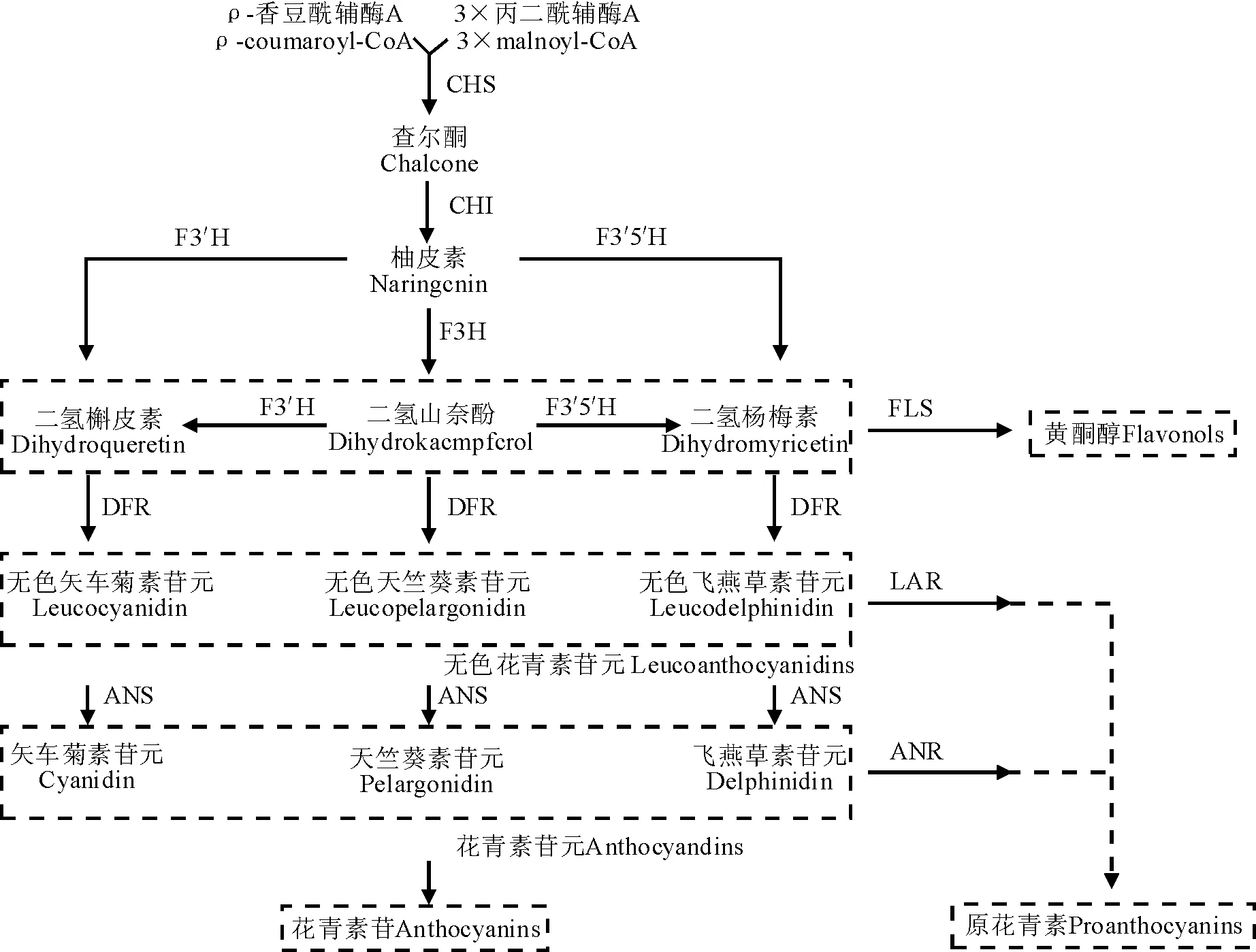
图5 类黄酮生物合成途径简图Fig.5 The biosynthetic pathway of flavonoids
类黄酮生物合成的调控主要在转录水平进行[24]。调控类黄酮物质生物合成的转录因子主要有 MYB、bHLH、WD40,而MYB是调控类黄酮生物合成的最重要转录因子。金鱼草(Antirrhinummajus)中的MYB基因Rosea1和Venosa,能激活花青素合成结构基因CHI、F3H、F3′H、FLS、DFR和ANS的表达,从而影响花青素积累[25]。番薯(Ipomoeabatatas)中的IbMYB1能特异地调控地下块根中结构基因CHS、F3H、DFR、ANS的表达,从而影响花青素的合成[26]。在番茄(Lycopersiconesculentum)中,LeANT1能够调控CHS、CHI、DFR等结构基因的表达,进而控制花青素的合成与积累[27]。从苹果(Malusdomestica)中分离到的MdMYB1能够调控果皮中结构基因MdDFR、MdANS的表达以及花青素的生物合成,并且与花青素积累、MdDFR、MdANS的表达正相关[28]。本研究中,PsMYB113的表达模式与PsDFR、PsANS表达量、花青素含量的变化趋势呈良好的正相关性,表明PsMYB113可能对牡丹叶片花青素合成起正向调控作用。
在MYB转录因子当中,与黄酮醇合成相关的MYB转录因子一般不具有与bHLH相互作用的基序,该类转录因子通常单独发挥作用,从而调节黄酮醇物质的合成[20],如拟南芥(Arabidopsisthaliana)中的AtMYB12或AtMYB111均能独立地激活黄酮醇合成相关基因如CHS、CHI、F3H、FLS的表达[29]。在葡萄(Vitisvinifera)中,VvMYB5a和VvMYBF1能够调控黄酮醇生物合成相关结构基因的表达和体内黄酮醇的合成积累[30-31]。本研究中,PsMYBF1表达量的变化趋势与牡丹叶片中黄酮醇水平、PsFLS表达量的变化趋势基本一致,并且呈显著正相关,表明PsMYBF1可能是调控牡丹叶片黄酮醇合成的重要转录因子。
调控类黄酮合成的MYB转录因子,并非全都是对类黄酮物质的合成起转录激活作用,有些MYB转录因子则起着负向调控作用。如拟南芥中的AtMYBL2,该基因的表达能够下调拟南芥体内花青素合成相关结构基因表达,从而抑制花青素的合成[32]。同时,在拟南芥中过表达AtMYB3、AtMYB6会引起花青素含量的下降, 说明AtMYB3、AtMYB6可能对拟南芥花青素的合成起抑制作用[33]。FaMYB1是草莓(Fragariaananassa)中发现的抑制花青素合成的转录因子基因,该基因的表达与花青素的积累呈负相关,在烟草中过表达FaMYB1会抑制烟草体内花青素的积累,同时也降低了黄酮醇的含量[34]。MdMYB6是从苹果中鉴定出的MYB转录因子基因,该基因在拟南芥中的过表达抑制了植株体内花青素的合成与积累,同时下调了花青素合成相关结构基因的表达[35]。本研究中,PsMYB4的表达模式与牡丹叶片花青素含量及花青素合成重要结构基因PsDFR、PsANS表达量的变化趋势呈显著负相关性,暗示PsMYB4可能对牡丹叶片花青素合成起负向调控作用。
综上所述,推测牡丹‘满园春光’春季叶片红色消退的可能机制为:在牡丹叶片发育前期,环境因子(低温)诱导PsMYB113的高表达,PsMYB113的表达激活了PsDFR、PsANS的表达,牡丹新叶中大量合成花青素(花青素可以提高植物的抗寒性),使叶片呈现紫红色;随着叶片发育,相应环境因子发生变化(温度升高),该因子诱导PsMYB4的表达,而抑制PsMYB113的表达,PsMYB4的高表达抑制了PsDFR、PsANS的表达,进而使花青素合成减少。同时,PsMYBF1的高表达激活了PsFLS的大量表达,进而与PsDFR竞争底物,使本该合成花青素的二氢黄酮醇大量流向黄酮醇合成的方向,从而使牡丹叶片中花青素的合成进一步减少。与此同时,叶片中叶绿素与类胡萝卜素的大量合成削弱了花青素对牡丹叶片颜色的影响。上述因素相互叠加从而导致了牡丹叶片紫红色逐渐消退,黄绿色形成。但该调控假设有待后续研究进一步验证。

