应用组合型四极杆-静电轨道阱质谱研究一种新合成二肽聚合物对糖肽的富集效果
阳 宏,杨晨熙
(武汉理工大学,材料复合新技术国家重点实验室,湖北 武汉 430070)
蛋白质糖基化是生物界普遍存在的一种蛋白质翻译后修饰方式[1],在生理和病理过程中具有重要意义。糖基化修饰赋予了蛋白质特定的空间结构和理化性质,使其在细胞粘附、细胞生长、信号转导、新陈代谢、细胞免疫等生理过程中发挥着至关重要的作用[2-6]。而异常的蛋白质糖基化被证实与恶性肿瘤、阿尔茨海默综合症等许多疾病的发生和发展密切相关,临床上常将其作为医疗诊断和治疗的着手点[7-9]。因此,全面、准确地研究蛋白质糖基化具有重要的生物学意义和临床应用价值。
目前,基于质谱技术的蛋白质糖基化研究受到了广泛关注[10]。应用质谱技术研究蛋白质糖基化已取得较大进展,但如何实现糖肽的有效富集[11],仍然需要深入研究。
常见的糖肽富集方法包括凝集素亲和法、亲水相互作用法、肼化学法、硼酸富集法等[12-13]。这些方法各有不足,如存在只能选择性地富集样品中特定的糖蛋白/糖肽[14]、操作繁琐且样品损失大[15]、富集效率不高等问题[16]。因此,开发一种性能优异的糖蛋白/糖肽富集材料尤为重要。文献[17]报道了利用表面引发原子转移自由基聚合法(surface initiated atom transfer radical polymerization, SI-ATRP)合成一种脯氨酸(P)-天冬氨酸(D)二肽聚合物修饰的介孔二氧化硅(Pro-Asp homopolymer modified mesoporous silica gel, poly-PD@SiO2)材料,通过其表面丰富的亲水基团(—NH、—COOH等)与糖链—OH形成多重氢键相互作用,可实现对糖肽的有效富集。
本研究拟应用高分辨和高质量精度的组合型四极杆-静电轨道阱(hybrid quadrupole Orbitrap, Q-Exactive Plus)质谱仪,全面、深度地研究这种二肽聚合物修饰的介孔二氧化硅材料的糖肽富集效果,并与常用于糖肽富集的亲水性相互作用色谱(hydrophilic interaction liquid chromatography, HILIC)比较,希望为糖蛋白/糖肽的富集分离提供新途径。
1 实验部分
1.1 主要仪器与装置
组合型四极杆-静电轨道阱质谱仪(Hybrid Quadrupole Orbitrap, Q-Exactive plus):美国Thermo Fisher Scientific公司产品;超低温冰箱:海尔生物医疗公司产品;H1650-W微量台式高速离心机:湖南湘仪实验室仪器开发有限公司产品;ZLS-1真空离心浓缩仪:湖南赫西仪器装备有限公司产品;BWS-5恒温水槽与水浴锅:上海一恒科学仪器有限公司产品;Sep-Pak C18柱(1 mL/50 mg):爱尔兰Waters公司产品;HILIC小柱(3 mL/500 mg):德国Macherey-Nagel公司产品;B-广范试纸:上海三爱思试剂有限公司产品。
1.2 主要材料与试剂
牛胎球蛋白(fetuin from fetal bovine serum)、二硫苏糖醇(dithiothreitol, DTT)、胰蛋白酶(trypsin from bovine pancreas,测序级):均为美国Sigma-Aldrich公司产品;碘乙酰胺(IAA):比利时Acros公司产品;碳酸氢铵:分析纯,天津市福晨化学试剂厂产品;三氟乙酸(TFA)、乙酸、甲酸、乙腈、实验用水:均为色谱纯,美国Thermo Fisher Scientific公司产品;其他化学试剂均为分析纯。
1.3 实验方法
1.3.1脯氨酸-天冬氨酸二肽聚合物修饰介孔二氧化硅的制备 按照文献[17]合成脯氨酸-天冬氨酸二肽聚合物修饰介孔二氧化硅。首先,将丙烯酰氯中的酰氯与脯氨酸-天冬氨酸(Pro-Asp)中的氨基进行取代反应,制备丙烯酰化二肽功能单体(AAPD);然后,利用2-溴异丁基酰溴将反应引发基团修饰到氨基硅球表面,得到酰溴化硅球;最后,将AAPD通过表面引发原子转移自由基聚合反应(surface initiated atom transfer radical polymerization, SI-ATRP)接枝到酰溴化硅球表面,得到脯氨酸-天冬氨酸二肽聚合物表面修饰的介孔二氧化硅(poly-PD@SiO2)。
1.3.2标准干扰模型样品的酶解 为评估新材料对糖肽的富集效果,将牛胎球蛋白(bovine fetuin)和牛血清蛋白(BSA,作为干扰蛋白)分别按照质量浓度比为1∶1、1∶2、1∶5、1∶10和1∶100混合,配制一系列标准干扰模型样品。将适量的标准干扰模型样品溶于50 mmol/L的pH8的NH4HCO3缓冲溶液,加入适量的250 mmol/L DTT水溶液,使其终浓度为5 mmol/L,在37 ℃水浴反应45 min,使糖蛋白中的双硫键断裂。冷却至室温后,为防止二硫键的重新形成,加入适量的250 mmol/L IAA水溶液,使其终浓度为15 mmol/L,于黑暗处室温静置30 min,使其发生烷基化。随后,向样品中再次加入适量的250 mmol/L DTT水溶液样品,至其终浓度为5 mmol/L,室温静置15 min,用以封闭过量的IAA。由于胰蛋白酶trypsin的最佳酶解条件为pH7.5~8.0、T=37 ℃,所以在注入胰蛋白酶前,需要利用50 mmol/L NH4HCO3缓冲溶液(pH8)调pH至8.0。最后,以胰蛋白酶/标准干扰模型样品的质量比为1∶50加入适量trypsin,于37 ℃水浴反应过夜。待样品酶解完成后,冷却至室温,加入适量10% TFA终止酶解反应。
为除去酶解过程中引入的盐类杂质,需要利用C18反相柱对酶解混合物进行脱盐处理[18]。具体步骤为:1) 向C18反相柱中依次加入3 mL乙腈、1 mL乙腈-水-乙酸溶液(70∶30∶0.25,V/V/V)、1 mL乙腈-水-乙酸溶液(40∶60∶0.5,V/V/V)、1 mL乙腈-水-乙酸溶液(20∶80∶0.5,V/V/V)、3 mL含0.1%三氟乙酸的水溶液,以平衡C18柱;2) 将样品注入C18除盐柱中;3) 加入3 mL含0.1%三氟乙酸的水溶液,除去酶解产物中的盐类;4) 先后注入1 mL乙腈-水-乙酸溶液(40∶60∶0.5,V/V/V)、1 mL乙腈-水-乙酸溶液(70∶30∶0.25,V/V/V),将吸附的非糖肽/糖肽洗脱出来。最后,用真空离心浓缩仪干燥洗脱液。
1.3.3酶解后样品中糖肽的分离富集 取1.00 mg poly-PD@SiO2材料于离心管中,加入500 μL乙腈-水-甲酸溶液(75∶24∶1,V/V/V)平衡材料。然后,取100 μg 1.3.2节浓缩干燥后的非糖肽/糖肽混合样品,溶解于不同浓度的乙腈-水-0.1%甲酸溶液,再与色谱材料平衡液充分混合,振荡孵育15 min。随着样品质量的增大,相应增加孵育平衡液的体积。离心除去上清液后,用100 μL乙腈-水-甲酸溶液(75∶24∶1,V/V/V)洗涤4次,用40 μL乙腈-水-甲酸溶液(73∶26∶1,V/V/V)洗涤3次,每次洗涤后离心除去上清液。最后用40 μL乙腈-水-甲酸溶液(40∶59∶1,V/V/V)洗脱2次,高速离心6 min,保留上清液,经真空离心浓缩仪干燥后,于-80 ℃保存,待测。
参照文献[19]进行HILIC富集糖肽,并对其进行适当优化。具体方法如下:首先,用3 mL乙腈-水-三氟乙酸溶液(80∶20∶0.1,V/V/V)冲洗平衡HILIC小柱3次;然后,用小于100 μL乙腈-水-三氟乙酸溶液(50∶50∶0.5,V/V/V)完全溶解以上酶解混合物,并向HILIC小柱中加入3 mL乙腈-水-三氟乙酸溶液(80∶20∶0.1,V/V/V),将非糖肽/糖肽溶液注入HILIC小柱中,再用3 mL乙腈-水-三氟乙酸溶液(80∶20∶0.1,V/V/V)淋洗2次,以除去酶解混合物中的非糖肽;最后,用3 mL 0.1%三氟乙酸水溶液将吸附的糖肽洗脱下来并收集;洗脱液干燥后,于-80 ℃保存,待测。
1.3.4Hybrid quadrupole Orbitrap质谱检测和分析 将富集所得的糖肽干燥样品分别溶解于80 μL不同浓度的乙腈-水-甲酸溶液中,在Hybrid quadrupole Orbitrap质谱仪正离子模式下直接进样,流速1 μL/min,喷雾电压2.00 kV,质量扫描范围m/z300~2 000,分辨率35 000,AGC target值2×105。
将raw data数据文件通过Thermo Xcalibur Qual Browser软件筛选后,利用UniProt (http:∥www.uniprot.org/)、ProteinProspector(http:∥prospector.ucsf.edu/prospector/mshome.htm) 对非糖肽序列信息进行匹配, GlycoMod Tool (http:∥web.expasy.org/gly-comod/)对糖肽信号进行数据库搜索[20],最后借助单糖连接的经验规律、已有的文献资料辅助人工筛选和GlycoWorkbench 2.1验证,确定糖肽结构。
2 结果与讨论
2.1 进样溶剂对质谱检测结果的影响
不同进样溶剂对质谱检测结果的影响示于图1,可以看出,进样溶剂中加入0.1%甲酸后可以多检测出20个糖肽信号,所以,甲酸的添加对糖肽的检测有重要作用。因此,本实验选用0.1%甲酸-40%乙腈-水溶液作为质谱检测的进样溶剂。
2.2 检测浓度的优化
为探讨从混合干扰模型样品中富集得到的糖肽样品的最佳检测浓度,将富集所得的同一糖肽样品分别稀释为0.25、0.5、1、1.25、1.5、1.75、2、3、4、5 g/L。不同进样浓度下,糖肽离子总强度占所有检测离子强度的比率示于图2a。

图1 40%乙腈水溶液(a)和0.1%甲酸-40%乙腈水溶液(b)作为进样溶剂对质谱响应的影响Fig.1 Influence of 40% acetonitrile aqueous solution (a) and 0.1% formic acid in 40% acetonitrile aqueous solution (b) as the solvent for MS detection
在进样浓度0.25 ~1 g/L范围内,糖肽离子总强度覆盖率从22.5%升至56.15%,糖肽信号显著提升;随着进样浓度的进一步增大,糖肽离子总强度覆盖率在55%~60%范围内小幅波动,糖肽信号趋于稳定。因此,检测浓度大于1 g/L时,才能得到信号强度适宜的糖肽谱图。为进一步明确糖肽样品的最佳检测浓度,选取5个信号最强的糖肽进行分析,其离子峰的信号强度示于图2b,top1至top5分别对应m/z1 633.9 583(4+)、1 307.3 653(5+)、1 534.6 332(3+)、1 089.6 423(6+)、1 183.2 487(4+)。随着检测浓度的增大,糖肽离子峰的信号强度呈现先增大后平稳的趋势。当检测浓度为1 g/L时,离子峰信号强度均达到5×106以上,且随着浓度进一步增大,信号强度均趋于平稳。由此可知,牛胎球蛋白富集所得的牛胎球蛋白酶解糖肽样品的最佳检测浓度为1 g/L。
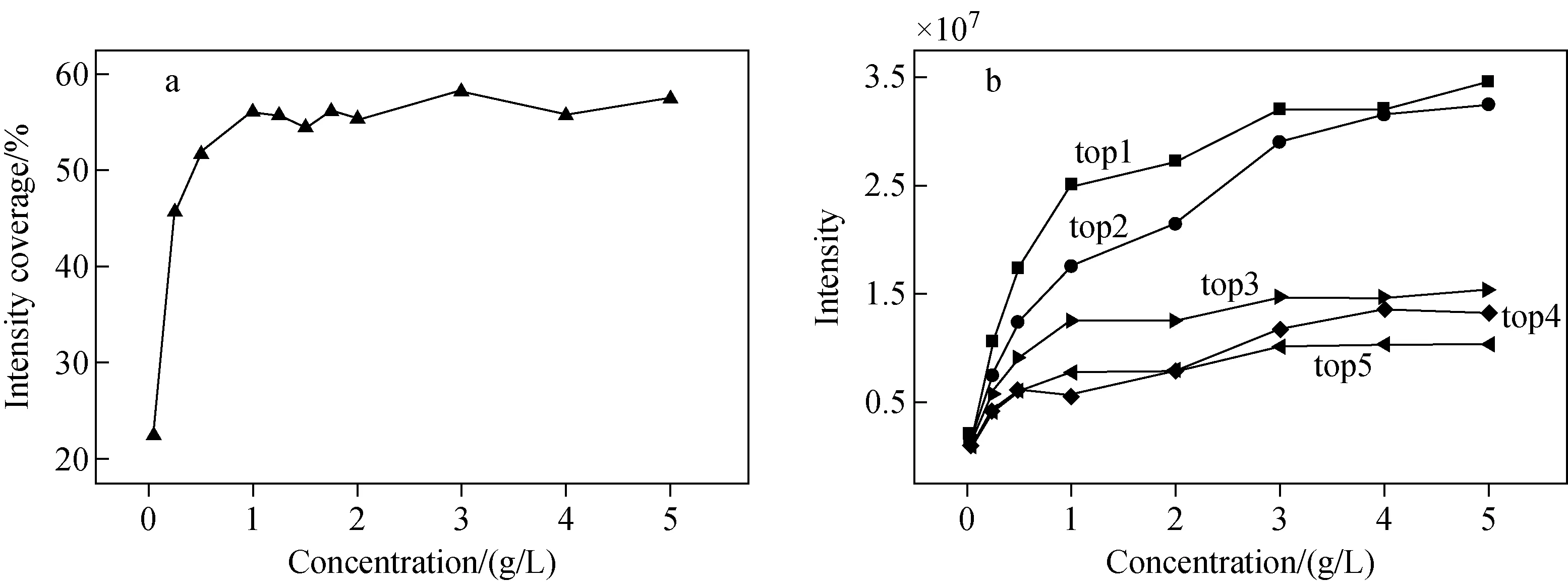
图2 进样浓度与糖肽离子信号覆盖率(a)和5个主离子峰最高信号强度(b)的相关曲线Fig.2 Plots of intensity coverage of all glycopeptides (a) and signal intensity of the five most abundant glycopeptides (b) vs. sampling concentration
2.3 poly-PD@SiO2糖肽富集条件的优化
样品富集前是否进行脱盐处理对poly-PD@SiO2的糖肽富集效果有显著影响,结果示于图3。通过对比图3a、3b可以看出,样品未脱盐时,仅能检测到17个糖肽信号,脱盐后,所得糖肽信号增加至22个,且糖肽信号的强度得到加强。如RPTGEVYDIEIDTLETTCHVLDPTPLAN(99)CSVR+(Hex)6(HexNAc)5(NeuAc)3糖肽,未脱盐时,测得m/z1 633.961 9(4+)的信号强度仅为1.58×106,脱盐后该离子的信号强度为1.25×107,增强了近10倍。这是因为poly-PD@SiO2主要通过脯氨酸(P)、天冬氨酸(D)二肽聚合物表面的多个氢键作用位点(—NH、—COOH)与糖肽的聚糖侧链上的—OH发生氢键作用来实现对糖肽的富集。如果样品中存在盐离子,会破坏这种氢键的相互作用,不利于糖肽的吸附。因此,脱盐处理对poly-PD@SiO2成功富集糖肽非常重要。
样品经酶解除盐、干燥浓缩后,实验探讨了对非糖肽/糖肽混合样品再溶解时所用的乙腈水溶液(含0.1%甲酸)的浓度对poly-PD@SiO2富集糖肽效果的影响,结果示于图4。当溶液含有75%乙腈时,样品只能部分溶解,谱图中存在m/z707.338 9(3+)、1 006.195 1(3+)、1 260.161 0(2+)等多个非糖肽信号,且糖肽分子信号强度相对较低,糖肽的最高检出信号强度为1.53×107;当溶液含59%乙腈时,样品完全溶解,谱图中未出现明显的非糖肽信号,且检测到40个糖肽信号,最高检出信号强度为2.51×107。虽然含40%乙腈溶剂和不含乙腈溶剂也都能够完全溶解样品,但检出的最高糖肽信号强度普遍较低,分别为1.25×107和7.78×106,且检出的糖肽信号个数明显少于59%乙腈溶液,这可能由于溶剂极性过大,干扰了poly-PD@SiO2通过氢键作用吸附糖肽。因此,选择59%乙腈水溶液(含0.1%甲酸)为浓缩干燥后的非糖肽/糖肽混合样品再溶解的最佳溶剂。

图3 脱盐前(a)、后(b)的糖肽富集情况Fig.3 Enrich efficiency of glycopeptides before (a) and after (b) desalting
2.4 poly-PD@SiO2富集糖肽的结构解析
经poly-PD@SiO2富集的糖肽质谱图和对应的糖链结构示于图5。可见,共检测出45个糖肽信号,包括文献[21-23]报道中的牛胎球蛋白的3个N-糖基化位点和4个O-糖基化位点,其连接的糖链结构包含文献[21-23]报道中除(Hex)6(HexNAc)5(NeuAc)1以外的所有聚糖结构。(Hex)6(HexNAc)5(NeuAc)1在牛胎球蛋白中的含量仅为2.2%[23],可能是本实验未测到该糖链的原因。
2.5 poly-PD@SiO2和HILIC小柱对糖肽富集效果的比较
poly-PD@SiO2和HILIC小柱从牛胎球蛋白与牛血清蛋白(干扰蛋白)的质量浓度比分别为1∶2、1∶5、1∶10的酶解样品中富集糖肽的质谱结果示于图6。每个poly-PD@SiO2富集样品中,均检测到至少33条糖肽信号,包含牛胎球蛋白中除第341位O糖基化位点以外的所有糖基化位点,且检测到的糖肽信号强度大部分在1×107左右;与之相比,HILIC小柱富集样品检出的糖肽信号较少,且随着干扰蛋白浓度的增加,富集灵敏度显著降低,检测的糖肽信号强度均低于1×107。以上结果表明,与HILIC小柱相比,poly-PD@SiO2能够从牛胎球蛋白与牛血清蛋白的酶解样品中富集到更多糖基化修饰信息,表明该材料能够高选择性地富集唾液酸型糖肽,效果优于目前常用的糖肽色谱分离材料。此外,当样品中牛血清蛋白浓度为牛胎球蛋白的100倍时,poly-PD@SiO2仍能成功富集糖肽,结果示于图7。谱图中检测到32条糖肽信号,并且与样品不含干扰蛋白时所包含的糖基化位点和糖链结构信息相差不大。

注:a.75%;b.59%;c.40%;d.0%图4 不同浓度乙腈的水溶液(含0.1%甲酸)对poly-PD@SiO2富集糖肽效果的影响Fig.4 Effects of concentration of acetonitrile on enrichment of glycopeptides by poly-PD@SiO2

图5 Poly-PD@SiO2富集样品的质谱图和对应的糖链结构Fig.5 Mass spectrum of sample enriched by poly-PD@SiO2 and corresponding structures of glycans
3 结论
本研究应用高分辨和高质量精度Hybrid quadrupole Orbitrap (Q Exactive Plus)质谱仪分析poly-PD@SiO2对糖肽样品的富集能力。对其富集过程进行优化后,poly-PD@SiO2可从牛血清蛋白(干扰蛋白)浓度为牛胎球蛋白(糖蛋白)浓度100倍的样品中成功富集糖肽,并检测到32条糖肽信号,分别对应除第341位O-糖基化位点以外的所有牛胎球蛋白糖基化位点及其所连接的糖链结构。与常用的HILIC小柱相比,poly-PD@SiO2表现出明显优势,有望成为一种高效的糖肽分离富集材料。

图6 poly-PD@SiO2(a,b,c)和HILIC小柱(d,e,f)从牛胎球蛋白和牛血清蛋白浓度比分别为1∶2(a,d)、1∶5(b,e)、1∶10(c,f)的酶解样品中富集糖肽的质谱图Fig.6 MS spectra of glycopeptides enriched from samples containing fetuin and bovine serum albumin in ratio of 1∶2 (a, d), 1∶5 (b, e) and 1∶10 (c, f) by poly-PD@SiO2 (a, b, c)and HILIC (d, e, f)

图7 poly-PD@SiO2从牛胎球蛋白和牛血清蛋白浓度比为1∶100的酶解样品中富集糖肽样品的质谱图Fig.7 MS spectrum of glycopeptides enriched from samples containing fetuin and bovine serum albumin in a ratio of 1∶100 by poly-PD@SiO2

