甲磺酸多黏菌素E2组分的色谱分离及质谱裂解规律研究
刘 丹,李 亮,刘 彩,陈笑艳,钟大放
(1.南昌大学药学院,江西 南昌 330006;2.中国科学院上海药物研究所药物代谢研究中心,上海 201203)
多黏菌素E(colistin)自1950年被发现后一直是多黏菌素类抗生素中重要的一种,但在20世纪70年代,由于其具有较高的肾毒性和神经毒性而被撤市,随后发现其对革兰氏阴性菌及泛耐药引起的感染有较强的作用。近年来,随着抗菌药物、免疫抑制剂的广泛应用,细菌的耐药性不断增强,多药耐药菌迅速增加,老药多黏菌素成为抗多药耐药菌的最后防线,引起了研究者的关注[1]。但有研究[2]发现,带有MCR-1基因的细菌也表现出了对多黏菌素的耐药性,这提示我们要更加关注对多黏菌素类抗生素的研究及使用。
目前市售的多黏菌素E主要有硫酸多黏菌素E和甲磺酸多黏菌素E两种,且均为多黏菌素E1(Colistin A)和多黏菌素E2(Colistin B)的混合物[3]。有文献[4]报道,多黏菌素E1和多黏菌素E2在抑菌活性上无明显差别,但二者混合物比单一成分的活性低,主要是因为二者会相互竞争血浆蛋白结合位点,影响游离药物浓度,进而影响药动学性质,同时还发现多黏菌素E1对肾脏的毒性比多黏菌素E2严重[5]。基于此,正大天晴药业集团股份有限公司研制开发了甲磺酸多黏菌素E(甲磺酸多黏菌素E1和甲磺酸多黏菌素E2混合物)中的单一成分甲磺酸多黏菌素E2,即用甲磺酸基团取代多黏菌素E2的5个碱性氨基,二者结构示于图1。甲磺酸多黏菌素E2是多黏菌素E2的非活性前药,几乎不被胃肠道吸收,主要通过肌肉注射或静脉注射给药,进入人体后能够代谢为多黏菌素E2而发挥杀菌作用。

图1 甲磺酸多黏菌素E2(a)和多黏菌素E2(b)的结构式Fig.1 Structures of colistin B methanesulfonate (a) and colistin B (b)
目前,对多黏菌素E和甲磺酸多黏菌素E的质谱定量研究已有报道[6-10],如,Mercier等[6]建立了HILIC-MS/MS法同时测定人血浆中的多黏菌素E1和多黏菌素E2及其前药甲磺酸多黏菌素E1和多黏菌素E2;Zhao等[7]建立了UHPLC-MS/MS法测定人血浆及尿液中的多黏菌素E及甲磺酸多黏菌素E等。但二者对于甲磺酸多黏菌素E均是间接定量,分别测得体内代谢产生多黏菌素E的浓度和体内代谢加体外水解产生多黏菌素E的总浓度,即可计算出体内的甲磺酸多黏菌素E的浓度[11]。Ma等[12]在多黏菌素E的定量研究中选择ESI+检测模式,分析了多黏菌素E的一级和二级质谱片段,发现主要的断裂方式是肽键断裂。甲磺酸多黏菌素E作为多黏菌素E的前药,研究其体内代谢过程具有重要意义,但目前尚未见对前药甲磺酸多黏菌素E进行直接测定或者对其色谱保留和质谱裂解规律进行研究的报道。
本实验拟对甲磺酸多黏菌素E2进行质谱ESI-模式下的裂解分析,以获得丰富的碎片离子结构信息,通过分析推测甲磺酸多黏菌素E2的质谱裂解规律,旨在为甲磺酸多黏菌素E2及其类似物的快速结构解析、定量分析和药动学研究提供支持。
1 实验部分
1.1 仪器与试剂
Acquity UPLC系统:配备二元输液泵、自动进样器、柱温箱、脱气机和TUV紫外检测器,美国Waters公司产品;Triple TOF 5600+型四极杆-飞行时间串联质谱仪(配有电喷雾电离源和CDS自动校正系统)、PeakViewTM软件:均为美国AB Sciex公司产品。
甲磺酸多黏菌素E2钠盐原料药(批号:160225115):由正大天晴药业集团股份有限公司提供;乙腈(色谱纯):德国Merck公司产品;氨水(分析纯):国药集团化学试剂有限公司产品;超纯水:美国Millipore公司产品。
1.2 色谱条件
Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm×1.8 μm);流动相:5 mmol/L醋酸铵(含0.001%氨水)(A)-乙腈(B);流速0.4 mL/min;检测波长254 nm;柱温45 ℃;进样量5 μL;梯度洗脱:0~1 min(5%B),1~7 min(5%~40%B),7~9 min(40%~70%B),9~11 min(70%~90%B),11~12 min(90%B),12~14 min(90%~5%B),14~17 min(5%B)。
1.3 质谱条件
电喷雾电离源(ESI),负离子扫描(高灵敏度模式)方式检测;GAS1:55,GAS2:50,Curtain GAS:35;源温度400 ℃;离子喷雾电压(ISVF)-4 500 V;去簇电压-80 V;一级全扫描时碰撞能量为-8 eV;产物离子扫描时碰撞能量分别为(-25±5) eV(二甲磺酸多黏菌素E2)、(-15±5) eV(三、四甲磺酸多黏菌素E2)、(-8±5) eV(五、六甲磺酸多黏菌素E2);质量扫描范围m/z80~1 500;采用自动校正系统(CDS)外标法校正质量数。
1.4 样品溶液制备
取规格为150 mg(以多黏菌素E2计)的注射用甲磺酸多黏菌素E2钠盐,加入一定体积纯水定量转移,得25 g/L的储备液;用纯水稀释储备液,配制成100 mg/L的工作溶液作为测试溶液。储备液及工作溶液均于-20 ℃保存。
2 结果与讨论
2.1 色谱分离
甲磺酸多黏菌素E2原料药为混合物,含有不同数目甲磺酸基团以及不同位置修饰的多黏菌素E2组分,各组分之间可通过极性不同或取代基位置不同得以分离。本实验比较了乙腈-水、乙腈-5 mmol/L醋酸铵水溶液、乙腈-5 mmol/L醋酸铵水溶液(含0.001%氨水)、甲醇-5 mmol/L醋酸铵水溶液(含0.001%氨水)体系作为流动相时,对甲磺酸多黏菌素E2混合物的色谱分离行为和离子化响应的影响。结果表明,选取乙腈-5 mmol/L醋酸铵水溶液(含0.001%氨水)为流动相时,色谱峰的峰形尖锐对称,分离度及离子化效果均较好。因此,本实验选择该溶液作为流动相。各组分的保留时间随着甲磺酸取代基数目的减少(极性减弱)而增加,但具有相同甲磺酸取代基数目的位置异构体较难实现完全分离。实验检测到的甲磺酸多黏菌素E2组分的色谱图示于图2,未检测到单取代的甲磺酸多黏菌素E2(因此后文未对其分析)。

注:a.二甲磺酸多黏菌素E2;b.三甲磺酸多黏菌素E2;c.四甲磺酸多黏菌素E2;d.五甲磺酸多黏菌素E2;e.六甲磺酸多黏菌素E2图2 不同数目甲磺酸基团取代的多黏菌素E2的色谱图Fig.2 Chromatograms of colistin B with different numbers of methanesulfonic acid groups
2.2 质谱裂解
本实验选择的电喷雾电离是一种软电离技术,易于得到目标物的相对分子质量信息。通过ESI一级质谱产生的准分子离子得到物质的分子质量信息,碰撞诱导解离(CID)技术可以使准分子离子发生碎裂,从而得到化合物的结构信息[13]。
2.2.1一级质谱全扫描分析 采用电喷雾离子源,在负离子检测方式下对5种不同数目甲磺酸基团取代的多黏菌素E2进行质谱分析。结果发现,均能检测到很强的双电荷准分子离子峰[M-2H]2-,六甲磺酸、五甲磺酸、四甲磺酸、三甲磺酸、二甲磺酸多黏菌素E2的[M-2H]2-分别为m/z858.291、811.296、764.312、717.327、670.344。这可能是因为甲磺酸多黏菌素E2的分子质量较大,较大的分子结构有利于电子分散,在负离子模式下,化合物多个位点的电子亲和势较低,容易电离多个氢产生多电荷离子。
2.2.2二级质谱分析 为了研究分子结构与裂解途径之间的关系,通过碰撞诱导解离对不同数目甲磺酸基团取代的多黏菌素E2的[M-2H]2-准分子离子峰进行二级质谱分析,所得碎片离子信息列于表1,二级质谱图示于图3。
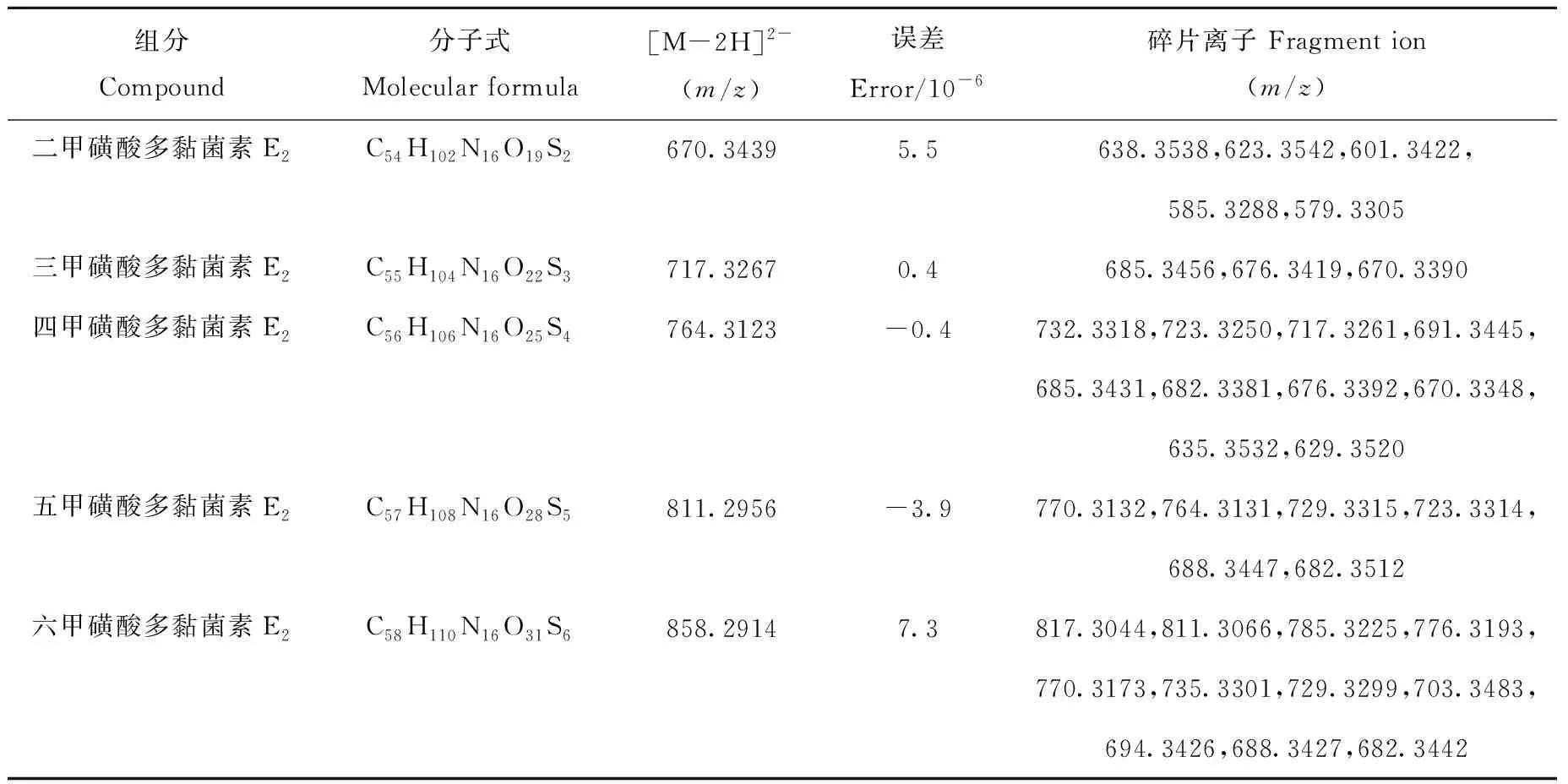
表1 甲磺酸多黏菌素E2组分的高分辨质谱数据Table 1 Accurate mass data of colistin B with different numbers of methanesulfonic acid groups
六甲磺酸多黏菌素E2的准分子离子[M-2H]2-为m/z858.291,通过CID解离分析,得到了m/z858.291 4、817.304 4、811.306 6、785.322 5、776.319 3、770.317 3、735.330 1、729.329 9、703.348 3、694.342 6、688.342 7、682.344 2一系列质谱峰(图3e)。其中m/z858.291 4与m/z817.304 4,m/z817.304 4与m/z776.319 3,m/z776.319 3与m/z735.330 1,m/z735.330 1与m/z694.342 6相比均相差40.985(±0.003),考虑到碎片为双电荷离子,即在结构上相差81.970,推测是甲磺酸基团上的C—S键断裂,中性丢失一分子H2SO3,此种断裂方式文献[14]中已有报道,主要是通过五元环过渡态发生重排反应形成了亚胺结构。相似的裂解方式也存在于含有磺酸基团的结构中,通过六元环过渡态发生重排反应而断裂[15];此外,发现m/z858.291 4与m/z811.306 6,m/z817.304 4与m/z770.317 3,m/z776.319 3与m/z729.329 9,m/z735.330 1与m/z688.342 7,m/z729.329 9与m/z682.344 2相比均相差46.986(±0.001),因为碎片为双电荷离子,所以质量相差93.972,推测是甲磺酸基团上亚甲基与相连的仲胺发生C—N键断裂,中性丢失CH2SO3。该中性丢失可能是环状结构,其形成的原因可能是亚甲基碳原子连有2个吸电子基团,带有部分正电荷,容易被甲磺酸羟基进攻而形成环氧结构。这种断裂方式与Bianco等[16]报道的硫代葡萄糖苷的断裂方式类似。除以上两种裂解方式外,还发现m/z817.304 4与m/z785.322 5,m/z735.330 1与m/z703.348 3相比相差31.980(±0.001),因为碎片为双电荷离子,所以质量相差63.960,推测为磺酸基上羟基迁移造成中性丢失一分子SO2。Ben-Ari等[17]在2005年曾报道苯磺酸类结构在CID中可以发生二氧化硫的丢失;2008年,Sun等[18]报道了芳基磺酸类结构在负离子模式下可以通过重排发生二氧化硫的中性丢失。因此,甲磺酸多黏菌素E2中性丢失SO2可能也是通过这种重排消除的方式发生的,其裂解途径示于图4(断裂过程图只以分子离子的其中一种可能取代情况发生断裂的过程示意,后文相同)。
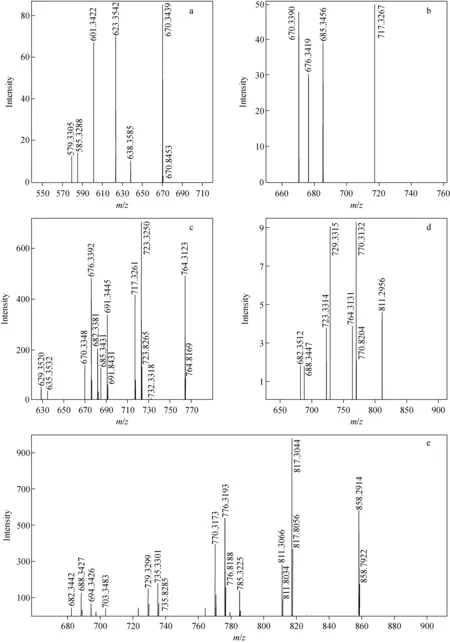
注:a.二甲磺酸多黏菌素E2;b.三甲磺酸多黏菌素E2;c.四甲磺酸多黏菌素E2;d.五甲磺酸多黏菌素E2;e.六甲磺酸多黏菌素E2图3 不同数目甲磺酸基团取代的多黏菌素E2[M-2H]2-离子的ESI-MS2谱图Fig.3 ESI-MS2 of [M-2H]2- ions of colistin B with different numbers of methanesulfonic acid groups
五甲磺酸多黏菌素E2的准分子离子[M-2H]2-为m/z811.296,通过CID解离分析,得到了m/z811.295 6、770.313 2、764.313 1、729.331 5、723.331 4、688.344 7、682.351 2一系列碎片离子(图3d)。其中m/z811.295 6与m/z770.313 2,m/z770.313 2与m/z729.331 5,m/z729.331 5与m/z688.344 7均相差40.985(±0.003),如前所述,推测五甲磺酸多黏菌素E2是甲磺酸基团上的C—S键断裂,中性丢失H2SO3;m/z811.295 6与m/z764.313 1,m/z770.313 2与m/z723.331 4,m/z729.331 5与m/z682.351 2均相差46.986(±0.001),推测是甲磺酸基团上亚甲基与相连的仲胺发生C—N键断裂,中性丢失CH2SO3。
四甲磺酸多黏菌素E2的准分子离子[M-2H]2-为m/z764.312,通过CID解离分析,得到了m/z764.312 3、732.331 8、723.325 0、717.326 1、691.344 5、685.343 1、682.338 1、676.339 2、670.334 8、635.353 2、629.352 0一系列碎片离子(图3c)。其中m/z764.312 3与m/z723.325 0,m/z732.331 8与m/z691.344 5,m/z723.325 0与m/z682.338 1,m/z676.339 2与m/z635.353 2,m/z670.334 8与m/z629.352 0均相差40.985(±0.003),如前所述,推测是甲磺酸基团上的C—S键断裂,中性丢失H2SO3;m/z764.312 3与m/z717.326 1,m/z717.326 1与m/z670.334 8,m/z732.331 8与m/z685.343 1,m/z723.325 0与m/z676.339 2均相差46.986(±0.001),与六甲磺酸多黏菌素E2类似,推测是甲磺酸基团上亚甲基与相连的仲胺发生C—N键断裂,中性丢失CH2SO3;m/z764.312 3与m/z732.331 8相差31.980(±0.001),推测为磺酸基上羟基迁移导致中性丢失一分子SO2,可能的裂解途径示于图5。
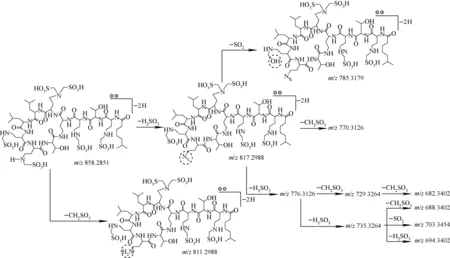
注:断裂图中质荷比(m/z)数值为理论值,以下同图4 六甲磺酸多黏菌素E2的[M-2H]2-离子可能的ESI-MS2断裂方式Fig.4 Proposed fragmentation pathways of [M-2H]2- of colistin B with six methanesulfonic acid groups in ESI-MS2
三甲磺酸多黏菌素E2的准分子离子[M-2H]2-为m/z717.327,通过CID解离产生的碎片离子相对较少,得到了m/z717.326 7、685.345 6、676.341 9、670.339 0碎片离子(图3b)。其中m/z717.326 7与m/z676.341 9相差40.985(±0.003),推测是甲磺酸基团上的C—S键断裂,中性丢失H2SO3;m/z717.326 7与m/z670.339 0相差46.986(±0.001),推测是甲磺酸基团上亚甲基与相连的仲胺发生C—N键断裂,中性丢失CH2SO3;m/z717.326 7与m/z685.345 6相差31.980(±0.001),推测为磺酸基上羟基迁移导致中性丢失一分子SO2。
二甲磺酸多黏菌素E2的准分子离子[M-2H]2-为m/z670.344,通过CID解离分析,得到了m/z670.343 9、638.358 5、623.354 2、601.342 2、585.328 8、579.330 5等碎片离子(图3a)。其中,m/z670.343 9与m/z623.354 2相差46.986(±0.001),推测是甲磺酸基团上亚甲基与相连的仲胺发生C—N键断裂,中性丢失CH2SO3;m/z670.343 9与m/z638.358 5相差31.980(±0.001),推测为磺酸基上羟基迁移导致中性丢失一分子SO2;m/z623.354 2与m/z601.342 2,m/z601.342 2与m/z579.330 5相差22.013(±0.001),双电荷情况下即分子质量相差44.026,推测为羟基α位C—C键断裂导致中性丢失一分子CH3CHO;甲磺酸多黏菌素E2含有2个苏氨酸片段,在CID中也会发生中性丢失乙醛,其消除机理是通过形成六元环过渡态发生的,该机理在Wang等[19-20]文献中已报道。m/z670.343 9与m/z585.328 8相差85.015,推测为准分子离子[M-2H]2-中性丢失一分子H2SO3和二分子CH3CHO产生的碎片,可能的裂解途径示于图6。
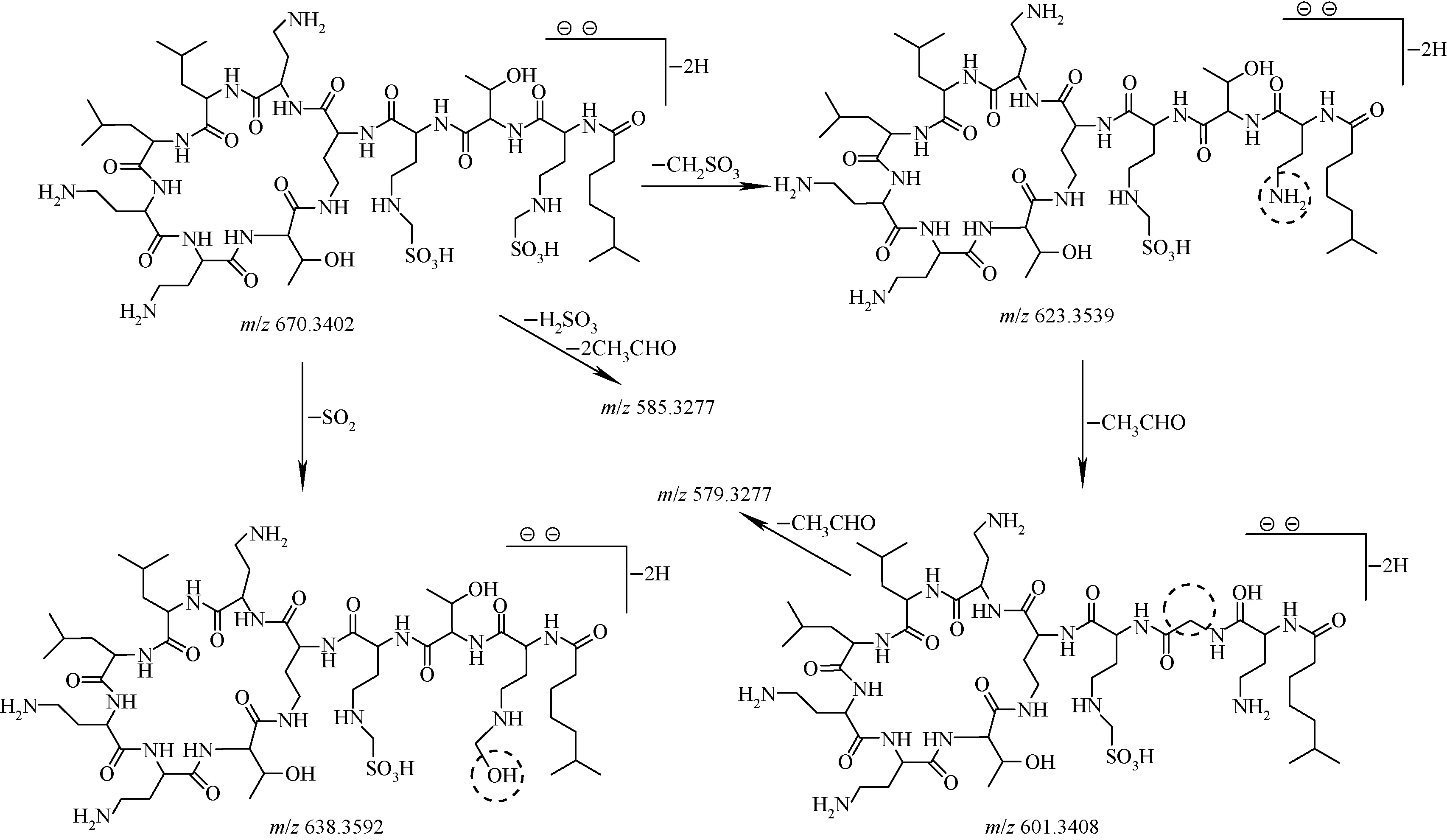
图6 二甲磺酸多黏菌素E2的[M-2H]2-离子可能的ESI-MS2断裂方式Fig.6 Proposed fragmentation pathways of [M-2H]2- of colistin B with two methanesulfonic acid groups in ESI-MS2
3 结论
本实验采用超高效液相色谱-串联四极杆飞行时间质谱技术对不同数目甲磺酸基团取代的多黏菌素E2进行了色谱分离以及质谱分析,对前药甲磺酸多黏菌素E2的色谱和质谱行为进行了研究。在ESI负离子模式下,不同数目甲磺酸基团取代的多黏菌素E2的一级质谱特征信号均为[M-2H]2-。通过分析其二级质谱裂解途径,未发现酰胺键断裂的方式,主要为中性丢失CH2SO3、H2SO3、SO2、CH3CHO,与文献[12]报道的ESI+质谱裂解明显不同。几种不同数目甲磺酸基团取代的多黏菌素E2的质谱裂解方式基本类似,但中性丢失的分子略有不同,这与甲磺酸基团取代数目有关。当甲磺酸基团取代个数较多时,易发生C—S键和C—N键断裂,以中性丢失H2SO3、CH2SO3和SO2为主;当甲磺酸基团取代个数较少时,可发生C—C键断裂,出现中性丢失CH3CHO的情况,且以中性丢失SO2和CH3CHO为主。此实验可为进一步研究甲磺酸多黏菌素E2及结构类似物质的质谱裂解规律提供基础,对甲磺酸多黏菌素E2的快速筛选鉴别、定量分析和药动学研究有参考价值。
致谢:感谢正大天晴药业集团股份有限公司为本研究提供的甲磺酸多黏菌素E2原料药。

