白杨素对结肠癌SW480细胞体内外抑制作用
冉广宇
兰州市第一人民医院药剂科,甘肃 兰州 730050
白杨素是一种从紫葳科植物木蝴蝶中提取的黄酮类化合物[1-2],具有低毒或无毒的特点,不仅具有常见的黄酮类结构,而且在A环的5位和7位上有两个羟基,使其具有广泛的生物活性,如抗炎、抗氧化、抗肿瘤活性等。大量研究显示[3-6],对于许多肿瘤细胞,包括鼻咽癌、前列腺癌、单核白血病细胞等,白杨素均具有抑制增殖和诱导凋亡的效应,但对于结肠癌SW480细胞的作用如何尚未见报道,本研究旨在探讨白杨素对体内外结肠癌细胞增殖的影响,为结肠癌的防治提供实验依据。
1 材料与方法
1.1 动物与试剂 SPF级BALB/c-裸鼠购于中国医学科学院实验动物中心,6~8周龄,16~18 g,雌雄各半,实验动物许可证号:SCXK(京)2013-0014。白杨素(Sigma公司提供);结肠癌SW480细胞(上海细胞库提供);DMEM液体培养基(HyClone公司提供);胎牛血清(Gibco/Invitrogen公司提供);细胞增殖与活性检测试剂盒(Cell counting Kit,CCK-8);赫斯特染色(Hochest)33258染色液(碧云天生物技术有限公司提供)。
1.2 方法
1.2.1 细胞培养 使用含有10%胎牛血清的DMEM液体培养基培养结肠癌SW480细胞,于37℃、5%CO2的细胞培养箱中进行培养。待细胞生长至80%~90%密度时传代(约3天传代1次)。用磷酸盐缓冲溶液(PBS)洗涤细胞3遍,2 mL/次,以1 mL的0.25%胰蛋白酶溶液,放置细胞培养箱中消化2分钟,待贴壁细胞逐渐趋于圆形时弃胰酶。用2 mL培养基反复吹打细胞,制成单细胞悬液。然后根据需要取合适细胞密度将细胞移入新培养瓶进行培养,取对数生长期细胞用于各实验。
1.2.2 结肠癌SW480细胞裸鼠异种移植瘤模型的建立 取24只BALB/c-裸鼠,无菌条件下于小鼠背部皮下接种SW480细胞悬液,密度约7×106/只。待接种的肿瘤长至100 mm3左右后认为SW480结肠癌的裸鼠异种移植模型构建完成。
1.2.3 分组给药 将24只荷瘤小鼠随机分为4组,每组6只。对照组腹腔注射二甲基亚砜(DMSO)0.1 mL/ 只;白杨素低(30 mg/kg)、中(60 mg/kg)、高(120 mg/kg)剂量组分别溶于0.1 mL DMSO中,均以腹腔注射方式给药,隔日给药1次,共10次。末次给药48小时后,将4组荷瘤小鼠全部处死,取出体内肿瘤并称重。
抑瘤率=(对照组平均瘤重-治疗组平均瘤重)/对照组平均瘤重×100%
1.2.4 细胞毒性实验 将处于生长对数期的结肠癌细胞SW480用胰酶消化后,离心并去除上清液。用DMEM培养基重新制成细胞悬液,稀释细胞密度约至2×104个/mL,取100μL种于96孔板中,待细胞完全贴壁后,将细胞悬液加入白杨素各组及 DMSO 组,使其终浓度为 20、40、80 μmol/L(μM)。每组设7个复孔,置于37℃培养箱中培养24小时,待24小时后,各孔加入CCK-8各10μL,继续培养4小时后,于酶标仪450 nm处检测吸光度OD值:
细胞增殖抑制率(%)=[(对照组OD值-空白组OD值)/(白杨素各组OD值-空白组OD值)]×100%
1.2.5 细胞凋亡的检测 取对数生长期SW480细胞,用PBS洗3次,用胰酶消化后制成细胞悬液,均匀平铺于6孔板中,待细胞完全贴壁后,将细胞悬液加入白杨素各组(20、40、80 μM)及 DMSO 组。每组设3个复孔。继续培养24小时,加入EDTA-胰酶混合液消化5分钟后,1 000 r/min离心10分钟,使用Hoechst33258染液染色2分钟后滴抗荧光淬灭液至载玻片上,将盖玻片盖至6孔板各孔中。荧光显微镜下(Nikon,400×)照相,使用Image-plus软件分析结果,统计细胞凋亡率:
凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)
1.3 统计学方法 使用SPSS 10.0软件分析数据,计量资料以(±s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 白杨素对结肠癌SW480细胞裸鼠异种移植瘤生长的影响 用药前,24只荷瘤裸鼠皮下肿瘤质地较硬,体积约(100±10)mm3。用药后,白杨素各剂量组裸鼠的活动饮食与对照组无显著不同,说明剂量不影响裸鼠的正常生活质量。白杨素低、中、高剂量组瘤块重量均低于对照组(P<0.05),抑瘤率分别为 25.91%,39.98%和56.77%,且具有剂量依赖性,提示白杨素对SW480细胞裸鼠异种移植瘤的生长具有抑制作用,见表1。
2.2 白杨素对结肠癌SW480细胞体外生长的影响 对照组SW480细胞体外生长正常,经20、40、80 μM的白杨素处理24小时后,SW480细胞生长均不同程度减慢,增殖抑制率分别为10.10%、45.63%、61.96%,且呈剂量依赖性,与对照组比较差异有统计学意义(P<0.05),见表2。
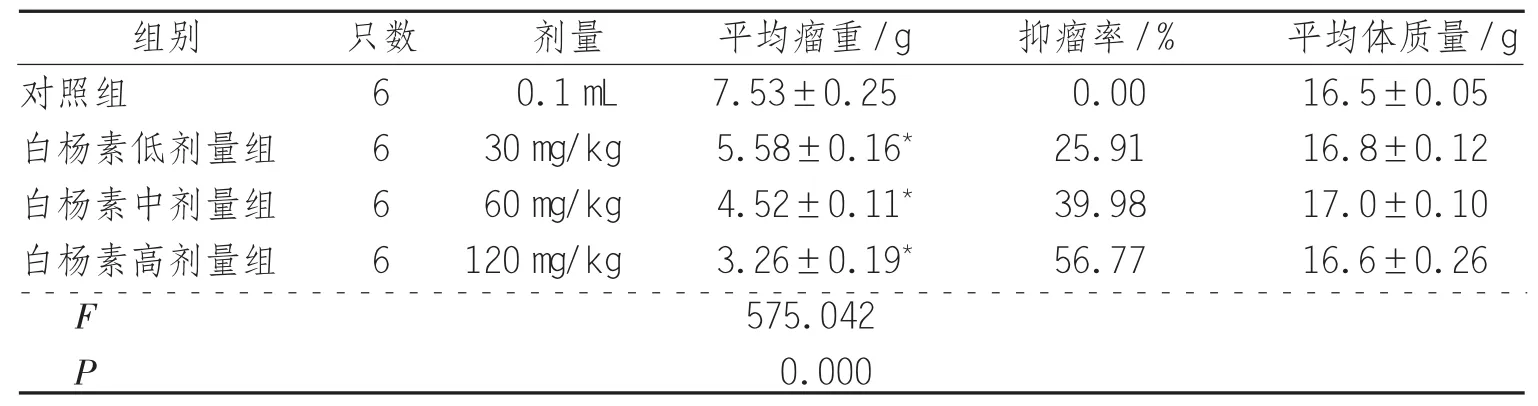
表1 结肠癌SW480细胞异种移植小鼠平均瘤重、抑瘤率和平均体质量
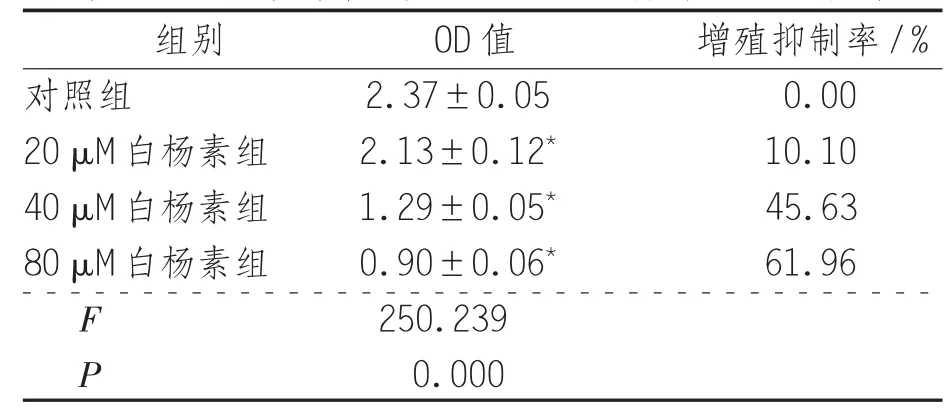
表2 白杨素对结肠癌SW480细胞体外生长的影响
2.3 白杨素对结肠癌SW480细胞凋亡的影响 对照组细胞的染色质密度均匀一致,20、40、80 μM 白杨素干预后结肠癌细胞即发生凋亡的形态学改变(P<0.05),细胞核缩小碎裂,碎裂后呈大小不等的不规则细胞碎片,且有不同程度的凋亡出现,80μM白杨素组的凋亡率高于20 μM及40 μM白杨素组,差异具有统计学意义(P<0.01),见表3、图1。
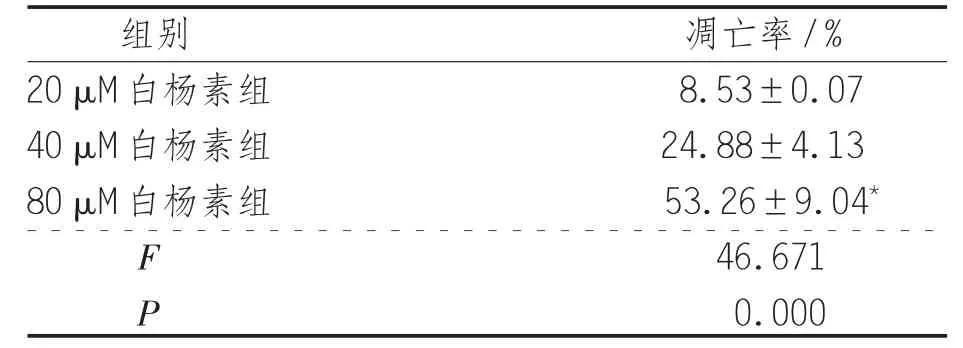
表3 白杨素对结肠癌SW480细胞凋亡的影响
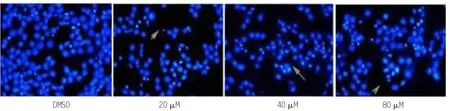
图1 白杨素对结肠癌SW480细胞凋亡的影响
3 讨论
黄酮类化合物是一种分布广泛的植物色素,易于人体吸收,在各种食物中大量存在,目前已有超过3 000种的黄酮类化合物的生物活性被鉴定[7]。白杨素又称白杨黄素,存在于紫葳科植物木蝴蝶的种子、茎皮及松科植物山白松的心木,是常见的黄酮类化合物,其在淡黄色棱柱形结晶(由甲醇中结晶)的熔点为285℃,溶于氢氧化碱溶液,微溶于乙醚、乙醇和氯仿,不溶于水[8]。有研究[9]比较多种天然黄酮类及其衍生物,证实白杨素对许多种类的肿瘤细胞具有抗增殖作用,而在正常细胞中几乎无毒。
肿瘤细胞的特点是不受控制的生长,相关研究[10-12]表明,作为一种天然的黄酮类化合物,白杨素对多种肿瘤细胞具有抑制活性作用。本研究发现白杨素可抑制结肠癌细胞SW480的生长,增殖抑制率分别为 10.10%、45.63%、61.96%,且呈剂量依赖性。同时在白杨素对结肠癌细胞SW480的凋亡试验中发现白杨素能诱导肿瘤细胞凋亡,且各剂量组出现不同程度的凋亡,出现细胞核固缩、凋亡小体等现象。
肿瘤的发生是细胞增殖与细胞凋亡平衡失调的结果,细胞凋亡在肿瘤生长过程中起负调控作用,诱导细胞凋亡能阻碍肿瘤的恶性增殖[13]。因此目前多数抗肿瘤治疗以诱导细胞凋亡为主。已有研究[14]证实,诱导肿瘤细胞凋亡是白杨素发挥抗肿瘤活性的主要机制之一。由此可推测白杨素对结肠癌细胞SW480体内生长的抑制作用可能通过诱导其凋亡实现。一些研究[15]表明,白杨素参与人类肝癌细胞HepG2及人类鼻咽癌细胞CNE-1凋亡的内在途径。
体内实验表明,把SW480细胞接种到裸鼠,采用不同浓度的白杨素进行干预,能使移植瘤体积小于对照组,说明白杨素对结肠癌细胞SW480具有体内抑制生长作用。表明白杨素对结肠癌细胞SW480增殖的抑制作用可能与其诱导细胞凋亡有关。这一结果与相关报道一致,如白杨素抑制胃癌、黑色素瘤细胞、肝癌的增殖均与其能够诱导肿瘤细胞凋亡有关。
细胞凋亡受阻是肿瘤的重要发病机制之一。核转录因子 -кB(nuclear factor kappa B,NF-кB)是一类与凋亡相关的核转录因子,NF-кB在多种肿瘤中高表达,抑制NF-кB的表达后可促进化疗药物诱导细胞凋亡[16-17]。此外,大量研究证实[18-20],白杨素诱导肿瘤细胞凋亡的机制主要包括抑制PI3K/Akt等抗凋亡蛋白;抑制I-κB激酶活性;诱导Caspase-3活性增高和下游靶点蛋白水解;诱导激活促凋亡的Bax基因;降低抗凋亡的Bcl-2基因表达;改变基于谷胱甘肽的氧化还原系统以及抑制肿瘤新生血管形成等。因此下一步将研究白杨素是否能够下调SW480细胞中NF-кB的表达,以及是否上调Bax蛋白和下调Bcl-2蛋白的表达,从而最终诱导SW480细胞发生凋亡。
尽管多数研究表明,白杨素在不同肿瘤细胞系可诱导凋亡,但到目前为止,其诱导凋亡的确切机制仍不清楚。因此,要明确白杨素诱导肿瘤细胞凋亡和抑制细胞增殖的确切机制开展进一步研究十分必要。

