烟叶陈化过程细菌群落演替特征
周家喜,喻理飞,张 健,张晓敏,胡大鸣,欧明毅,邹 晓,*
1 贵州大学生命科学学院 生态系,贵阳 550025 2 贵州中烟工业有限责任公司,贵阳 550001
烟叶陈化是指在人工可控的仓储环境下烟叶与微生物及环境相互作用的发酵过程,在此过程中,仓储环境因子(温度、湿度等)、烟叶化学组分(总糖、蛋白质、淀粉、生物酶等)含量、烟叶水分及酸碱度等与烟叶表面微生物彼此联系、互相促进、互相制约共同构成了烟叶陈化的特定生态系统,并在物质流、能量流和基因流“三流运转”规律的交互作用下构成了烟叶微生态的动态发展和特定阶段的动态平衡[1]。环境信息的传递和烟叶化学物质的改变直接或间接的影响着烟叶微生物的种类和数量及代谢产物的产生与积累,并最终决定着物质和能量的走向[2-3],因此,研究仓储生态因子和烟叶化学成分的改变对烟叶微生物群落结构和功能的影响具有重要意义。随着烟叶陈化的不断进行,微生物群落的消长演替又会引起烟叶组分微环境的变化[4],如蛋白质、淀粉、糖类、纤维素等大分子物质降解[5-6]及紫罗兰酮、大马酮、糠醛等小分子物质产生[7-8]。环境因子变化也会作用于微生物,并导致群落结构及代谢产物的成分和比例发生变化,最终形成产品特有的生态风味[9],所以,研究微生物群落动态变化对了解烟叶陈化生态系统的运行很有必要。
烟叶陈化过程中占优势的微生物群落以细菌类为主[10],但是目前90%—99%的微生物处于不可培养状态[11],因此本研究依托二代测序的技术优势[12]对样品中微生物菌群进行分析,同时结合分析陈化过程中烟叶化学组分的变化,揭示细菌群落变化过程与烟叶化学组分之间作用规律,加深对烟叶陈化机制的理解。
1 材料与方法
1.1 材料
样品:分别陈化了0、6、12、18、24个月的云南保山C3F烟叶样品(产地:云南保山地区;品种:云87;等级:C3F);采集地:贵阳库(GY)、坛厂库(TC)、紫云库(ZY);采集方式:除去烟箱表层烟叶,按五点式收集烟叶样品,500g,存于-20℃冰箱中,各库样品同一时间内采集;采集时间:2014年7月、2015年1月、2015年7月、2016年1月、2016年7月;编号:GY-0、TC-0、ZY-0、GY- 6、TC- 6、ZY- 6、GY- 12、TC- 12、ZY- 12、GY- 18、TC- 18、ZY- 18、GY- 24、TC- 24、ZY- 24。
1.2 方法
1.2.1 烟叶微生物收集与总DNA提取
参照Zhao等[13]和Su等[14]的网膜法收集烟叶总微生物。称取60g烟叶样品,剪碎,平均分成3份,分别置于3个装有200mL pH=7.0磷酸缓冲溶液(PBS)的三角瓶中,27℃、200r/min震荡培养1h;用已灭菌的双层纱布过滤培养物,收集滤液;6000r/min室温离心30min,收集沉淀;加入20mL PBS缓冲液,重新制成菌悬液,6000r/min离心,收集沉淀,最后将相同样品的沉淀物汇集到一起,即为烟叶总微生物。参照OMEGA公司E.Z.N.A.® SoiL DNA Kit试剂盒说明方法提取微生物总DNA。提取的总DNA送北京诺和致源科技股份有限公司进行高通量测序。
1.2.2 PCR扩增及高通量测序
选取16S rRNA基因 V4片段进行PCR扩增,扩增产物使用HiSeq2500 PE250进行上机测序。选用引物:515F(5′-GTGCCAGCMGCCGCGGTAA- 3′)和806R(5′-GGACTACHVGGGTWTCTAAT- 3′)。反应体系(30μL):Phusion Master Mix(2×) 15μL;Primer1(2μmol/L)1.5μL;Primer2(2μmol/L)1.5μL;DNA模板(1ng/μL)10μL;H2O 2μL。反应程序:98℃预变性1min;98℃ 10s,50℃ 30s,72℃ 5min,共30个循环;72℃延伸5min。
1.2.3 化学物质检测
参照李永忠等[15]方法进行烟叶常规化学物质检测,每个样品设置3个重复。有机碳采用高温外热重铬酸钾氧化容量法;全氮采用H2SO4-H2O2消化-蒸馏法;全磷采用H2SO4-H2O2消化-钼黄比色法;全钾采用H2SO4-H2O2消化-火焰分光光度法;水溶性总糖采用80%酒精浸提-蒽酮比色法;烟碱采用碱蒸馏-紫外分光光度法;淀粉采用稀酸水解-蒽酮比色法;蛋白质采用凯氏定氮法;粗纤维采用酸碱洗涤-重量法;石油醚浸提物采用石油醚浸提-重量法。
1.2.4 数据处理
①序列处理及OTU注释:根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,截去Barcode和引物序列后使用FLASH[16]对每个样品的Reads进行拼接,得到原始Tags数据;参照Qiime[17]的Tags质量控制流程,经过Tags截取、过滤及嵌合体去除等处理后得到高质量的有效Tags数据。利用Uparse软件,以97%的一致性将序列聚类为OTUs(Operational Taxonomic Units),选取OTUs的代表性序列用Mothur方法与SSU rRNA数据库对OTUs进行物种注释,并在OTU水平上进行α多样性分析。
②细菌群落动态变化分析:通过韦恩图分析陈化不同时间的样品OTUs分布差异;根据所有样品在属水平的物种注释及丰度信息,选取丰度排名前35的类群,从物种和样品两个层面进行聚类,绘制成热图,分析不同陈化时间样品优势细菌类群变化情况;通过LEfSe系统分析不同陈化时间的样品间显著差异的物种。
③细菌群落变化与化学成分关系分析:结合不同陈化时间优势细菌及关键类群,利用SPSS 19.0、CANOCO 5等统计学软件对细菌群落与各化学指标进行相关性分析和冗余分析(RDA)。
2 结果与分析
2.1 高通量测序结果

图1 Shannon-Winner指数曲线Fig.1 The Shannon-Winner curves GY:贵阳库;TC:坛厂库;ZY:紫云库;0、6、12、18、24:陈化时间,0个月、6个月、12个月、18个月、24个月
Shannon-Winner指数曲线可反映各样本的物种多样性随测序量的变化情况[18]。如图1所示,随着样品序列数的增加,Shannon-Winner指数曲线越趋向平坦,表明本试验测序的数据深度能较全面地反应测序样品中微生物信息。
样品DNA高通量测序结果如表1所示,经拼接、优化、过滤后得到1191887条有效序列,每个样品得67940—86235条;以97%的一致性将序列聚类,平均得到1099个OTU。对不同样品的α多样性指数进行对比分析发现,样品细菌丰富度的Chao1指数和ACE指数分别在510.34—3528.94和520.33—2226.74之间。反映菌群多样性的Shannon和Simpson值分别达到3.47—6.59和0.70—0.96。其中,样品GY-0细菌最丰富,多样性最大,Shannon指数达6.59,样品ZY- 18多样性最低,Shannon指数为3.47;样品GY- 24和TC-0均匀性最好,Simpson指数均达到0.97,ZY- 18均匀性最差,Simpson指数为0.70。所有样品Coverage指数均达到0.98以上,表明本次研究所测得的数据足够反应烟叶细菌群落的多样性。

表1 样品测序结果及α多样性指数信息
GY:贵阳库;TC:坛厂库;ZY:紫云库;0、6、12、18、24:陈化时间,0个月、6个月、12个月、18个月、24个月
2.2 细菌群落组成
烟叶细菌种类丰富,分属于493个属,每个样品相对丰度大于1.0%的类群组成,如图2所示(< 1.0%的归于Others)。假单胞菌属、鞘氨醇单胞菌属、寡养单胞菌属、芽孢杆菌属为主要优势类群,其中,假单胞菌属占主导优势,占17.8%—44.3%,其次是鞘氨醇单胞菌属,占8.0%—23.6%。

图2 属水平上相对丰度柱状图Fig.2 Histogram of relative abundance at the genus level
2.3 不同陈化时间烟叶细菌群落动态演替分析
2.3.1 OTU变化分析
在OTU水平上绘制韦恩图,如图3所示。贵阳库(图3A)样品有313个共有OTUs,陈化0、6、12、18、24个月时分别有267、110、90、120、159个特有OTUs。坛厂库(图3B)样品有170个共有OTUs,陈化0、6、12、18、24个月时分别有249、82、126、115、262个特有OTUs。紫云库(图3C)样品有176个共有OTUs,陈化0、6、12、18、24个月时分别有192、97、140、41、264个特有OTUs。共有的OTUs表明这些细菌类群的作用在烟叶陈化过程中贯穿于陈化的始终,是烟叶陈化的主要细菌类群;不同陈化阶段特有OTUs表明烟叶陈化过程中功能细菌群落与陈化进程密切相关,演替现象明显。
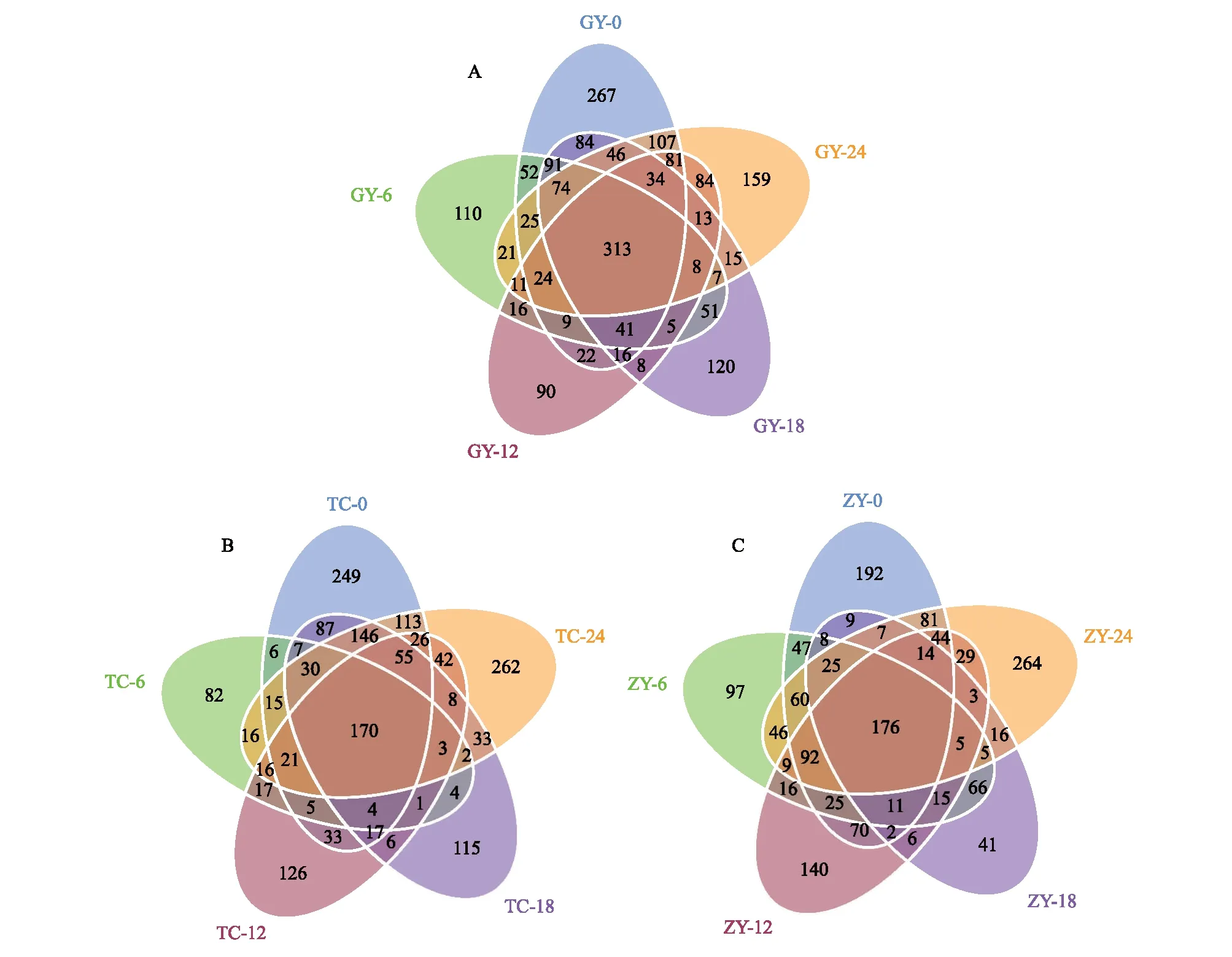
图3 不同陈化时间样品OTUs韦恩图Fig.3 Analysis of OTUs from samples of different aging time via Venn diagram图A:贵阳库样品OTUs;图B:坛厂库样品OTUs;图C:紫云库样品OTUs
2.3.2 优势细菌类群变化分析
针对陈化不同时间对所有样品进行组合分析,发现烟叶细菌群落结构随陈化时间的延长发生了较大变化(图4)。陈化开始时拟杆菌门的Sphingobacterium,变形菌门的Steroidobacter、Aquicella、Legionella、Pseudoxanthomonas、Methylobacterium及厚壁菌门的Romboutsia等类群占优势。6个月时变形菌门的Pusillimonas和Vulgatibacter占优势。12个月时绿弯菌门的unidentified_Anaerolineaceae占优势。18个月时,所有类群的丰度都相对较低,变形菌门的Pusillimonas占优势。24个月时,变形菌门的Stenotrophomonas和Comamonas,厚壁菌门的Solibacillus、Bacillus、Staphylococcus、Paenibacillus及放线菌门的Kocuria等类群优势明显。
整体来看,随着烟叶陈化时间的增加,细菌优势类群种类先减少后增加,其中变形菌类逐渐减少,厚壁菌类和放线菌类逐渐增加,这种变化与李晓强研究结果相似[19]。
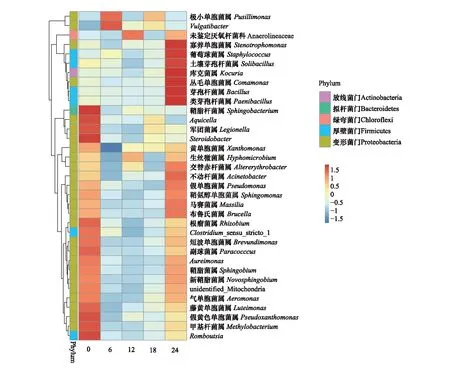
图4 不同陈化时间样品物种丰度聚类热图Fig.4 Heatmap of species abundance for samples of different aging time
2.3.3 关键细菌类群变化分析
通过LEfSe分析(LDA 值默认为4)发现,在烟叶陈化0、12、24个月时样品之间具有显著差异的细菌类群,结果如图5所示。陈化开始时Methylobacterium差异显著,起重要作用。陈化12个月时 Enterobacteriaceae起重要作用。陈化24个月时Bacillus、Sphingomonas、Comamonas、Pseudomonas差异明显,发挥重要作用。LEfSe分析表明随烟叶陈化时间延长,关键优势菌群发生一系列演变,先是由Methylobacterium向Enterobacteriaceae演变,随后向Bacillus、Sphingomonas、Comamonas、Pseudomonas变化。其中,Methylobacterium、Sphingomonas、Comamonas、Pseudomonas、Enterobacteriaceae均属于变形菌门类群,Bacillus属于厚壁菌门类群,因此,随陈化时间延长,厚壁菌门优势逐渐增加,芽孢杆菌优势度后期明显增强。
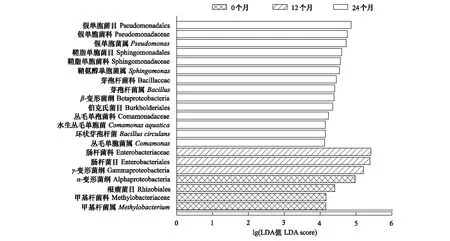
图5 不同陈化时间物种LDA值分布柱状图Fig.5 The LDA score distribution histogram of LEfSe analysis in different aging time
2.4 细菌群落演替与烟叶化学成分的关系
RDA分析结果中,轴1和轴2累积变量分别为50.70%和73.24%,化学物质变化对细菌群落演替整体解释量为78.90%。据图6和表2可知,水溶性总糖对细菌群落动态影响最大,其次是纤维素。陈化开始时(Ⅰ),水溶性总糖贡献最大,与Pusillimonas显著负相关,相关系数为-0.546,与Steroidobacter、Romboutsia、Clostridium_sensu_stricto_1、Legionella显著正相关,相关系数分别为0.613、0.613、0.656、0.517。陈化12个月时(Ⅱ),淀粉、石油醚浸提物及总氮、总磷等影响最大,石油醚浸提物与Xanthomonas呈显著负相关,相关系数为-0.541,与Pusillimonas、Vulgatibacter呈显著正相关,相关系数为0.579、0.524;总磷与Xanthomonas呈显著负相关,相关系数为-0.528。陈化24个月时(Ⅲ),纤维素作用最明显,与Staphylococcus、Aureimonas、Massilia呈显著正相关,相关系数为0.562、0.539、0.528。随着时间的延长,细菌群落发生了由降解糖类向降解淀粉类菌群变化,再向降解纤维素类菌群变化的演替现象,这与化合物的逐级降解相关。

图6 优势细菌群落与化学物质RDA分析Fig.6 Redundancy analysis based on bacterial community and chemical substanceb1—b24:假单胞菌属Pseudomonas、寡养单胞菌属Stenotrophomonas、芽孢杆菌属Bacillus、鞘氨醇单胞菌属Sphingomonas、丛毛单胞菌属Comamonas、甲基杆菌属Methylobacterium、葡萄球菌属Staphylococcus、Aureimonas、黄单胞菌属Xanthomonas、马赛菌属Massilia、类芽孢杆菌属Paenibacillus、极小单胞菌属Pusillimonas、Steroidobacter、unidentified_Anaerolineaceae、土壤芽孢杆菌属Solibacillus、Romboutsia、鞘脂杆菌属Sphingobacterium、库克菌属Kocuria、Clostridium_sensu_stricto_1、Vulgatibacter、军团菌属Legionella、Aquicella、假黄色单孢菌属Pseudoxanthomonas、肠杆菌科Enterobacteriaceae
3 讨论
烟叶陈化是在环境可控的人工仓储设施内进行的自然发酵过程。在此过程中烟叶不仅为复杂的微生物体系提供了栖息地和营养物质,还为微生物活动提供多样的生态位,以维持陈化生态系统的正常运行;反之,微生物在满足自身生长繁殖的同时,分泌各种生物酶分解有机大分子物质,促进烟叶的陈化进程。本研究发现烟叶表面细菌物种丰富,以假单胞菌属、鞘氨醇单胞菌属、寡养单胞菌属、芽孢杆菌属等为优势类群,这与前人研究结果相似[20-21]。近年来发现许多假单胞菌菌株能高效降解烟叶尼古丁[22];部分芽孢杆菌能分泌蛋白酶、淀粉酶等多种生物酶,促进烟叶大分子物质降解[6];鞘氨醇单胞菌是降解芳香化合物的新型生物资源[23],对烟叶芳香类化合物的降解具有广泛应用前景。因此,烟叶陈化是多种微生物协同作用的结果,微生物是陈化的主要驱动因子。
烟叶陈化是一个微型动态过程,早期研究表明随陈化时间的延长,烟叶表面细菌数量、种类及多样性后期明显呈下降趋势[24-25],但对于具体菌群的变化还不明确。本研究结果表明,随陈化时间的增加,细菌群落消长演替,优势细菌类群不断变化,由变形菌门向厚壁菌门演变,芽孢杆菌后期作用显著。目前对于烟叶陈化过程中微生物群落变化主要有两种解释:第一种观点认为是陈化环境条件决定了烟叶上微生物的丰度和种类及其演化过程。Di Giacomo等研究人员认为,环境温度和pH是促进微生物动态演替的主要动力之一[4]。浦绍占等在研究云南玉溪红塔区和元江县两仓库中不同自然陈化时期的红大品种烤烟表面微生物种群结构时,发现不同时期、不同地点陈化烟叶表面细菌的优势种群不尽相同[3]。Chopyk等比较了在室温、冰箱、人的口袋三种不同储存条件下五种不同品牌香烟制品细菌群落组成及动态变化,发现香烟品种对烟叶细菌群落影响不大,而储存条件对烟叶微生物丰度及动态变化影响较大[26]。这主要是由于不同的储存地或储存方式中环境温度、湿度、pH及其他生态因子的不同而导致烟叶表面微生物群落结构的差异。第二种观点认为是由于化学成分的改变而引起烟叶微生物群落的改变。叶建斌等曾推测在原烟进入陈化阶段后,由于培养成分的改变,适者生存,不适者淘汰,从而形成了新的微生物群落结构[27],但他们没有对该推测进行验证。本研究发现(表2)在烟叶陈化开始时,水溶性总糖的影响较大,与优势菌群甲基杆菌类呈正相关关系;12个月时,淀粉、石油醚浸提物及总磷、总氮等的影响较大,与肠杆菌类呈正相关关系;24个月时,纤维素是影响的主要因素,与芽孢杆菌类、鞘氨醇单胞菌类、丛毛单胞菌类、假单胞菌类等优势菌群呈正相关关系。本研究还发现细菌间的衔接与烟叶有机质的逐级降解相关联(图6),前期主要是以能降解糖类和淀粉的微生物为主,后期主要是以能降解纤维素和木质素的微生物为主。这充分证实了化学成分的改变是微生物群落演替变化的主要动力之一。

表2 细菌群落变化与烟叶化学成分相关性分析
*在0.05水平相关性显著,**在0.05水平上相关性极显著
在烟叶陈化生态系统中,陈化是在微生物的驱动下进行的,而烟叶的陈化伴随着微生物的演替,微生物的演替受陈化环境和化学成分的共同驱动。通过对烟叶微生物群落组成、群落演替分析,可以确定最优的微生物群落组成,对微生物群落变化与化学成分关系分析,有助于烟叶陈化进程的人工调控。

