杨梅叶中花色苷提取工艺优化
金 茜,赵 特,胡明华
(遵义师范学院,贵州遵义 563006)
花色苷是目前清除氧自由基和脂质过氧化的抑制剂之一[1-9],是一种天然色素,在欧美等国家已广泛应用于医药和保健食品行业[10-11]。提取花色苷的方法有双水相法、超声波法、微波法、酶解法等[12-14]等。本试验以恒温水浴震荡器为辅助仪器,采用溶剂提取法进行花色苷的提取,为杨梅叶资源综合利用提供参考。
1 材料与方法
1.1 仪器与试剂
仪器:SHIMADZU AUX220 电子天平,日本岛津;T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;TGL-16G离心机,上海安亭科学仪器厂制造;SHA-B恒温水浴震荡器,金坛市科析仪器有限公司;FW135中草药粉碎机,天津市泰斯特仪器有限公司;ZK-82B真空干燥箱,天津天有利科技有限公司;pHS-3C型精密算度计,上海大普仪器有限公司。
试剂:无水乙醇(AR)、混合磷酸盐缓冲溶液(pH=6.86)、氯化钾(AR)、浓盐酸(AR)、乙酸钠(AR)、pH1.0氯化钾缓冲溶液、pH4.5乙酸钠缓冲溶液,所有试剂均购自成都试剂厂。
1.2 材料
杨梅叶,2016年6月—2017年1月采摘于遵义,洗净后晾干或低温烘干,粉碎,避光保存。
1.3 杨梅叶中花色苷的提取方法
准确称取一定量的杨梅叶粉末,以80%的乙醇为提取剂,盐酸质量分数为0.3%,在60℃的恒温水浴震荡器里浸提60min,于5 000r/min离心10min。
1.4 花色苷最大吸收光谱的测定
提取液用紫外可见分光光度计进行光谱扫描,测定杨梅叶中花色苷的最大吸收波长。由图1可知,杨梅叶花色苷在520~550nm之间有明显的吸收峰,在538nm处有最大吸收,故其最大吸收波长为538nm。
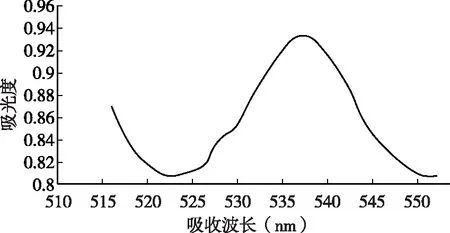
图1 杨梅叶花色苷特征吸收光谱
1.5 pH示差法测定花色苷含量
在不同的pH条件下,花色苷会表现出不同的结构,当pH=1.0时,花色苷以有色的黄烊盐正离子的形式存在;当pH=4.5时,则以无色半酮缩醛形式存在。两种物质的吸光度有很大差别,但结构都相对稳定,故可用pH示差法测定花色苷的含量[15]。各取上清液1mL,分别加入氯化钾缓冲溶液(pH1.0)和醋酸钠缓冲溶液(pH 4.5)各9mL,混合后平衡1h,用乙醇溶液作空白,在最大吸收波长λmax和700nm(校正浑浊度)处测得稀释后样品的吸光值。根据式(1)、(2)计算花色苷的含量。
花色苷浓度(mg/L)=[(Aλmax-Aλ700)pH 1.0-(Aλmax-Aλ700)pH 4.5]×Mw×DF×1 000/k
(1)
式(1)中,Mw—相对分子质量;DF—样品稀释倍数;k—摩尔吸光系数。当k未知或样品成分未知时,将矢车菊-3-葡萄糖苷作为标准物,此时Mw=449.2,k=26 900。
花色苷含量m(mg/g,DW)=C×V/m0
(2)
式(2)中,DW—样品为干重状态;V—浸提液体积;m0—样品干重时的质量。
2 单因素试验与分析
2.1 乙醇浓度的选择及对花色苷提取率的影响
由图2可知,花色苷的提取率随乙醇浓度的变化而改变,当乙醇浓度为80%时,花色苷提取率最高。

表1 花色苷提取率随乙醇含量的变化
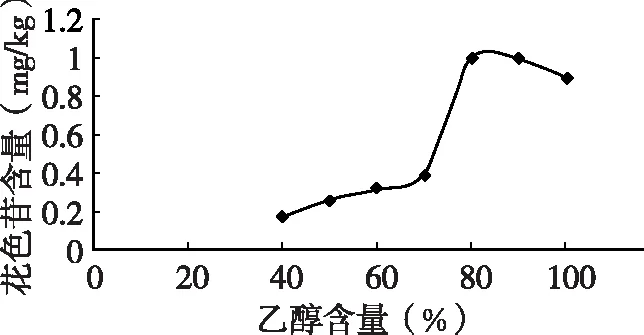
图2 乙醇含量对花色苷提取量的影响
2.2 提取时间对花色苷提取率的影响
由图3可知,当提取时间为60min时,花色苷的提取率达到最大,随后花色苷的提取量下降。随着提取时间的延长导致了其他成分含量的增加,且提取率下降,同时延长了试验的时间,因此选取60min作为提取的最佳时间。

图3 提取时间对花色苷提取量的影响
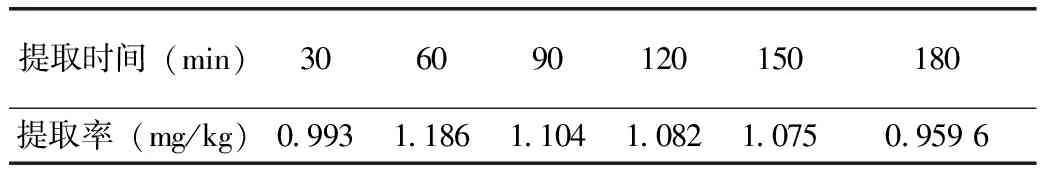
表2 花色苷提取率随时间的变化
2.3 提取温度对花色苷提取率的影响
由图4可知,当温度不断升高,杨梅叶中花色苷的提取率不断上升,当提取温度达到60℃时提取率达到最大,并随温度的升高而急剧下降,与文献[16]结果一致,可能是花色苷的结构在较高的温度环境下受到了破坏,因此提取花色苷的温度应控制在60℃左右。

表3 花色苷提取率随提取温暖的变化
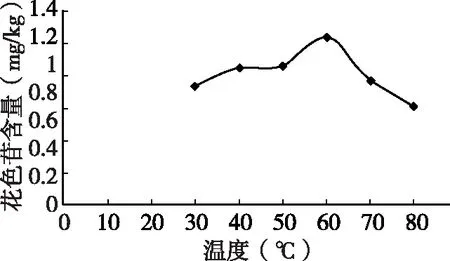
图4 提取温度对花色苷提取量的影响
2.4 料液比对花色苷提取率的影响
由图5可知,随着料液比的增加花色苷的提取率不断上升,当料液比为1∶70时,花色苷的提取率趋于稳定,因此选取的料液比为1∶70。

表4 花色苷提取率随料液比的变化
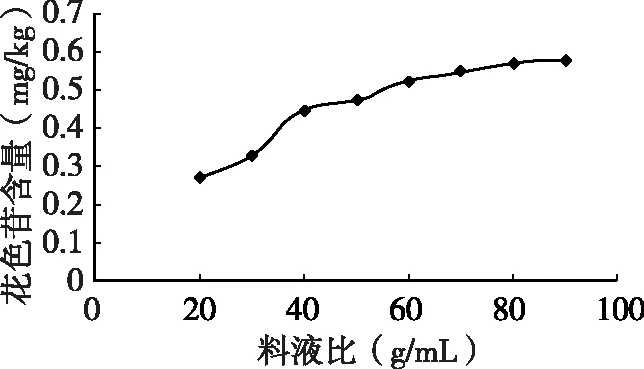
图5 料液比对花色苷提取量的影响
2.5 最佳盐酸浓度对花色苷提取率的影响
由图6可知,当盐酸浓度为0.3%时,花色苷的提取率达到最大,当酸度过高时花色苷的提取率反而下降,可能是花色苷中的糖苷键水解导致色苷提取率下降[17]。因此试验时选取0.3%的盐酸浓度。
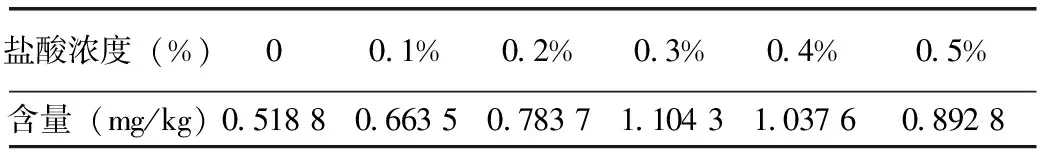
表5 花色苷提取率随盐酸浓度的变化
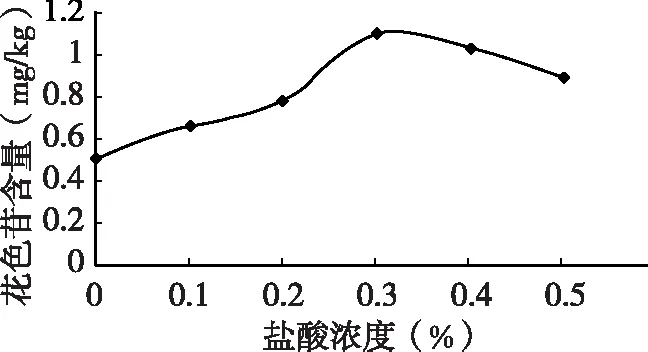
图6 盐酸体积分数对花色苷提取量的影响
2.6 最佳提取次数对花色苷提取率的影响
由图7可知,当提取次数为1时,杨梅叶中花色苷的提取率最高,因此提取次数为1。
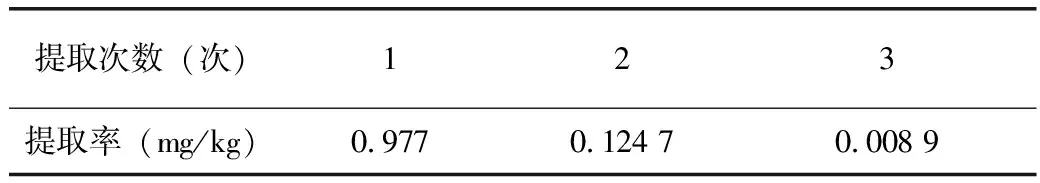
表6 花色苷提取率随提取次数的变化
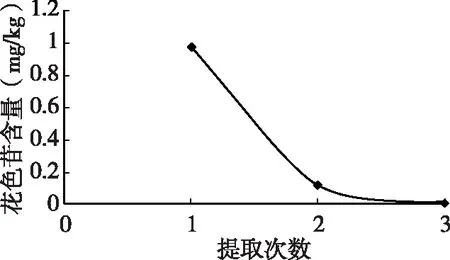
图7 提取次数对花色苷提取量的影响
3 花色苷提取的多因素正交试验
按照四因素三水平进行正交试验L9(34),对浸取时间、浸提温度、乙醇含量、料液比4个因素进行优选(表7、表8)。由极差(R)分析知,料液比对杨梅叶中花色苷的提取影响较大,其次是提取温度和提取时间,影响最小的是提取剂浓度,即A>D>C>B,比较综合各因素的 K 值,最佳提取工艺为料液比为1∶70、乙醇含量为80%、温度为60℃、提取时间为60min,此条件下的提取率最高。
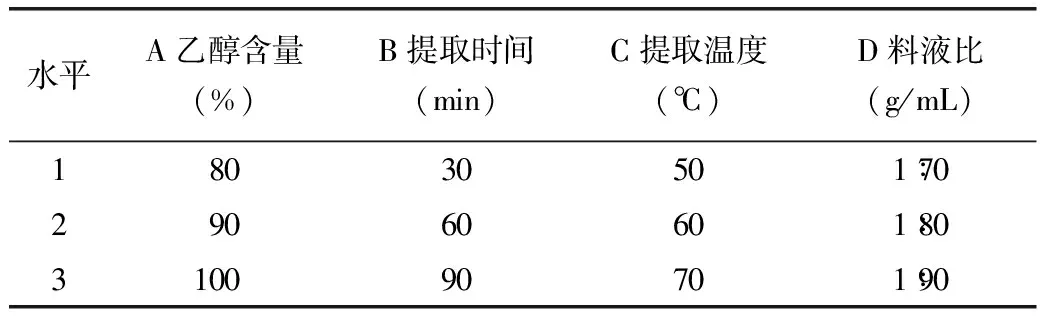
表7 正交试验因素水平

表8 正交试验结果
4 结论
杨梅叶花色苷最佳提取工艺为料液比为1∶70、乙醇含量为80%、温度为60℃、提取时间为60min,此条件下的提取率最高。该提取方法操作简单、方便、无污染。从杨梅叶中提取的花色苷粗产品可进一步纯化,用于饮料、食品及医药中,为充分利用杨梅叶资源提供了参考依据。◇

