浅析吉西他滨对人非小细胞肺癌A549细胞增殖与凋亡的影响
, ,
(肇庆医学高等专科学校基础医学部,广东 肇庆 526020)
肺癌为全球最为常见的一种恶性肿瘤,具有较高发病率与死亡率,其发病病因主要与吸烟、遗传、职业暴露、环境污染、电离辐射等因素相关。患者发病后会出现胸部胀痛、咯痰、痰血、低热等症状。有相关研究表示,在肺癌总数中,非小细胞肺癌达到80%左右[1-2]。肺小细胞肺癌主要有腺癌、鳞癌、大细胞癌等,与小细胞肺癌相比,其具有癌细胞生长分裂较慢的特点,癌细胞扩散与转移也较晚[3]。非小细胞肺癌患者常见并发症包括胸腔积液、淋巴转移、心包积液等,目前临床治疗非小细胞肺癌主要采用分期手术、化疗等手段。虽然目前医学相对较为发达,医学技术不断进步与发展,但非小细胞肺癌预后相对较差,患者生存率降低。有相关研究表示,细胞增殖与及凋亡与肿瘤发生具有密切的关系,人体内正常细胞凋亡功能减弱,使得异常细胞难以被清除,导致基因调控难以维持平衡,进而堆积形成肿瘤[4-5]。因此临床将诱导肿瘤细胞增殖和凋亡作为目前治疗非小细胞肺癌的主要原则。吉西他滨是一种新型抗代谢肿瘤药物,本研究通过分析吉西他滨体外对人非小细胞肺癌A549细胞增殖及凋亡的作用,现报告如下。
1 资料与方法
1.1一般资料:资料收集时间在2014年2月~2016年5月,对象为人非小细胞肺癌A549细胞,由我院呼吸内科实验室进行冰冻储存。细胞培养:使用RPMI1640 培养液在5%二氧化碳、37℃的细胞培养箱内进行培养,采用0.02%乙二胺四乙酸与0.25%胰酶进行消化传代,使用比例为1∶1,本次研究所用细胞均处于指数生长期。
1.2方法:MTT法:使用0.25%胰蛋白酶对细胞进行消化,接种96孔板,密度为1×104,将无细胞的培养液作为空白对照。细胞贴壁后将不同浓度吉西他滨加入,随后采用酶联免疫仪对490 nm处的吸光度值进行检测。
流式细胞仪:不同浓度药物对细胞处理72 h后行细胞消化,并将悬浮细胞进行收集,将密度调整为5×105~1×106个/ml,将1 ml细胞离心操作,加入70%乙醇于细胞内,并将置于-20℃低温固定过夜,采用PBS进行清洗2次。随后加入PI 50 μg/ml与Rnase A 1 mg/ml,于室温避光条件下进行染色处理,半小时后上机进行检测。
Annexin V-PI双标法:将不同浓度药物对细胞处理72 h后,经流式细胞仪检测后使用CELIQUEST软件对其凋亡率进行分析。bcl-2表达检测:将细胞在不同吉西他滨浓度下分别培养24 h、48 h、72 h,随后将其制成盖玻片,进行细胞标本培养,采用配套试剂盒操作后,使用图像分析仪分析。
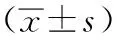
2 结果
2.1吉西他滨体外对A549细胞增殖影响:不同浓度吉西他滨对A549细胞均有抑制作用,在时间、剂量上差异均有统计学意义(P<0.05)。详见图1。
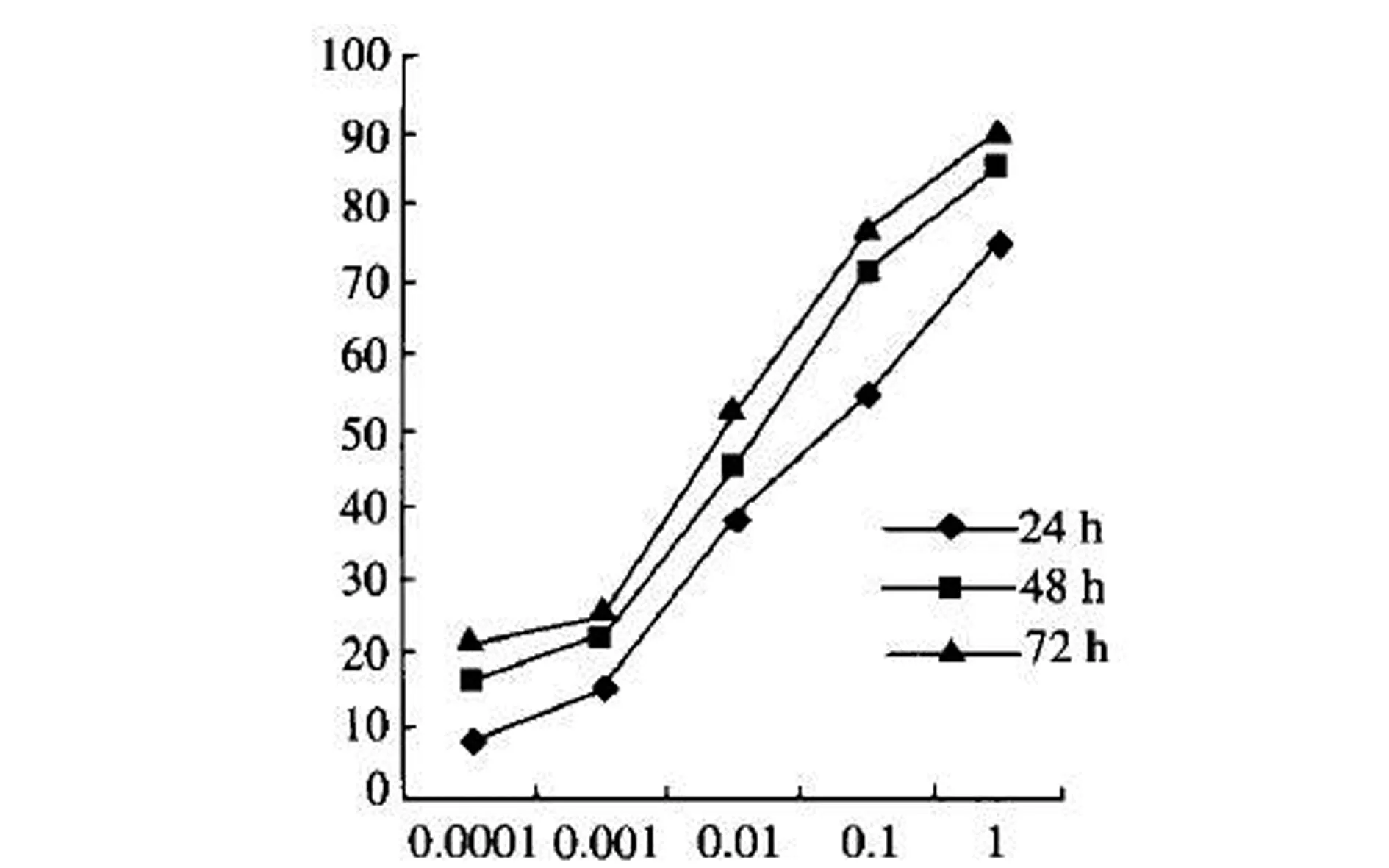
图1 吉西他滨体外对A549细胞增殖的影响:纵轴代表抑制率(%),横轴代表药物浓度(μg/ml)
2.2不同浓度吉西他滨体外对A549细胞周期影响:药物浓度增加后,G0/G1使其细胞比例逐渐升高,S时期比例逐渐下降,提示药物浓度对细胞周期有显著影响。见表1。
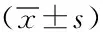

浓度(μg/ml)G0/G1SG2/M0.00151.7±3.234.5±5.214.6±2.70.0142.5±3.738.7±4.317.9±2.30.141.3±5.149.5±6.111.1±3.7115.9±4.271.8±4.69.1±2.3
2.3细胞凋亡率分析:经Annexin V-PI双标法检测结果显示,72 h后不同浓度细胞凋亡率分别为(4.8±0.3)%、(8.1±0.6)%、(14.9±0.4)%、(31.6±1.2)%,提示吉西他滨浓度增加,细胞凋亡率为显著增加。
2.4bcl-2表达:经免疫组化法后,DAB染色后可见各组细胞浆内有棕黄色物质,呈颗粒状,分布深浅不一,将药物处理前后细胞棕黄色物质平均吸光度进行比较,配对t检验后差异有统计学意义(P<0.05)。提示经吉西他滨作用后,bcl-2表达与细胞凋亡率有相关性,呈负相关。
3 讨论
细胞凋亡指在细胞调控下由基因介导发生的主动自杀现象[6]。细胞凋亡与调控基因出现异常可有效反映出人体内肿瘤的生物学特性。因此诱导肿瘤细胞增殖及凋亡成为近年来临床工作者研究肿瘤的重点。吉西他滨是一种新型胞嘧啶核苷衍生物,进入人体后通过脱氧胞嘧啶激酶活化,通过胞嘧啶核苷脱氨酶代谢,是一种抗肿瘤药物[7-8]。吉西他滨通过在细胞内转化为磷酸化代谢物,有效发挥出细胞毒效果。有相关研究表示,吉西他滨药敏性与人体内dCK水平有密切相关性,成正相关性。吉西他滨进入人体后,被体内细胞摄入,会转化为活性代谢物,如二磷酸酯、三磷酸酯等,可竞争性对DNA链延长进行有效抑制,进而促使DNA片段形成与细胞发生死亡。
有相关研究结果表示,吉西他滨在非小细胞肺癌治疗中具有一定效果。但目前临床对吉西他滨抑制肿瘤的作用机制并不清楚,相关研究也较少。本次研究中分析了吉西他滨对A549细胞凋亡增殖、周期、凋亡的影响。结果显示不同浓度吉西他滨对A549细胞均有抑制作用,在时间、剂量上均差异有统计学意义(P<0.05)。通过流式细胞仪检测出细胞周期,药理学特性主要作用S期。采用Annexin V-PI双标法获取不同药物浓度下的凋亡率,随药物浓度增加,细胞凋亡率逐渐升高,提示吉西他滨诱导细胞凋亡效果显著。
虽然吉西他滨诱导细胞凋亡效果显著,可作为治疗非小细胞肺癌的有效药物,但大部分细胞对药物存在一定抵抗性,目前临床对吉西他滨如何诱导细胞凋亡的作用机制尚不完全明确。笔者认为,可通过选择性激活通道增加药物疗效,有效降低其细胞耐药性。有相关研究表示,吉西他滨可有效促进和核浓缩与凋亡通路效应Caspase-3激活,对特定蛋白底物水解进行有效抑制,并通过核转录因子与Akt有效使细胞凋亡[9-10]。另外有相关研究表示,吉西他滨诱导肿瘤细胞凋亡与神经酰胺途径相关,可通过对神经鞘脂循环进行激活,进而生成内源性神经酰胺使其聚集,对Caspase-3进行激活,进而诱导Caspase-9与bcl-X发生剪接变化[11]。由神经酰胺介导的肿瘤细胞凋亡可使用Caspase抑制剂进行阻滞,也能被bcl-2进行抑制。但目前临床对bcl-2介导有无参与到吉西他滨诱导细胞凋亡的过程中尚不清楚,相关研究较少。本次研究中,通过使用免疫组化染色处理后,将药物作用前后吸光度值进行比较,发现bcl-2表达呈下调现象,其与细胞凋亡率间关系呈负相关。bcl-2表达下调可对Ca2+进行阻断,保持滑面内质网钙的稳定性,进而阻止细胞凋亡出现,此外还可通过对Caspase-3激活进行抑制,将生理性刺激、病理性刺激诱导细胞凋亡的过程进行抑制。
综上所述,吉西他滨用于非小细胞肺癌治疗中具有一定效果,可有效对A549细胞体外增殖进行抑制,并诱导细胞凋亡,bcl-2参与细胞凋亡过程中并具有一定作用。但目前其在人体内具体机制尚不清楚,还需进行深入研究与分析。

