抑制外泌体释放对骨髓间充质干细胞生物学特性的影响*
郭贵显, 成传访▲, 顾杰蕾, 周文怡, 汤晓燕, 钟 赟, 陈颜芳, 2, 刘世明△
(1广州医科大学附属第二医院心内科, 广州心血管疾病研究所, 广东 广州 510260; 2莱特州立大学Boonshoft医学院药理学与毒理学系, 美国 俄亥俄州 代顿 45435)
缺血性心脏病是严重威胁人类健康的疾病之一。由于心脏内源性修复机制有限,心肌缺血梗死后引起心肌细胞的永久性缺失,导致局部纤维瘢痕的形成,从而导致左室重构,最终引起心力衰竭。对于缺血性心脏病的治疗现阶段主要有药物治疗、介入治疗及手术治疗,但这些方法都有一定的局限性,使治疗效果不能令人十分满意。近年兴起的细胞移植新方法对未来治疗心血管疾病具有重要的应用价值。现已有多种细胞尤其是干细胞用于治疗心肌梗死的研究,骨髓间充质干细胞作为细胞移植治疗的种子细胞,具有取材方便、免疫原性低、不受伦理学限制、容易进行自体移植等诸多优点[1]。
移植的间充质干细胞到达心肌梗死部位后在局部产生多种生物学效应,除了增殖分化为血管内皮细胞及少量分化为心肌样细胞外,还能通过旁分泌的方式产生大量的促血管生成因子等保护性细胞因子,改善缺血心肌的血液供应或心肌代谢,以此来参与心脏组织的重建,从而改善心肌梗死后心功能[2]。尽管如此,移植的间充质干细胞在缺血微环境中的存活率限制了干细胞的治疗效果,近年来间充质干细胞到达心肌缺血部位后释放到大量具有心肌保护效应的外泌体备受关注[3]。
外泌体是一种纳米级的小囊泡,其能携带大量生物学信号并参与细胞间的生物信息交流,外泌体从细胞内释放到胞外的过程主要由一些小G蛋白协助完成,其中Rab27a是调节外泌体释放的重要因子之一,其主要功能是将多囊泡体运载至细胞膜相应部位,使得多囊体与细胞膜融合而释放外泌体[4]。移植的间充质干细胞在心梗部位释放大量的外泌体从而发挥心肌保护效应[5],但目前对于外泌体缺失对间充质干细胞生物学特性的影响尚未有详细的报道。因此本文通过敲除Rab27a来抑制骨髓间充质干细胞(bone marrow mesenchymal stem cells, BM-MSCs)外泌体的释放,随后对抑制外泌体释放的间充质干细胞的增殖能力及缺氧耐受能力做初步的研究。
材 料 和 方 法
1 动物
SPF级C57BL/6J小鼠,雌雄不限,6~8周龄,18~20 g,由广东省实验动物中心提供,许可证号为SCXK(粤)2013-0002。BM-MSCs由小鼠股骨及胫骨中分离提取。
2 主要试剂
IMEM液体培养基和胎牛血清购自Gibco;外泌体提取试剂盒购自Invitrogen;EdU试剂盒(Cell-LightTMEdU Apollo 567 In Vitro Kit)购自广州锐博生物科技有限公司;MTS购自Promega;抗Rab27a抗体(SC-22756)购自Santa Cruz;抗增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体(CST 2586S)及抗GADPH抗体(CST 2118L)购自CST;抗CD63抗体(ab8219)购自Abcam;其它生化试剂均为进口分装或国产分析纯。所用引物由上海吉凯基因技术有限公司根据设计合成。
3 主要方法
3.1TALEN技术构建Rab27a基因敲除模型 根据NCBI上Rab27a基因的序列,利用TALEN(transcription activator-like effector nucleases)在线设计工具(http://zifit.Partners.org/ZiFiT/Choice Menu.aspx)设计基因敲除位点,并构建相关载体,随后将Rab27a的TALEN-L mRNA 和 TALEN-R mRNA 混合在一起后以第2个外显子作为靶点在显微镜下利用显微操作系统注射到C57BL/6J小鼠的受精卵中,随后移植到ICR受体雌鼠体内,具体实验方法参考小鼠胚胎操作实验手册[6]。该过程与赛业(广州)生物科技有限公司共同完成。随后取3周龄小鼠鼠尾用碱裂解法提取基因组 DNA并检测其基因序列(上游测序引物Rab27a-F的序列为5’-ACCAGCTCTAATTCTCGATTCCTGG-3’,下游测序引物Rab27a-R的序列为5’-GGCTTCTCAAGTCCGGTTAATTTGT-3’),按照活性鉴定方法对 F0 代小鼠进行鉴定,以此来挑选敲除Rab27a的纯合子小鼠。
3.2间充质干细胞的分离、培养及鉴定 按照全骨髓法提取间充质干细胞[7]。取敲除Rab27a的纯合子小鼠(knockout, KO)及野生型(wild-type,WT)小鼠两侧股骨及胫骨,去除两端用1 mL注射器冲出骨髓腔内骨髓细胞,随后1 000 r/min离心5 min,弃上清,用PBS洗涤细胞2次,最终用含10% 胎牛血清的IMDM培养基将细胞重悬,并接种到25 cm2培养瓶中,37 ℃、5% CO2培养箱中连续培养。48 h后首次换液,并用PBS清洗2次,同时在显微镜下观察细胞密度及形态。待细胞密度到达80%~90%后按1∶2传代,传至第3代用于后续实验,随后取第3代骨髓间充质干细胞,常规消化、重悬;取流式细胞仪专用试管4个,每管加入100 μL细胞悬液,加入小鼠抗人Sca-1 APC-A、CD34 PE-A、CD44 FITC-A和CD45 PE-Cy7-A荧光单克隆抗体各5 μL,4 ℃孵育15 min,用流式细胞仪进行测定。
3.3外泌体的提取及鉴定 KO-MSCs和WT-MSCs分别用0.25%的胰酶消化后用IMDM完全培养基将细胞重悬至1×1010/L,并接种在6孔板中,培养2 d后,弃培养基换用2 mL去除外泌体的10%胎牛血清的IMDM 培养基在培养箱中培养,48 h后收集上清,细胞用4%多聚甲醛固定15 min后加入1 mL结晶紫染色液, 15 min后在显微镜下拍照并进行细胞计数。将收集的细胞培养基于4 ℃、2 000×g离心30 min以去除细胞及细胞碎片。收集上清液加入1 mL外泌体提取试剂,涡旋混匀后4 ℃孵育过夜,之后于4 ℃、10 000×g离心1 h。弃上清,用100 μL去外泌体的PBS重悬,利用纳米颗粒跟踪分析(nanoparticle tracking analysis, NTA)对外泌体进行计数,同时将20 μL外泌体混匀滴于铜网表面,室温静置1 min,用滤纸吸干液体;滴加适量磷钨酸室温复染5 min,用滤纸从侧面小心吸干复染液后置于电镜下观察外泌体大小和形态;最后通过Western blot检测外泌体标志性蛋白CD63的表达。
3.4MTS实验检测细胞活力 KO-MSCs和WT-MSCs分别用0.25%的胰酶消化后,用IMDM完全培养基将细胞重悬,以1×106cells/L的密度接种至96孔板中,每组设置5个复孔,培养2 d后加入100 μL含不同浓度(0、25、50、100、200和400 μmol/L)H2O2培养基培养箱内继续培养6 h。培养结束后弃上清液加入100 μL含有20 μL MTS的培养基,于培养箱中避光孵育3 h后在酶标仪上测定490 nm时各孔的吸光度(A)值。
3.5TUNEL实验检测细胞凋亡 KO-MSCs及WT-MSCs分别消化后重悬,以1×106cells/L的密度接种至96孔板中,每组设置4个复孔,培养2 d后弃培养基每孔加入含有100 μmol/L H2O2的IMDM培养基,培养箱中孵育6 h,培养结束后弃上清并用PBS清洗2遍,用4%多聚甲醛室温固定25 min,PBS清洗2~3遍后用100 μL 0.5% Triton X-100室温静置5 min,弃通透液加入100 μL平衡缓冲液室温静置5~10 min。弃平衡液后加入50 μL rTdT,37 ℃避光孵育60 min,弃孵育buffer并每孔加入100 μL 2×SSC溶液,室温孵育5 min,弃孵育buffer并用PBS清洗2~3次,随后加入DAPI染液,室温孵育15~20 min,弃染色液用PBS清洗2~3遍后在倒置荧光显微镜观察拍照。
3.6EdU实验检测细胞增殖 采用上述相同的方法将KO-MSCs和WT-MSCs分别接种在96孔板中,每组设置6个复孔,培养2 d后每孔加入含50 μmol/L EdU培养基共孵育4 h,用PBS清洗细胞2次后,用4%多聚甲醛固定细胞30 min。弃固定液PBS清洗细胞2次,加入100 μL 2 g/L的甘氨酸中和残留多聚甲醛,弃甘氨酸后PBS清洗细胞2次,每孔加入100 μL 0.5% Triton X-100(PBS配制)孵育10 min,PBS清洗细胞2次后加入Apollo染色液避光室温孵育30 min,弃染色液后加入0.5% Triton X-100清洗2~3次,加入无水甲醇清洗2次以此来降低染料背景,PBS清洗细胞2次后每孔加入100 μL 1×Hoechst 33342工作液室温避光孵育30 min,PBS清洗细胞2次后倒置荧光显微镜观察拍照。随后通过Western blot检测MSCs中PCNA的表达量。
4 统计学处理
采用SPSS 19.0软件进行统计分析,所用正态分布统计数据采用均数±标准误(mean±SEM)表示。两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
结 果
1 Rab27a基因敲除小鼠的建立
本研究利用TALEN技术在小鼠Rab27a基因中第2个外显子上敲除7个碱基。Rab27a在细胞内囊泡的运输起着重要的作用,Rab27a基因敲除小鼠由于毛囊根部的黑色素小体释放障碍而导致其毛发呈现灰白色,见图 1A;随后经过基因测序可以看到相对于野生型小鼠,Rab27a基因敲除小鼠存在7个碱基的缺失,见图1B;同时Rab27a蛋白表达也明显降低,见图1C,说明利用TELEN技术成功构建Rab27a基因敲除小鼠。
2 小鼠骨髓间充质干细胞的鉴定
骨髓间充质干细胞表面表达特异性抗原Sca-1和CD44,而不表达造血干细胞表面特异性抗原CD34和CD45。流式细胞术结果显示,第3代骨髓间充质干细胞表面标志物Sca-1表达率为95.60%±1.06%,CD44表达率为96.09%±1.79%,呈现强阳性;CD34表达率为0.54%±0.16%, CD45表达率为0.55%±0.17%,呈现阴性,见图2。
3 外泌体释放的数量及鉴定
利用结晶紫实验来计数KO-MSCs和WT-MSCs的数量,见图3A;同时利用外泌体提取试剂盒提取MSCs释放的外泌体并用NTA计数外泌体的数量,见图3B;以此来计算单个MSCs释放的外泌体的数量,见图3C;利用透射电镜来观察外泌体的形态及大小,见图3D;同时也检测外泌体标志性蛋白CD63的表达[8],见图3E。由上述数据可发现,相比于WT-MSCs,KO-MSCs释放的外泌体明显减少。
4 外泌体释放缺陷引起MSCs增殖能力降低
EdU实验显示在荧光显微镜下增殖期的MSCs发红色荧光,用Image-Pro Plus 6.0计算红色荧光及绿色荧光的数量,并经过SPSS 19.0统计可知,KO- MSCs的增殖能力显著低于WT-MSCs,见图4A。同时用Western blot检测各实验组MSCs中PCNA的表达量,可发现相比于WT-MSCs,KO-MSCs中PCNA的表达明显下调,见图4B。
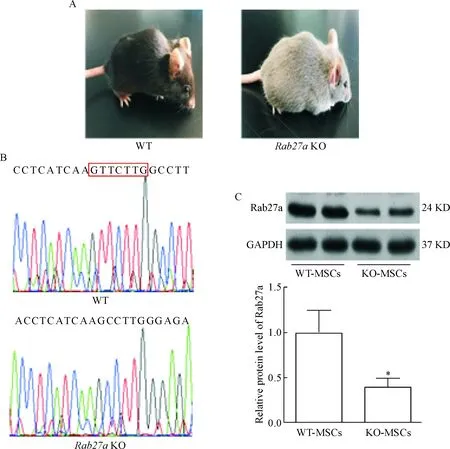
Figure 1.Establishment of Rab27a knockout (KO) mice. A: the representative wild-type (WT) and KO mice; B: validation of Rab27a depletion in BM-MSCs by DNA sequencing; C: the expression of Rab27a was significantly reduced in the BM-MSCs of the KO mice. Mean±SEM. n=3. *P<0.05 vs WT-MSCs.
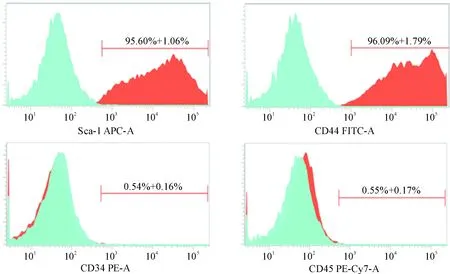
Figure 2.Surface marker determination of bone marrow mesenchymal stem cells. Mean±SEM. n=3.
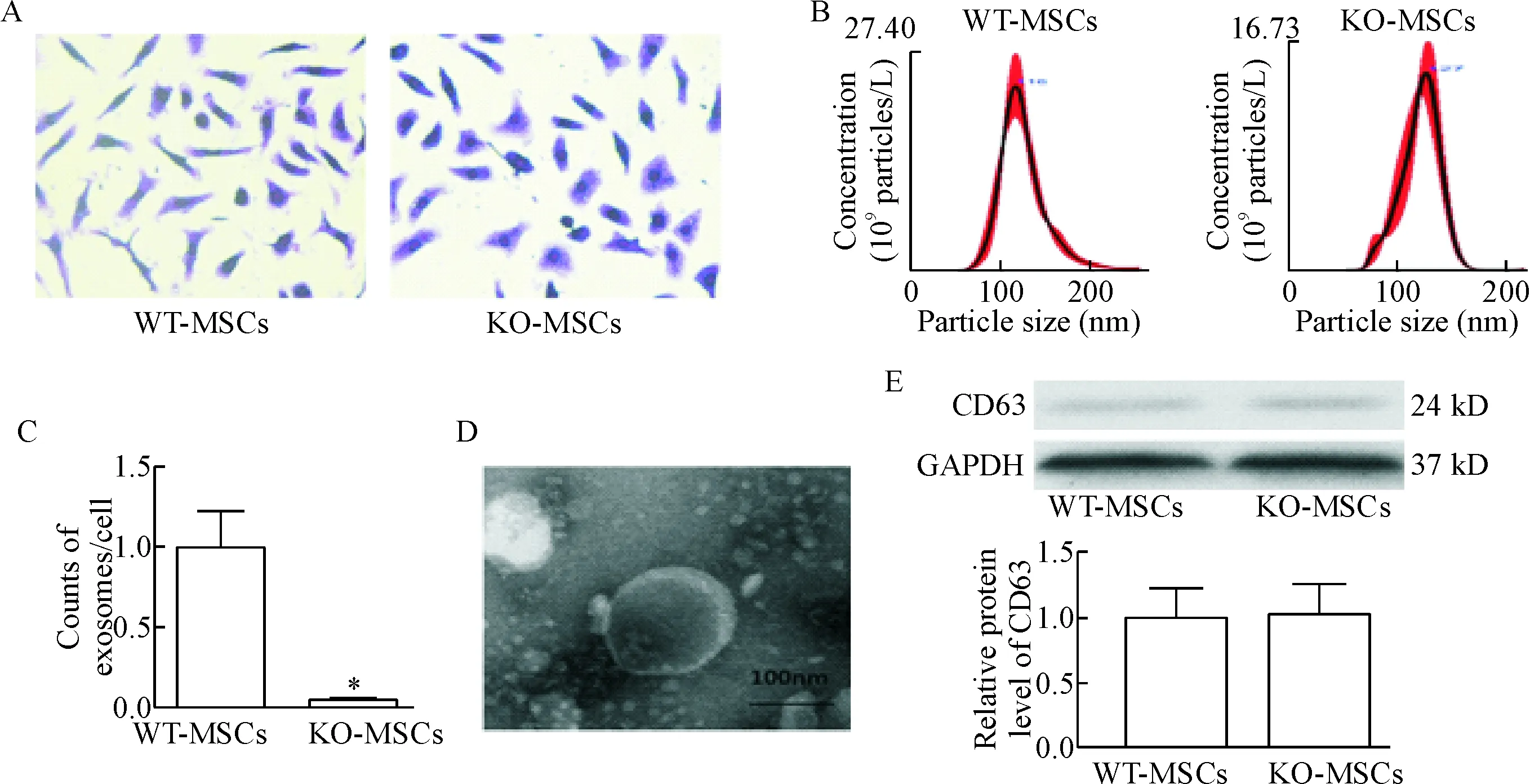
Figure 3.The quantity and identification of the exosomes. A: crystal violet staining of BM-MSCs (×200); B: the exosomes released from WT-MSCs and Rab27a KO-MSCs were quantified by NTA; C: the relative amount of exosomes released from a single MSCs; D: isolated exosomes were confirmed by transmission electron microscopy; E: the protein expression of CD63 was detected by Western blot. Mean±SEM. n=3. *P<0.05 vs WT-MSCs.
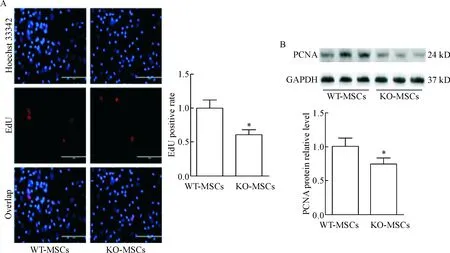
Figure 4.The proliferation ability of KO-MSCs and WT-MSCs. A: EdU assay of BM-MSCs; B: the protein expression of PCNA was determined by Western blot. Mean±SEM. n=3. *P<0.05 vs WT-MSCs.
5 外泌体释放缺陷引起MSCs对缺氧的耐受能力降低
利用MTS实验来检测经H2O2处理的间充质干细胞的活力,发现KO-MSCs对缺氧的耐受能力明显低于WT-MSCs,见图5A;同时用TUNEL实验也发现KO-MSCs对缺氧的耐受能力明显降低,见图5B。
讨 论
间充质干细胞分泌的外泌体用于心肌梗死的治疗在近来的研究中备受关注,间充质干细胞来源的外泌体因携带有其宿主细胞的生物学信息而在心肌梗死中发挥心肌保护作用,所以干细胞分泌的外泌体将作为以后治疗心肌梗死的一种重要的工具[9],然而移植的间充质干细胞趋化至心肌梗死部位的存活率限制了干细胞的治疗效果,所以趋化至心肌梗死部位的间充质干细胞对缺氧的耐受能力及增殖能力尤为重要。当前研究却很少关注外泌体的释放对间充质干细胞本身发挥生物学效应的影响,本文就简约地阐述抑制间充质干细胞释放外泌体可导致间充质干细胞增殖能力及对缺氧的耐受能力降低。
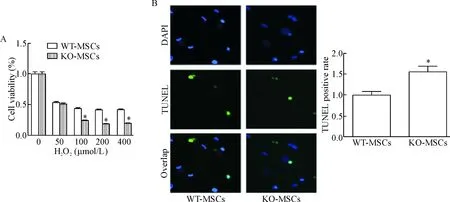
Figure 5.Defects in exosome release resulted in reduction of hypoxia tolerance. A: compare with WT-MSCs, the viability of KO-MSCs was significantly decreased after H2O2 treatment; B: TUNEL staining was used to assess the level of apoptosis (blue: DAPI; green: TUNEL; ×40). Mean±SEM. n=3. *P<0.05 vs WT-MSCs.
细胞通过内吞作用在胞内形成多囊泡体,在外界刺激时,Rab27a引导多囊泡体靶向移动至胞膜脂质筏,并与多囊泡体的效应蛋白(突触结合蛋白4家族蛋白)结合致使多囊泡体与细胞膜相互融合并向胞外分泌外泌体[10]。本文运用TELAN技术靶向敲除C57BL/6J小鼠Rab27a基因[11],并且从Rab27a基因敲除小鼠的骨髓中提取间充质干细胞,用外泌体试剂盒提取间充质干细胞释放的外泌体,同时用NTA检测外泌体的数量,实验数据显示Rab27a敲除的间充质干细胞分泌外泌体的量明显减少。随后我们探索抑制外泌体的释放是否对间充质干细胞生物学特性产生影响。通过EdU实验来检测间充质干细胞的增殖能力,我们实验发现相对于WT-MSCs的增殖能力,KO-MSCs的增殖能力明显降低。众所周知,间充质干细胞具有增殖及分化潜能并在一定条件下可以分化成多种功能细胞,以此在治疗心肌梗死方面提供更为广阔的应用前景。抑制间充质干细胞外泌体的释放而引起间充质干细胞的增殖能力降低最终导致MSCs到达心肌缺血部位后发挥心肌保护效应的能力明显降低。随后我们还发现抑制间充质干细胞外泌体的释放导致其缺氧耐受能力明显下降。有研究表明体外移植的间充质干细胞趋化至心肌梗死部位后在缺氧的环境下存活率低,同时受损的心肌细胞分泌的外泌体可促进MSCs的凋亡,以此限制MSCs治疗疗效。目前尚不清楚抑制MSCs分泌外泌体后是否对其本身的缺氧耐受能力产生影响。通过我们的实验发现,KO-MSCs的缺氧耐受能力明显低于WT-MSCs。外泌体在最早发现时认为是转运细胞废物的囊泡,在随后的研究发现外泌体还可以携带宿主细胞的生物学信号[10]。近期有研究表明外泌体可以将受损的DNA转运出细胞,但是当抑制外泌体的分泌而导致受损的DNA 在细胞内大量堆积可引起机体的内源免疫反应,并激活了活性氧依赖的DNA损伤,这样导致细胞周期阻滞甚至引起细胞凋亡[12];我们前期实验发现细胞分泌的外泌体减少,可导致细胞之间的信息交流减少,最终影响细胞的增殖和自噬。总的来说,细胞释放外泌体减少,导致细胞的内外环境紊乱,进而影响细胞的生理功能。
综上所述,本研究采用TALEN技术,建立Rab27a敲除的细胞模型,从而抑制间充质干细胞外泌体的释放,导致其增殖能力及缺氧耐受能力明显降低。

