亮蓝G减轻急性CO中毒大鼠海马的损伤*
杨坤丽, 沈 慧, 李 璐, 张利彬, 李秀娟, 魏林郁, 黄亚迪, 赵红岗, 江林华, 李东亮△
(新乡医学院 1三全学院生理学教研室, 2生理与神经生物学教研室, 3第三附属医院, 河南 新乡 453003)
一氧化碳(carbon monoxide,CO)是造成中毒性死亡最常见的有毒气体,可引起机体多个系统的损伤,其中,缺氧引起的脑损伤是造成患者死亡的主要原因[1-2]。急性一氧化碳中毒(acute carbon monoxide poisoning,ACMP)后数小时会引起神经系统出现炎症反应和脑组织水肿等一系列病理变化,最终导致神经元的凋亡或坏死,其中海马神经细胞的损伤尤为严重,从而引起学习和记忆能力受损[3-5]。目前普遍认为炎症在CO中毒脑损伤中起着重要作用,抑制炎症可以促进CO中毒患者神经功能的恢复,提高学习记忆能力,降低死亡率,但其病理机制和分子靶标仍然不十分清晰[6-7]。
嘌呤能P2X7受体(purinergic P2X7receptor,P2X7R)是三磷酸腺苷门控阳离子通道,属于嘌呤受体P2X家族的一个亚型。P2X7R在病理情况下被过度激活后会引起白细胞介素1β(interleukin-1β,IL-1β)等促炎因子的释放,引发系列级联反应,造成细胞不可逆的损伤[8]。近几年研究表明P2X7R在许多神经性疾病的炎症发生中有重要作用,包括阿尔茨海默病[9]、脊柱损伤[10]和脑缺血[11]等。在许多诱导神经炎症的模型动物,用P2X7R拮抗剂能够减轻炎症反应,起到神经保护作用[8,12],但P2X7R在ACMP脑损伤中的作用至今未见文献报道。
亮蓝G(brilliant blue G,BBG)是P2X7R的特异性拮抗剂,近几年研究已经证明BBG对许多脑部疾病有神经保护作用。BBG的干预可以减轻阿兹海默病[13]、脊柱损伤[10]和脑缺血[11]引起的神经症状和病理结果。然而,BBG对ACMP引起脑损伤的影响尚未见报道。本文观察BBG对ACMP引起的海马损伤的影响,探讨P2X7R在ACMP引起脑损伤中的作用,试图揭示ACMP的嘌呤受体机制。
材 料 和 方 法
1 动物
8~10周龄健康雄性SD大鼠,体重280~355 g, 购自北京维通利华实验动物技术有限公司,所有操作和动物处理严格遵循伦理道德的指导原则,动物合格证号为SCXK(京)2016-0011。
2 主要试剂
99.9% CO气体(新乡市北普特殊气体有限公司); BBG(Sigma);肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IL-1β和IL-6酶联免疫吸附测定试剂盒(武汉博士德生物技术有限公司);TRIzol 试剂和RT-qPCR试剂盒(Invitrogen);HE染色试剂盒(索莱宝科技有限公司)。
3 主要方法
3.1动物分组及模型的制备 80只雄性SD大鼠采取随机抽样法分为4组:对照(control)组:腹腔注射1 mL的生理盐水,30 min后注射100 mL/kg的空气;ACMP组:腹腔注射1 mL的生理盐水,30 min后注射100 mL/kg的CO气体;ACMP+BBG组:腹腔注射BBG(30 mg/kg,溶解于双蒸水中),30 min后注射100 mL/kg 的CO气体;BBG组:腹腔注射BBG(30 mg/kg,溶解于双蒸水中), 30 min 后注射100 mL/kg 空气。分组处理后120 min眼内眦取血测碳氧血红蛋白(carboxyhemoglobin,HbCO)的浓度,ACMP组和ACMP+BBG组大鼠在注射CO后2 h HbCO浓度均达75.00%±0.05%以上,达到重度中毒的程度,且2组HbCO没有差异;control组和BBG组HbCO浓度仅为5.00%±0.60%,表明ACMP大鼠造模成功。染毒6 h后计数各组存活率。
3.2海马组织的提取及保存 第一批动物:染毒6 h后每组存活的动物中各取5只,10%的水合氯醛(4 mL/kg)麻醉,断头取脑,快速分离左右侧海马,左侧立即用干湿称重法测水含量,右侧立即置于-80 ℃保存备用。第二批动物于水迷宫试验结束后,用上述方法分离左右海马,分别放入不同EP管中,立即置于-80 ℃保存,用于ELISA和RT-qPCR实验。
3.3RT-qPCR法检测P2X7R的mRNA表达 取出冷冻的右侧海马组织,冰上溶解,组织总RNA用TRIzol法提取,然后以总RNA为模板反转录为cDNA,步骤如下:取一PCR管,加入含2 μg RNA的溶液,加入1 μL Oligo(dT)18,用无核糖核酸酶的去离子水补足至12 μL,于PCR仪上70 ℃保温5 min,迅速置冰上冷却,依次加入4 μL 5×buffer、 2 μL 10 mmol/L dNTPs、 1 μL RNA inhibitor和1 μL 反转录酶,用枪抽吸混匀,在PCR仪上42 ℃保温60 min,结束后80 ℃保温5 min灭活反转录酶。最后进行PCR定量,配制PCR扩增体系:cDNA 12.5 μL,上、下游引物各2 μL,酶和底物等混合物2.5 μL,加无菌去离子水8 μL。反应条件: 95 ℃预变性10 min; 95 ℃变性10 s, 60 ℃ 退火60 s, 95 ℃延伸15 s,共40个循环。以标准品GAPDH为内参照,建立扩增标准曲线,结果采用2-ΔΔCt(Livak法)法进行分析,引物序列见表1。
3.4ELISA检测海马组织炎症因子的含量 取出冷冻的左侧海马组织快速称重,低温下进行匀浆,4 ℃、12 000 r/min离心15 min,取上清液作为待测样品,-80 ℃保存备用。在各孔中加入标准品或稀释过的待测样品各100 μL,37 ℃反应 90 min。加生物素标记抗体工作液100 μL,37 ℃反应 60 min。缓冲液洗涤 3 次。加100 μL ABC工作液,37 ℃反应 30 min,缓冲液洗涤 5 次。加入TMB 90 μL,37 ℃ 反应 20~25 min。加入100 μL TMB 终止液,立即在450 nm 处测量吸光度(A)值。
3.5干湿称重法检测海马组织的含水量 6 h后每组取5只大鼠,在10%的水合氯醛(4 mL/kg)麻醉下断头取脑,分离左侧海马,立即置于事先称重过的1.5 mL的EP管中封口,用电光分析天平(分度值0.000 1)称湿重,放入电热恒温干燥箱100 ℃烘烤72 h后称干重。测定的含水量公式:含水量(%)=(湿重-干重)/湿重×100%。
3.6Morris 水迷宫实验检测大鼠学习记忆能力
3.6.1定位航行实验 Morris水迷宫内径160 cm,水深22 cm。水池均分为4个象限,分别标记为NW(northwest)、SW(southwest)、SE(southeast)和NE(northeast)。水迷宫平台位于SE象限中间,直径9 cm,平台上面低于水面0.5 cm。池壁周围悬挂蓝色布帘,水池内壁各象限固定不同形状的参照物。实验开始前调整水温至22 ℃。各组大鼠在未作任何处理的情况下先行定位航行训练7天,每天提前 30 min 带入水迷宫实验室以熟悉环境。每日每只大鼠在每个象限训练 1 次,训练时间间隔为25 min。每次训练的最大时长为 60 s, 60 s 内找不到水下平台的,将其引至平台上并停留 30 s,逃避潜伏期记为 60 s,低于 60 s找到平台的则以实际时间记录逃避潜伏期。第8天按分组条件给大鼠相应处理, 6 h后每组取5只大鼠在目标象限对侧(NW象限)进行定位航行试验,记录逃避潜伏期。
3.6.2空间探索实验 第8天进行,移除水下平台,水温保持 22 ℃。将大鼠在NW象限(即目标象限的对侧)放入池中,用摄像记录游泳轨迹,用软件EthoVision XT 8 (Noldus)进行信号的采集与分析。 记录时长300 s,观察在各象限的游泳路径及时长,分析其空间记忆能力。
3.7HE染色 3 d后每组取5只大鼠,10 %的水合氯醛(4 mL/kg)麻醉,仰卧固定, 经左心室灌注生理盐水,看到剪破的右心耳流出清亮液体,然后再灌注4 %的多聚甲醛约250 mL。固定完毕后,迅速断头取脑,将脑组织置于4 %多聚甲醛中4 ℃过夜。多聚甲醛浸置后的脑组织常规脱水、透明、浸蜡、包埋、冠状位切片,每张切片厚约7 μm,每组取3张切片置于载玻片上,进行HE染色,显微镜下观察切片并拍照。
4 统计学处理
结果用SPSS 19.0软件行统计学分析,数据均采用均数±标准差(mean±SD)表示,多组间比较用单因素方差分析(one-way ANOAN),组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 各组P2X7R的mRNA表达
RT-qPCR结果显示,ACMP组海马组织的P2X7R的mRNA表达量比control组明显增高(P<0.05), ACMP+BBG组P2X7R的mRNA表达量比ACMP组明显降低(P<0.05),BBG组与control组比较差异没有统计学显著性,见图1。
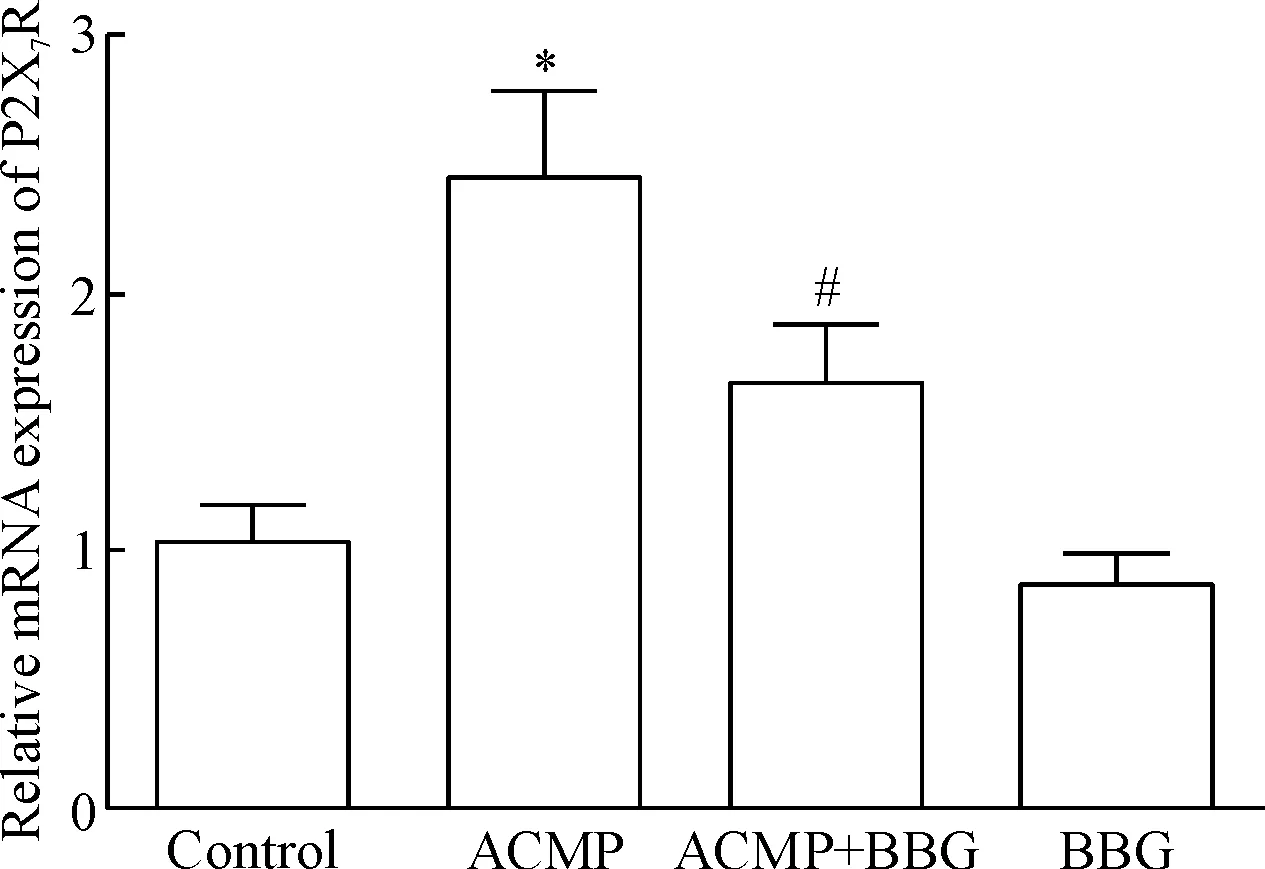
Figure 1.The mRNA expression of P2X7R in the rat hippocampal tissues was measured by RT-qPCR at 6 h after ACMP. Mean±SD. n=5. *P<0.05 vs control group; # P<0.05 vs ACMP group.
2 BBG对ACMP引起的大鼠死亡率的影响
Control组和BBG组存活率都是100%,而ACMP组的存活率为55%,明显低于control组(P<0.05); ACMP+BBG组的存活率为75%,较ACMP组有明显提高(P<0.05)。
3 BBG对ACMP后海马组织促炎因子IL-1β、TNF-α和IL-6含量的影响
与control组和BBG组相比,ACMP组的IL-1β、IL-6和TNF-α的含量明显升高(P<0.05);与ACMP组相比,ACMP+BBG组的IL-1β、TNF-α和IL-6含量显著降低(P<0.05);control组与BBG组相比的炎症因子IL-1β、IL-6和TNF-α含量的差异没有统计学显著性,见图2。
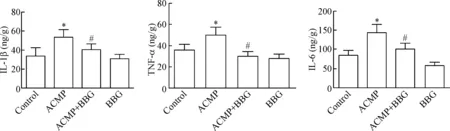
Figure 2.The effect of BBG on the concentrations of IL-1β, TNF-α and IL-6 in the rat hippocampal tissues at 6 h after ACMP. Mean±SD. n=5. * P<0.05 vs control group; # P<0.05 vs ACMP group.
4 BBG对ACMP诱导的海马组织水肿的影响
Control组和BBG组的海马组织含水量分别为79.22%±0.82%和78.97%±0.71%,两者之间的差异无统计学显著性。ACMP组海马组织的含水量为80.72%±0.93%,明显高于control组(P<0.05);而ACMP+BBG组海马组织的含水量为79.56%±0.63%,显著低于ACMP组(P<0.05),见图3。

Figure 3.The effect of BBG on the water content in rat hip-pocampal tissues at 6 h after ACMP. Mean±SD. n=5. * P<0.05 vs control group; # P<0.05 vs ACMP group.
5 BBG对ACMP大鼠学习记忆功能的影响
5.1定位航行训练的结果 定位航行训练7 d,结果显示全部大鼠的逃避潜伏期第1天平均为46.25 s,第7天降至14.02 s,且4组之间的差异均无统计学显著性,见图4A。第8天对各组大鼠进行相应药物处理后发现BBG组与control组相比逃避潜伏期的差异无统计学显著性,ACMP组的逃避潜伏期较control组显著延长(P<0.05),而ACMP+BBG组的逃避潜伏期明显短于ACMP组(P<0.05),见图4B。
5.2空间探索实验结果 BBG组与control组相比,在目标象限探索时间的差异无统计学显著性;与control组相比,ACMP组大鼠在目标象限的探索停留时间显著缩短(P<0.05),轨迹减少;与ACMP组相比,ACMP+BBG组大鼠在SE象限的探索时间明显延长(P<0.05),轨迹增加,见图5。
6 BBG对ACMP大鼠海马组织 CA1区细胞形态的影响
HE染色显示, control组的细胞密集整齐排列,胞体形态规整,胞质丰富,胞核与胞质界限清晰可见;ACMP组海马CA1区细胞数目减少,细胞排列紊乱,细胞形态不完整, 胞质稀少,胞核与胞质界限模糊,细胞核深染、固缩,呈三角形或不规则形;与ACMP组比较,BBG+ACMP组大鼠海马 CA1 区神经细胞核固缩现象明显改善,形态较规则,排列整齐;BBG组与control组无明显差异,见图6。这一结果表明,BBG预处理能够改善急性CO中毒引起的大鼠海马CA1区神经元损伤。适宜浓度的BBG单独处理,对大鼠海马神经元CA1的形态结构无影响。
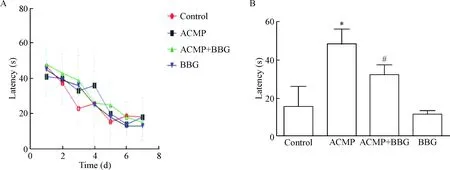
Figure 4.The result of escape latency of the rat in the Morris water maze. A: the mean latency time to find the platform had no significant difference between the 4 groups from the 1st day to the 7th day; B: the effect of BBG on the escape latency at 6 h after ACMP on the 8th day. Mean±SD. n=5. * P<0.05 vs control group; # P<0.05 vs ACMP group.
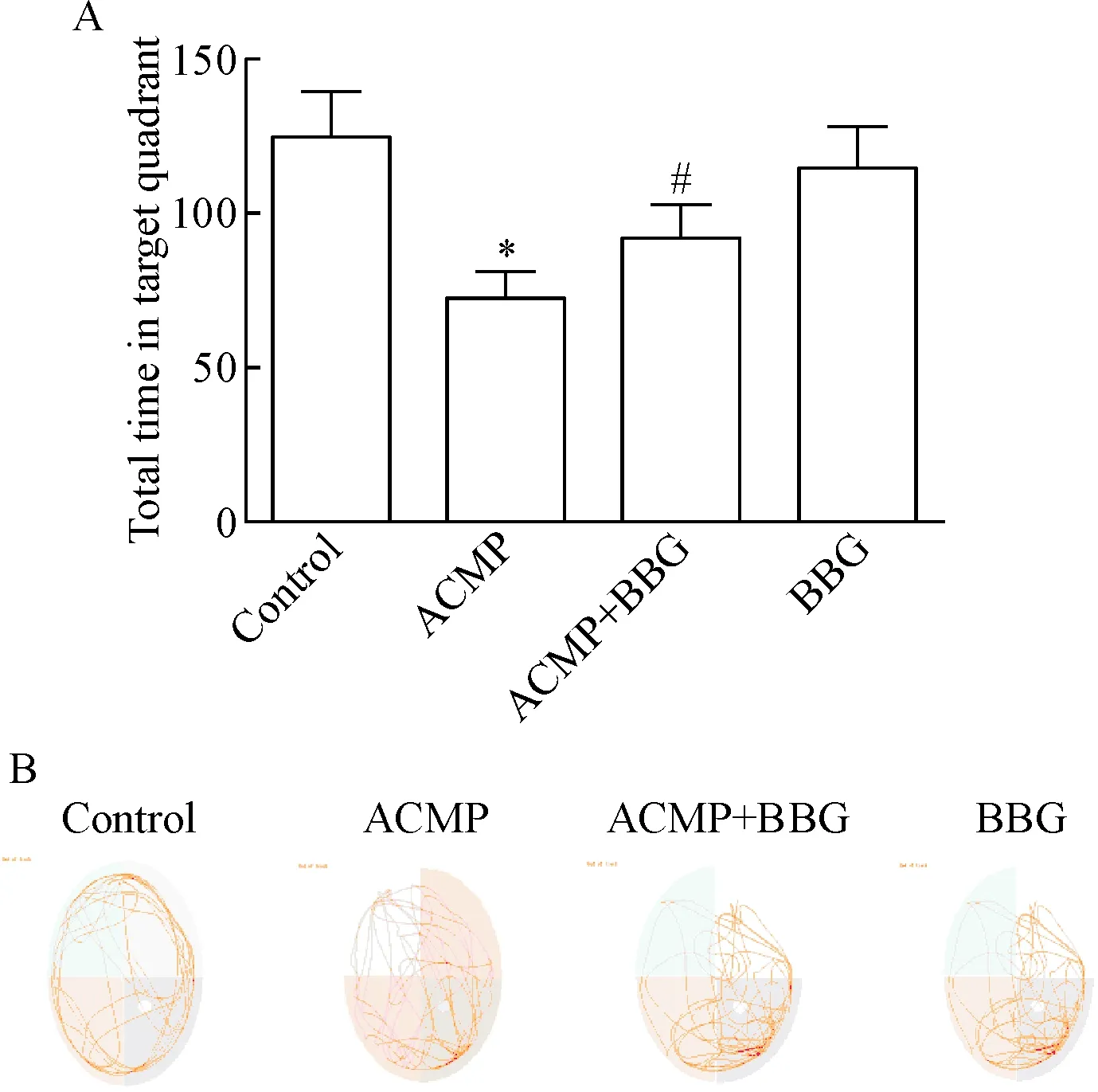
Figure 5.The effect of BBG on the probe trial at 6 h after ACPM on the 8th day. A: the total time in target quadrant (lower right) in spacial probe phase; B: the typical swimming traces of the 4 groups. Mean±SD. n=5. * P<0.05 vs control group; # P<0.05 vs ACMP group.
讨 论
在我国ACMP是急性中毒中最常见的一种,其发病率和死亡率仍然很高。制备ACMP的动物模型对研究ACMP的干预措施有重要意义。传统的吸入法制备一氧化碳中毒的动物模型分为动态和静态吸入法,动态吸入法CO需要量大,消耗成本高,操作要求高,对实验者自身安全也有威胁。静态吸入法虽操作简单,但不能排除CO2蓄积、缺氧等干扰因素。模型制备的种种困难制约了对CO中毒的研究进展[14]。1985年Gutierrez等[15]运用腹腔注射CO气体的方法成功建立了CO中毒动物模型,此方法操作方便,造价低,实验者安全有保障,并且能够达到与吸入法相同的CO中毒程度。近年来,随着对此模型的进一步完善,腹腔注射CO造模的方法得到广泛应用[16],本文观察到腹腔注射CO后 5 min,大鼠出现呼吸急促、烦躁不安等现象,并逐渐加重,30 min左右,大鼠走路不稳、嗜睡、昏睡,2 h 时症状更为严重,血HbCO浓度超过75%,达重度CO中毒程度。本实验又一次证明了腹腔注射CO造模,方法简单,结果可靠,能较好模拟CO中毒的临床表现,又不构成对实验者的威胁。
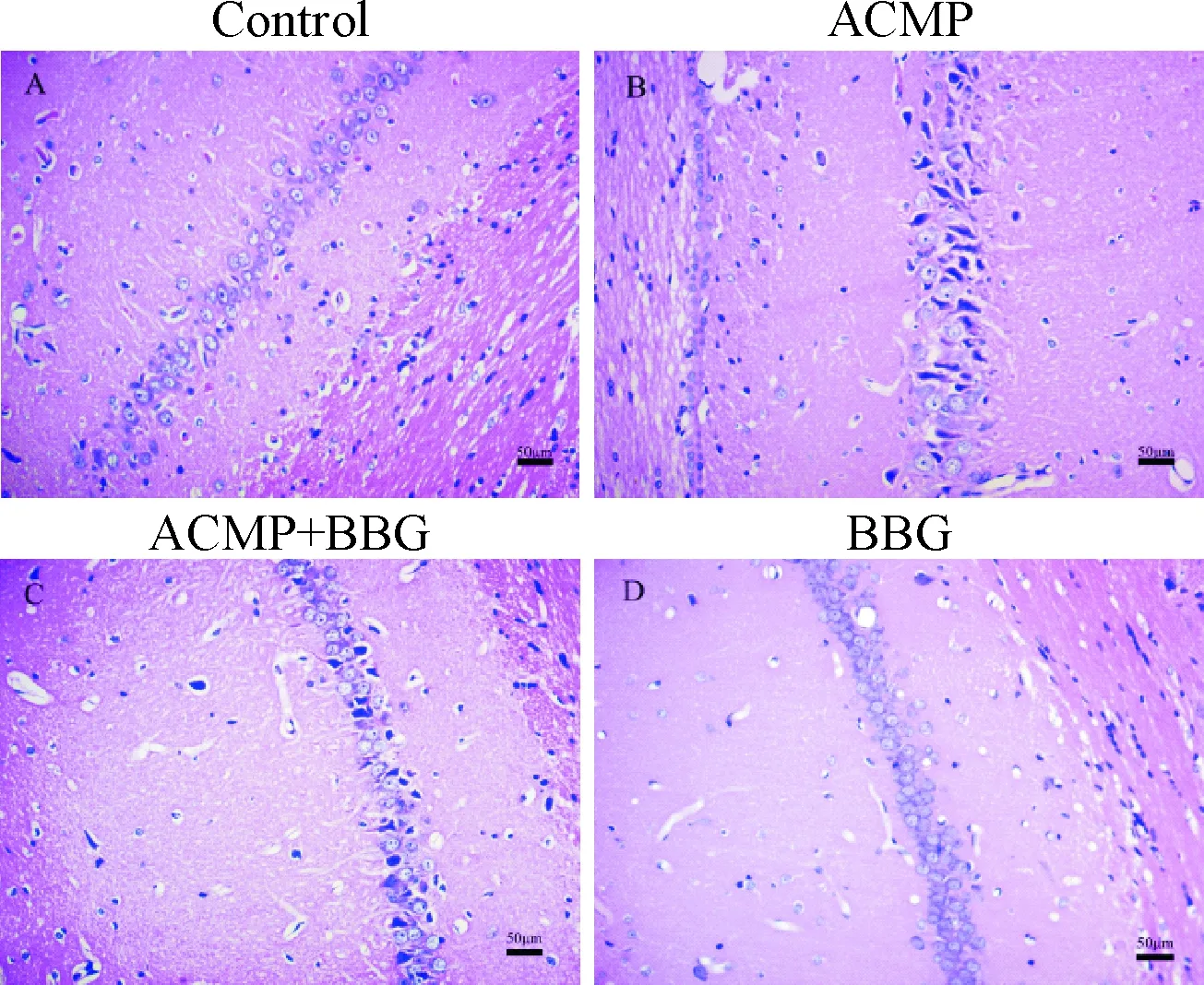
Figure 6.The morphological changes of neural cells in the CA1 region of rat hippocampal tissues were observed by HE staining at 3 d after ACPM (×200).
一氧化碳中毒后缺氧引起的海马损伤对患者生存率和预后都有极大影响,但其损伤的关键环节和受体机制尚不清楚。近几年研究发现中、重度CO中毒患者脑组织存在过度炎症反应,看来炎症可能是CO中毒诱导脑损伤的重要病理进程。文献报道ACMP后数小时IL-1β和TNF-α等炎症因子释放明显增加,6 h达到高峰,炎症反应所致损伤达36 h以上[3-5]。过量的IL-1β和TNF-α可能通过诱发和促进炎症,而后产生免疫损伤、细胞毒性、激活凋亡途径等一系列反应,引起继发性神经元损伤[17]。研究证明ACMP患者血IL-2、4、6水平明显升高,IL-8介导的炎症反应可能也参与ACMP及迟发型脑病(delayed encephalopathy of acute carbon monoxide, DEACMP)的病理损伤过程,ACMP早期阶段中枢神经系统产生IL-6程度与大脑白质脱髓鞘程度有关[18],但是ACMP后炎症因子IL-1β、TNF-α和IL-6含量增多的机制尚不十分清楚。本研究用ELISA法检测海马组织中炎症因子的含量,发现ACMP后6 h,大鼠海马组织中IL-1β、TNF-α和IL-6水平明显增加,这与文献报道相符[19]。我们用BBG预处理,结果这些促炎细胞因子都明显降低了,提示P2X7R在ACMP诱导的促炎细胞因子的大量释放中起着重要作用。
常态下P2X7R只是阳离子通道,参与细胞的正常兴奋功能。但在细胞受到损伤时,P2X7R过度激活,就会通过介导一系列的级联反应,加重细胞损伤。P2X7R与许多神经性疾病的神经炎症发生相关,目前对于P2X7R研究的热点是它能够释放IL-1β和IL-18等炎症因子,血液中IL-1β的释放可以用来作为P2X7R活化的标志。也有报道指出TNF-α、IL-6、CCL2、CCL3 和CXCL2的释放也能反映P2X7R的激活[20-22]。ACMP引起的IL-1β、TNF-α和IL-6释放量增多是否也与P2X7R的激活相关呢?目前未见文献报道,本研究发现ACMP 6 h后P2X7R的mRNA水平明显增高,提示 ACMP可能诱导P2X7R的表达;采用P2X7R的拮抗剂BBG预处理,可明显降低ACMP引起的P2X7R mRNA表达的上调,明显减少了ACMP引起的海马组织中IL-1β、TNF-α和IL-6的释放,并且降低了ACMP大鼠的死亡率,减轻了海马组织水肿和海马CA1区神经细胞损伤。上述结果表明P2X7R在ACMP引起脑损伤中起着重要作用,我们的结果也初步说明ACMP可过度刺激P2X7R,引发促炎细胞因子释放,但ACMP时P2X7R诱导促炎因子释放的胞内信号通路尚需深入研究。大量促炎因子进一步助推炎症和水肿反应,导致大量脑细胞死亡。BBG的使用阻断了P2X7R,也就抑制了ACMP病理进程中炎症这一关键环节,通过抗炎作用改善ACMP引起的海马损伤。
大脑边缘系统中的海马是学习、记忆等高级神经活动的重要部位。当脑组织受到缺氧、 缺血刺激时,IL-1β异常升高,高浓度IL-1β可抑制海马神经元的兴奋性和突触功能从而导致认知功能受损[23]。McAfoose等[24]认为高浓度IL-1β可直接影响长时程增强的发生,引起学习记忆缺陷。本研究发现ACMP 6 h后,促炎症因子IL-1β、TNF-α和IL-6明显增高的同时,大鼠学习记忆能力也显著下降,表明炎症反应增强与学习记忆能力减退密切相关。近年来有研究表明创伤性脑损伤[25]和帕金森病[26]等神经系统疾病引起的学习记忆能力减退与P2X7R的过度激活有关,使用P2X7R抑制剂能够改善这些疾病的学习记忆功能减退。然而P2X7R是否参与了大鼠CO中毒后大脑学习记忆损伤的病理过程,至今未见文献涉及。本文用P2X7R的拮抗剂BBG预处理来研究对ACMP的影响,结果发现ACMP引起的炎症因子IL-1β、TNF-α、IL-6的释放减少了,同时明显改善了ACMP大鼠的学习记忆功能。提示P2X7R在ACMP引起的海马学习记忆功能受损中扮演着重要角色,BBG可能是通过抗炎作用来改善ACMP大鼠海马组织损伤,提高学习记忆能力。本文的这一结果为CO中毒病理机制的研究提供了新思路,为干预CO中毒病理进程提供了新靶点,为开发ACMP脑保护药物提供了的实验依据。ACMP后有10%~30%的病人会发生迟发型脑病,再次出现以急性痴呆为主的神经精神症状[27],病人的认知能力严重受损,严重影响到患者及家庭的生活质量。P2X7R是否在DEACMP中发挥着重要作用、阻断P2X7R是否可以改善DEACMP的学习记忆功能受损,将是我们课题组下一步希望解决的问题。

