RTN1A通过ERK信号诱导肾小管上皮细胞分泌VEGF和IL-8并促进糖尿病肾病肾纤维化*
赵力敏, 杨淑芬, 陈鹏飞, 程文德, 马云晖
(深圳市龙华区中心医院 1全科医学科, 2中心实验室, 广东 深圳 518110; 3新疆维吾尔自治区人民医院肾病科, 新疆 乌鲁木齐 830000)
糖尿病肾病(diabetic nephropathy,DN)是糖尿病(diabetes mellitus,DM)常见的难治性并发症之一,其早期病理通常表现为肾小球肥大,肾小球和肾小管基底膜增厚及系膜区细胞外基质产生增多,慢性发展为肾小球硬化和肾小管间质纤维化,最终导致肾衰竭[1-2]。因此,迫切需要确定DN进展的关键介质,以开发有效延缓或阻断肾小球及其间质纤维化的治疗手段来遏制DN进展。网状蛋白1A(reticulon 1A, RTN1A)由RTN1A基因编码,定位于内质网,能够参与调控细胞的内吞作用、细胞凋亡、内质网应激和DNA损伤诱导的细胞死亡[3-4]。RTN1A在人类和小鼠肾脏疾病模型中均高度表达,并且其高表达可导致肾小管细胞内质网应激反应和肾细胞凋亡[5],而在体外实验中抑制RTN1A表达可减轻肾小管细胞氧化应激和纤维化反应[6],说明RTN1A高表达与DN进展和肾损伤严重程度相关。最近研究表明,在DN中RTN1A能够介导内质网应激诱导足细胞损伤[7]。然而,RTN1A在DN中的作用机制及对DN炎症反应和纤维化影响尚未完全阐明。本研究报道了RTN1A可能通过细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号诱导肾脏分泌炎症因子和肾纤维化,在HK-2细胞中沉默RTN1A能够减少细胞因子分泌及纤维化标志物蛋白表达,表明RTN1A可能是治疗DN的潜在靶标。
材 料 和 方 法
1 材料
C57BL/6雄性小鼠,6周龄,体重20~25 g, 购自上海斯莱克动物公司,合格证号为SCXK(沪) 2007-0005。人肾小管上皮细胞株HK-2购自上海研晶商贸有限公司。链脲佐菌素购自Sigma;Lipofectamine 2000转染试剂购自Invitrogen;RPMI-1640培养基、胎牛血清和Opti-MEM购自Gibco;RTN1A小干扰RNA (RTN1Asmall interfering RNA,RTN1AsiRNA, siRTN1A)和阴性对照scrambled siRNA购自广东锐博生物有限公司;抗RTN1A、ERK、p-ERK、血管内皮生长因子(vascular endothelial growth factor,VEGF)、白细胞介素8(interleukin-8,IL-8)、α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)、纤维连接蛋白(fibronectin,FN)和GAPDH抗体购自Abcam;IL-8及测定IL-8和VEGF的ELISA试剂盒购自R&D Systems;PD98059购自MCE。三诺安稳血糖仪购自长沙三诺生物传感技术股份有限公司。
2 实验方法
2.1DN模型的复制和动物分组 取12只C57BL/6小鼠随机分为模型组(DN组)和正常对照组(control组),每组各6只,禁食12 h后称体重并测量空腹血糖值。DN组小鼠腹腔注射链脲佐菌素, 每只70 mg/kg,每隔1 d注射1次,总共注射3次; control组则注射等体积的柠檬酸钠缓冲液。小鼠置于同一动物房中,给予标准饮食,连续3 d 随机测量血糖,DN组小鼠血糖值均≥16.67 mmol/L则糖尿病造模成功,约需10 d 左右。糖尿病小鼠造模成功后,继续喂养3个月,期间每2周测1次血糖和1次 24 h尿量,每周称1次体重。3个月后DN模型小鼠可用于实验。
2.2标本的收集及指标测定 将造模成功的小鼠进行称重及收集血、尿标本,后解剖收集小鼠肾脏,并称量各个小鼠的肾脏重量。用肾脏重量(kindey weight,KW)除以小鼠体重(body weight,BW)计算小鼠的肾脏指数(KW/BW)。血标本在早上经小鼠尾静脉进行采集,隔夜不禁食(禁食12 h),并用血糖仪测定各组小鼠血糖含量。尿标本在取材前1 d 用小鼠代谢笼进行收集,小鼠在代谢笼中自由饮食饮水,监测24 h尿量。
2.3细胞模型建立 将人肾小管上皮细胞株HK-2用含10%胎牛血清和1%双抗的RPMI-1640培养基,置于37 ℃、5% CO2的恒温培养箱中培养,待细胞生长至约50%融合度时,随机分为3组,每组3个重复,用无血清培养基饥饿处理24 h,后每组分别加入含25 mmol/L右旋葡萄糖、5 mmol/L右旋葡萄糖和5 mmol/L右旋葡萄糖+20 mmol/L左旋葡萄糖(levoglucose,LG)的RPMI-1640培养基继续培养24 h,依次记为高糖(high glucose,HG)组、正常糖(normal glucose,NG)组和NG+LG组。另取适量HK-2细胞分为2组,每组依次加入25 mmol/L右旋葡萄糖+DMSO和25 mmol/L右旋葡萄糖+PD98059(10 μmol/L)处理24 h,分别记为DMSO+HG组和PD98059+HG组,收集各组细胞及其上清液用于Western blot和ELISA检测。
2.4细胞转染 取适量对数生长期的HK-2细胞接种至6孔板中,待细胞贴壁过夜长至60%时,按照Lipofectamine 2000转染试剂操作说明书将scrambled siRNA和siRTN1A转染至HK-2细胞中,转染浓度为50 nmol/L,转染6 h后更换新鲜培养基,并继续培养至24 h,收集细胞进行Western blot检测。
2.5VEGF和IL-6分泌检测 取按方法2.3构建的细胞,用25 mmol/L右旋葡萄糖处理24 h,收集上清液,根据ELISA试剂盒说明书检测各组细胞VEGF和IL-8的分泌量。
2.6Western blot实验 分别取造模后糖尿病肾病小鼠和对照组小鼠肾组织,加入适量含0.25%蔗糖的0.01 mmol/L的磷酸盐缓冲液,于冰上进行组织研磨,后4 ℃、700×g离心30 min,取上清液用NanoDrop分光光度计测定蛋白质浓度。将处理后的HK-2细胞用PBS洗2次,胰酶消化,离心收集细胞,加入含0.25%蔗糖的0.01 mmol/L的磷酸盐缓冲液,冰上裂解后4 ℃、700×g离心30 min,取上清液用NanoDrop分光光度计测定蛋白质浓度。取100~200 μg 蛋白样品,加入10% SDS-PAGE进行分离蛋白,并将分离后的蛋白转移至聚偏二氟乙烯膜上,后用5%脱脂牛奶室温封闭2 h, I抗4 ℃孵育过夜, II抗室温孵育2 h,ECL发光液于凝胶成像系统中进行曝光显影,以GAPDH为内参照, ImageJ软件分析各组蛋白相对表达水平。
3 统计学处理
采用SPSS 22.0进行统计学分析。实验数据用均数±标准差(mean±SD)表示,两组数据的比较采用独立样本t检验,多组间差异的比较采用单因素方差分析,各组均数间的两两比较采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 DN小鼠模型的建立
与control组相比,建立的糖尿病模型小鼠身体消瘦,反应迟钝,精神萎靡,毛发无光泽,尿量与饮水量均明显增加,且其血糖较control组明显升高(P<0.05), 见图1A;肾组织明显变肥大,肾脏指数显著升高(P<0.05), 见图1B;尿微量白蛋白(urine microalbumin, UMA)和肌酐清除率(creatinine clea-rance, CCr)亦明显升高(P<0.05), 见图1C、D。
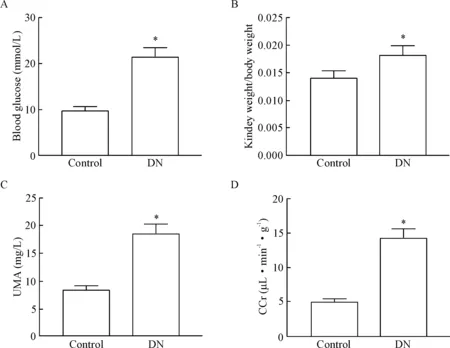
Figure 1.The changes of blood glucose, kidney index, urine microalbumin (UMA) and creatinine clearance (CCr) in the DN mice after 3 months of modeling. A: the changes of blood glucose levels; B: the changes of kidney index; C: the changes of UMA; D: the changes of CCr. Mean±SD. n=6. *P<0.05 vs control group.
2 DN模型小鼠肾组织中RTN1A的表达
从DN模型小鼠肾组织样本中随机选取了3个样本,经Western blot检测发现,与control组相比,DN组RTN1A表达均显著上调(P<0.05),提示RTN1A可能与糖尿病肾病发生有关,见图2。

Figure 2.Western blot analysis of RTN1A protein expression in mouse kidneys. 1, 2 and 3 represent 3 renal tissue samples in each group. Mean±SD. n=3. *P<0.05 vs control group.
3 DN模型小鼠肾脏炎症因子和纤维化标志物的蛋白水平
经Western blot检测发现,与control组相比,DN组RTN1A及其下游蛋白p-ERK的水平明显上调(P<0.05),而总的ERK蛋白水平无明显变化;同时细胞因子VEGF和IL-8以及纤维化标志物α-SMA和FN的水平亦显著上调(P<0.05),提示DN小鼠模型中发生了肾脏损伤炎症反应和纤维化,RTN1A可能与此有关,见图3、表1。
4 RTN1A、细胞因子及纤维化标志物在高糖培养条件下HK-2细胞中蛋白水平的变化
Western blot结果显示,高糖培养条件下的HK-2细胞中RTN1A及其下游蛋白p-ERK的蛋白水平明显上调(P<0.05),而总的ERK蛋白水平无明显变化;同时纤维化标志物α-SMA和FN的蛋白水平显著上调(P<0.05),HK-2细胞炎症细胞因子VEGF和IL-8分泌显著增加(P<0.05),进一步验证了体内实验结果,并且说明细胞模型可模拟DN细胞,见图4、表2。

Figure 3.The images of Western blot for determining the protein levels of ERK signaling proteins, cytokines and fibrosis markers in the mouse kidneys.

表1 小鼠肾脏组织中ERK信号蛋白、细胞因子和纤维化标志物的相对水平
*P<0.05vscontrol group.
5 构建沉默RTN1A的HK-2细胞
Western blot结果显示, blank组、 scrambled组和siRTN1A组的RTN1A表达量分别为0.76±0.07、 0.74±0.08和 0.25±0.03;转染siRTN1A的HK-2细胞较scrambled组细胞中RTN1A表达现显著降低(P<0.05),表明细胞构建成功,见图5。
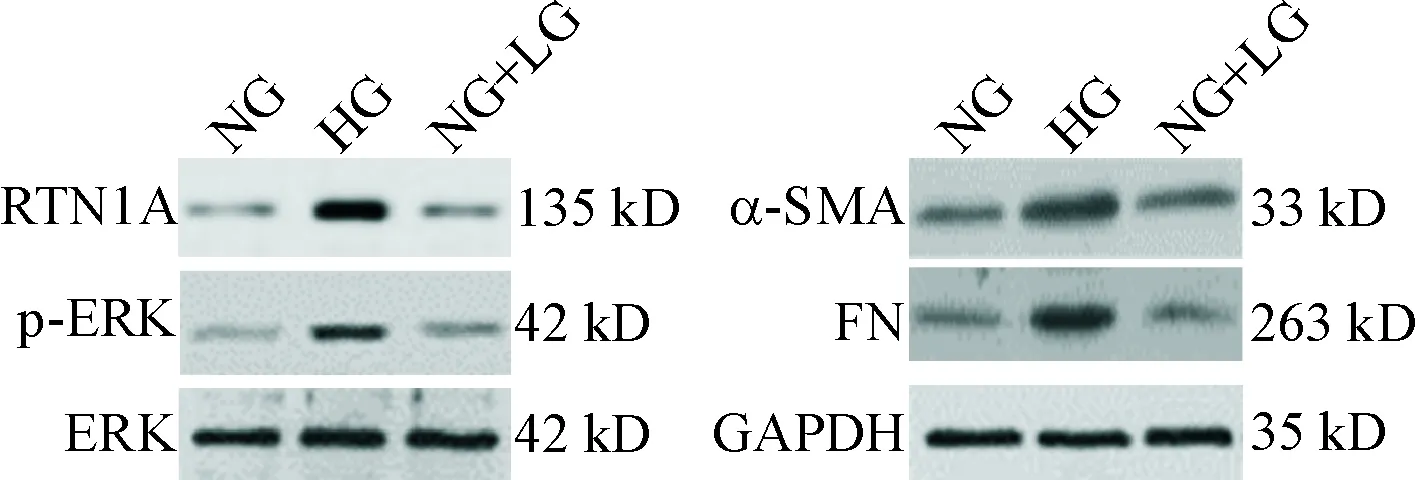
Figure 4.The images of Western blot for determining the protein levels of ERK signaling proteins and fibrosis markers in the HK-2 cells under high glucose (HG) exposure.

表2 高糖培养下HK-2细胞中ERK信号蛋白和纤维化标志物的蛋白水平及细胞因子VEGF和IL-8分泌水平的变化
*P<0.05vsNG group.

Figure 5.The protein expression of RTN1A in the HK-2 cells. Mean±SD. n=3. *P<0.05 vs scrambled group.
6 高糖培养条件下沉默RTN1A和ERK抑制剂处理后HK-2细胞中ERK信号蛋白、细胞因子和纤维化标志物的蛋白水平变化
用高糖培养沉默RTN1A和ERK抑制剂处理后的HK-2细胞,Western blot检测发现RTN1A及下游蛋白p-ERK的水平显著降低(P<0.05),总的ERK蛋白水平无明显变化,同时纤维化标志物α-SMA和FN表达也显著降低(P<0.05); ELISA检测发现,HK-2中细胞因子VEGF和IL-8的分泌水平显著降低(P<0.05),表明沉默RTN1A表达可通过阻断ERK信号抑制肾小管上皮细胞分泌细胞因子并抑制其纤维化,见图6、表3。
讨 论
糖尿病肾病是一种致死性糖尿病并发症,是西方国家终末期肾病(end-stage renal disease, ESRD)的主要原因[8]。根据美国肾脏数据系统报告,约有43.8%的首次诊断为糖尿病的ESRD患者占DN患病率的36.9%[9], DN已成为最具挑战性的健康问题之一。尽管近年来针对糖尿病肾病治疗手段不断进步,但仍有近一半的患者不可避免地进展到肾脏疾病的终末期[10]。肾脏纤维化是绝大多数慢性肾脏疾病的终末期共同通路[11]。研究发现,多种因素如高血压、炎症、高血糖、高血脂及药物损伤均可导致肾脏纤维化[11],但高糖致纤维化的潜在分子机制仍然不清楚,因此,研究肾小管间质纤维化的机制有望为开发有效的DN防治靶点提供依据。

Figure 6.The images of Western blot for determining the protein levels of of ERK signaling proteins and fibrosis markers in the HK-2 cells with RTN1A silencing or ERK inhibitor treatment under high glucose (HG) exposure.
RTN1是内质网相关蛋白,其表达水平与肾损伤的严重程度相关,而RTN1A作为RTN1亚型之一,在人类和小鼠肾脏疾病模型中均高度上调,且其高表达可导致ER应激反应和肾细胞凋亡[5]。有研究发现,通过对来自DN患者的转录测序发现肾小管间质中RTN1A蛋白表达增加,且其高表达与肾功能降低相关[12]。此外,RTN1A在调节肾小管细胞内质网应激中也起关键作用[5],这些数据强烈支持RTN1A在人类DN进展中的作用。最近研究发现,在肾脏损伤中,RTN1A主要在肾小管间隔中发现高表达,包括肾小管和间质细胞,其在肾小管中高表达表明其可能与肾小管细胞损伤有关,而在间质细胞中RTN1A表达增加,提示其可能在肾脏炎症中起作用[5]。DN纤维化的病理特征是肾小球基底膜(glomerular basement membrane,GBM)增厚,细胞外基质(extracellular matrix,ECM)和胶原蛋白、FN、α-SMA等蛋白质积聚[13-16]。本研究通过腹腔注射链脲佐菌素构建了DN小鼠模型,经检测发现RTN1A在DN肾脏组织中高表达,同时检测发现纤维化标志物α-SMA和FN表达均显著增加。成纤维细胞间隔中的纤维化是部分通过激活常驻成纤维细胞而介导的,这些成纤维细胞分泌炎症因子并进一步刺激近端小管上皮分泌介导局部炎症和纤维化的促炎细胞因子,此外,趋化细胞因子由成纤维细胞和上皮细胞分泌,并提供指导单核细胞/巨噬细胞和T细胞向肾小管间质中浸润的方向性梯度[17-19]。炎性浸润产生另外的纤维化和炎症介质,其进一步激活成纤维细胞和上皮细胞因子释放,其中主要会引起VEGF、细胞间黏附分子1(intercellular adhesion molecule,ICAM-1)、IL-6、IL-8和血管紧张素II(angiotensin II,Ang II)表达升高,同时还刺激上皮经历表型转变,其中细胞沉积过量的细胞外基质成分[20-23]。有研究表明,白细胞介素17A可诱导人近曲小管上皮分泌IL-6、IL-8、VEGF、粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)和粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)等细胞因子发挥促炎和促纤维化作用[17]。本研究发现DN小鼠肾脏组织中细胞因子VEGF和IL-8表达显著增加,上述结果提示RTN1A可能与肾脏炎症和纤维化有关。

表3 高糖条件下沉默RTN1A和ERK抑制剂处理后HK-2细胞中ERK信号蛋白、纤维化标记物的蛋白水平及细胞因子VEGF和IL-8的分泌水平的变化
*P<0.05vsscrambled+HG group;#P<0.05vsDMSO+HG group.
为进一步验证动物实验中的发现,本研究利用高糖诱导方法建立了DN细胞模型,经Western blot检测发现HK-2细胞经高糖诱导后RTN1A表达显著增多,同时细胞因子VEGF和IL-8分泌显著增加,纤维化标志物α-SMA和FN表达均亦显著增加,这与体内结果相一致。为证明RTN1A在DN的作用,本研究构建了沉默RTN1A的HK-2细胞,并用高糖进行处理,发现细胞因子VEGF和IL-8分泌以及纤维化标志物α-SMA和FN表达均明显降低。这些数据表明,RTN1A可能对高血糖引起的肾小管炎症损伤及纤维化进展有重要作用。
p38丝裂原激活蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)/ERK作为重要的丝氨酸/苏氨酸蛋白调节激酶,其在糖尿病肾病的发生和发展中也发挥重要作用[24-25]。高糖是引起糖尿病肾病最主要的原因,研究发现在高糖作用下,p38-MAPK/ERK信号通路可被诱导激活[1, 26],而高葡萄糖条件下激活的ERK将诱导肾脏足细胞中VEGF的mRNA和蛋白表达上调,进而高水平的VEGF导致糖尿病大鼠蛋白尿增加,肾小球渗透率增加并变肥大[8]。此外,活化的p38 MAPK/ERK信号能够促进ATF2和MEF2C基因的表达,导致肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、IL-1β以及其它炎症细胞因子如IL-6和IL-8释放显著增加,加速肾小球肾炎的发生,致使更容易发生DN[27-29],表明p38 MAPK/ERK与DN发生密切相关。最近研究发现,RTN1A能够通过与p-ERK结合调节介导内质网应激导致肾脏疾病发生[5]。本研究发现,在DN小鼠模型和高糖处理的HK-2细胞中p-ERK均显著高表达,而沉默RTN1A的HK-2细胞经高糖处理后,p-ERK较对照组显著降低,结果表明RTN1A可能通过调控p-ERK发挥作用。综上所述,本研究证实了RTN1A可能通过ERK信号诱导肾脏分泌炎症因子和纤维化。RTN1A可能是诊治DN疾病的潜在靶标。

