FBXW7在糖尿病心肌病中的表达*
申屠路媚, 卢 敏, 王 燕, 牟艳玲△
(1济南大学-山东省医学科学院医学与生命科学学院, 山东 济南 250200; 2山东省医学科学院药物研究所, 国家卫生部生物技术药物重点实验室, 山东省罕少见病重点实验室, 山东 济南 250062)
随着人们生活水平的提高以及肥胖发生率的增加,糖尿病(diabetes mellitus,DM)的发病率和死亡率呈逐年上升趋势,心血管并发症是DM患者死亡的主要原因,其中,糖尿病心肌病(diabetic cardiomyopathy,DCM)是DM心血管并发症中一种独立、特异的心肌病,与糖尿病患者发生心力衰竭和死亡率升高密切相关[1]。
含F框/WD重复域蛋白7(F-box/WD repeat-containing protein 7,FBXW7)是F-box蛋白家族成员,为 Skp-Cullin-F-box(SCF)E3泛素连接酶体系的靶蛋白识别组分[2]。FBXW7作为一种肿瘤抑制基因,可通过介导泛素蛋白酶体途径降解多种癌蛋白,如cyclin E、c-Myc、mTOR、Notch1和低氧诱导因子1α(hypoxia-inducible factor-1α, HIF-1α)等,在细胞周期进程、细胞生长、分化、凋亡、肿瘤转移及肿瘤抗药性等多个方面发挥重要的调控作用[3-5]。研究表明,mTOR[6]、Notch[7]及RhoA[8]等均可参与糖尿病心肌病的发生发展。此外还有研究[9-11]发现,FBXW7通过调节内皮细胞迁移,促进血管生成,在一定程度上起到减轻冠心病的作用,但FBXW7对DCM发生发展的作用尚未见报道。本文通过Western blot和免疫组化方法检测FBXW7在DCM中的表达情况,初步探讨FBXW7在DCM发生发展过程中的表达变化,为糖尿病心肌病的防治寻找新的靶点。
材 料 和 方 法
1 实验动物
健康雄性 SD大鼠72只,SPF级,体重 180~200 g,购自济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)2014-0007。
2 材料与试剂
链脲佐菌素和戊巴比妥钠(Sigma);血糖试纸(强生中国医疗器材有限公司);SABC免疫组化染色试剂盒(SA1020,武汉博士德生物技术有限公司);浓缩型 DAB试剂盒和II抗辣根酶标记山羊抗兔抗体均购自北京中杉金桥生物技术有限公司;Western blot 细胞裂解液、Western blot实验用的I 抗、II抗稀释液、Western blot转膜液、BCA 蛋白浓度测定试剂盒(增强型)、SDS-PAGE凝胶配制试剂盒和SDS-PAGE电泳液均购自碧云天生物技术研究所;Pro-Sieve Color protein markers (Lonza);PVDF膜(0.45 μm,SERVA);ECL化学发光试剂(Millipore);抗FBXW7抗体(Abcam);抗β-actin抗体(Cell Signaling Technology)。
3 仪器
DYY-6C型电泳仪(北京六一仪器厂);Wallac 1420 型多标记酶标仪(Perkin Elmer);RM2235型石蜡包埋机和EG1150型切片机(Leica);J-25 型高速冷冻离心机(Beckman);LAS4000 型化学发光成像仪(Fujifilm);Eclipse TE2000-S 型免疫荧光显微镜(Nikon)。
4 方法
4.1糖尿病大鼠模型的建立 健康雄性 SD大鼠适应性喂养1周后,按体重均衡的原则随机分为非糖尿病组(non-diabetic,ND组)30只和糖尿病模型组(DM组)42只。造模前禁食16 h,DM组大鼠一次性腹腔注射1% 链脲佐菌素(60 mg/kg, 用pH4.4柠檬酸-柠檬酸三钠缓冲液于4 ℃配制,现配现用),ND组正常大鼠注射同体积柠檬酸-柠檬酸三钠缓冲液。72 h 后尾静脉采血检测空腹血糖 (fasting blood glucose,FBG),以FBG≥16.7 mmol/L为DM模型成功,本次造模成功38只。再将ND组正常大鼠随机分为4、8 和 12 周空白对照组,每组10只;DM组造模成功大鼠随机分为4、8和12周模型组(4W-DM、 8W-DM和12W-DM组),每组分别为12只、13只和13只。
4.2标本收集 大鼠麻醉,开胸,迅速取出心脏,用预冷生理盐水洗净,剔除血管和脂肪等非心肌组织,滤纸吸干水分后称心脏重量和左心室(含室间隔)重量,并计算心脏(左心室)指数=心脏(左心室)重量(mg)/体重(g)。分离的左心室再分为2部分:一部分用福尔马林固定,经脱水、透明、包埋,制成心肌组织石蜡块;另一部分置于EP管,于液氮中保存待用。
4.3HE染色 取石蜡切片常规脱蜡至水,苏木精染色10 min,流水稍洗,体积分数为0.01的盐酸乙醇分化,流水冲洗数分钟,伊红染色5 min,流水稍洗,梯度乙醇常规脱水,中性树胶封片,于显微镜下观察心肌组织病理结构的改变。
4.4Western blot实验 每20 mg心肌组织中加入100~200 μL含1 mmol/L PMSF的裂解液,制备组织匀浆,4 ℃、14 000 r/min离心10 min,取匀浆上清,BCA 法测定总蛋白浓度。每孔40~60 μg 总蛋白上样量以浓度为8%的凝胶电泳进行分离,冰浴下恒流(300 mA)湿法转膜2 h,质量分数为5% 的脱脂奶粉室温封闭1.5 h后,与相应 I 抗4 ℃共孵育过夜,抗体稀释比例分别为1∶800(FBXW7)和1∶1 000(β-actin);次日TBS-T洗液(pH 7.6)洗涤后,与辣根酶标记的II 抗共孵育3 h,用ECL化学发光试剂进行显色,并利用ImageJ2x灰度分析软件定量分析,以 β-actin 的灰度值标化蛋白表达。
4.5免疫组化染色 取石蜡切片常规脱蜡至水,磷酸盐缓冲液(PBS,pH 7.4)洗涤,浸入体积分数为0.03 的过氧化氢封闭液中,室温封闭30 min,以阻断内源性过氧化物酶。枸橼酸缓冲液(0.01 mol/L,pH 6.0)高压3 min以修复抗原,自然冷却至室温。PBS 洗涤后滴加 I 抗,4 ℃湿盒过夜,抗体稀释比例为FBXW7 (1∶800)。次日切片恢复至室温后,分别滴加 II 抗和辣根酶标记工作液,37 ℃温箱分别孵育 20 min。PBS洗涤后DAB显色,苏木精轻度复染,自来水水洗返蓝,梯度乙醇常规脱水,中性树胶封片,于显微镜下观察结果。每组随机取 10个视野,通过Image-Pro Plus 6.0图像分析系统测定平均积分吸光度。
5 统计学分析
应用SPSS 19.0统计软件进行数据处理,所有数据均以均数±标准差(mean±SD) 表示,各项指标组间差异比较采用单因素方差分析及Boferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 大鼠模型建立情况
实验期间,ND组大鼠一般状态良好、健壮、皮毛有光泽,自主活动正常,对外界反应灵敏,无死亡。与ND组比较,DM组大鼠逐渐出现多饮[(63.6±5.2)vs(282.2±65.5) mL/24 h]、多食[(24.7±1.9)vs(52.1±9.4) g/24 h]、多尿[(3.7±1.3)vs(224.3±42.8) mL/24 h]和消瘦,精神萎靡,皮毛无光泽,腥臊酮臭味加重,且随着时间延长,多饮、多食、多尿和消瘦表现加重,大鼠生存状态越来越差,造模成功38只,成功率为90%。
2 大鼠体重及心脏各指标的测定结果
在4、 8和12周时,ND组大鼠体重明显增加,FBG正常;与ND组相比,DM组大鼠体重明显降低(P<0.01),FBG明显升高(P<0.01)。此外,DM组大鼠心脏及左心室重量均比ND组明显降低(P<0.01),但心脏指数和左心室指数均显著高于ND组(P<0.01),见表1。
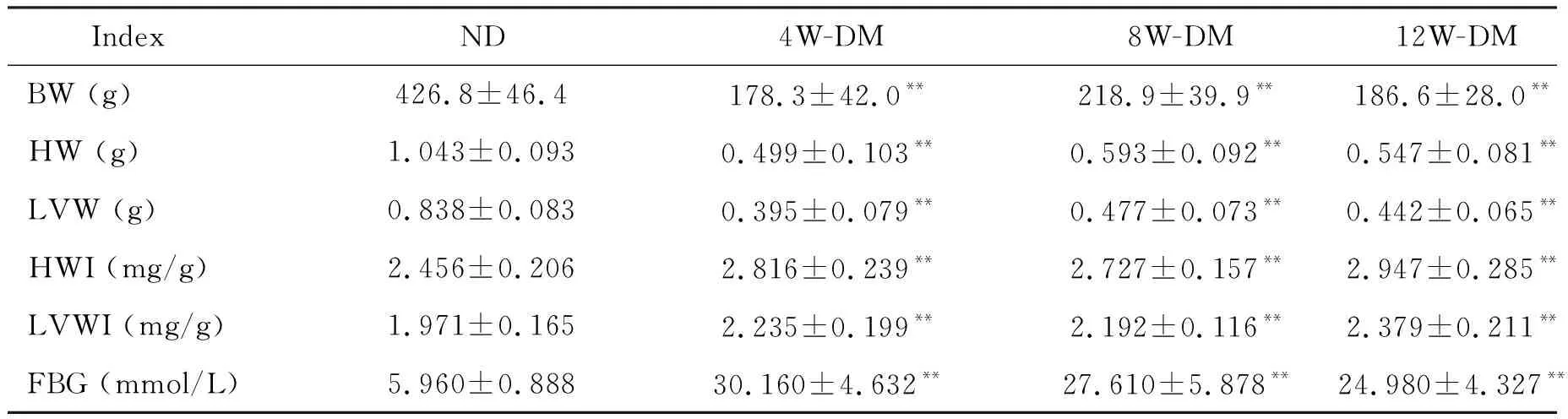
表1 糖尿病大鼠的一般特征
BW: body weight; HW: heart weight; LVW: left ventricular weight; HWI: HW/BW; LVWI: LVW/BW; FBG: fasting blood glucose. These indexes were evaluated and calculated at the end of the protocol time.**P<0.01vsND group.
3 大鼠心肌组织病理观察结果
ND组大鼠心肌纹理清晰,心肌细胞排列整齐,细胞核均匀分布,无变性、坏死等病理结构改变。DM 组大鼠均观察到不同程度的病变,4周DM组心肌细胞胞浆丰富,细胞核形状不规则,排列紊乱,可见个别心肌细胞坏死;8周DM组局部大量心肌细胞坏死,坏死心肌细胞胞浆红染;12周DM组可见心肌细胞肥大且局部不同程度凝固性变性、坏死,胞浆嗜酸性增强,核固缩深染,见图1。
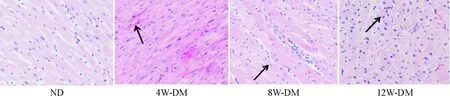
Figure 1.The pathological structural changes of the cardiac myocardium (HE staining, ×200).
4 FBXW7在大鼠心肌中的表达
Western blot 实验结果表明,DM组大鼠相对于ND组心肌组织中FBXW7 的表达显著增加(P<0.01),且8周DM组表达量明显高于4周DM组(P<0.01),维持在较高水平;12周DM组表达显著低于8周DM组(P<0.01),但仍高于ND组(P<0.01),见图2。
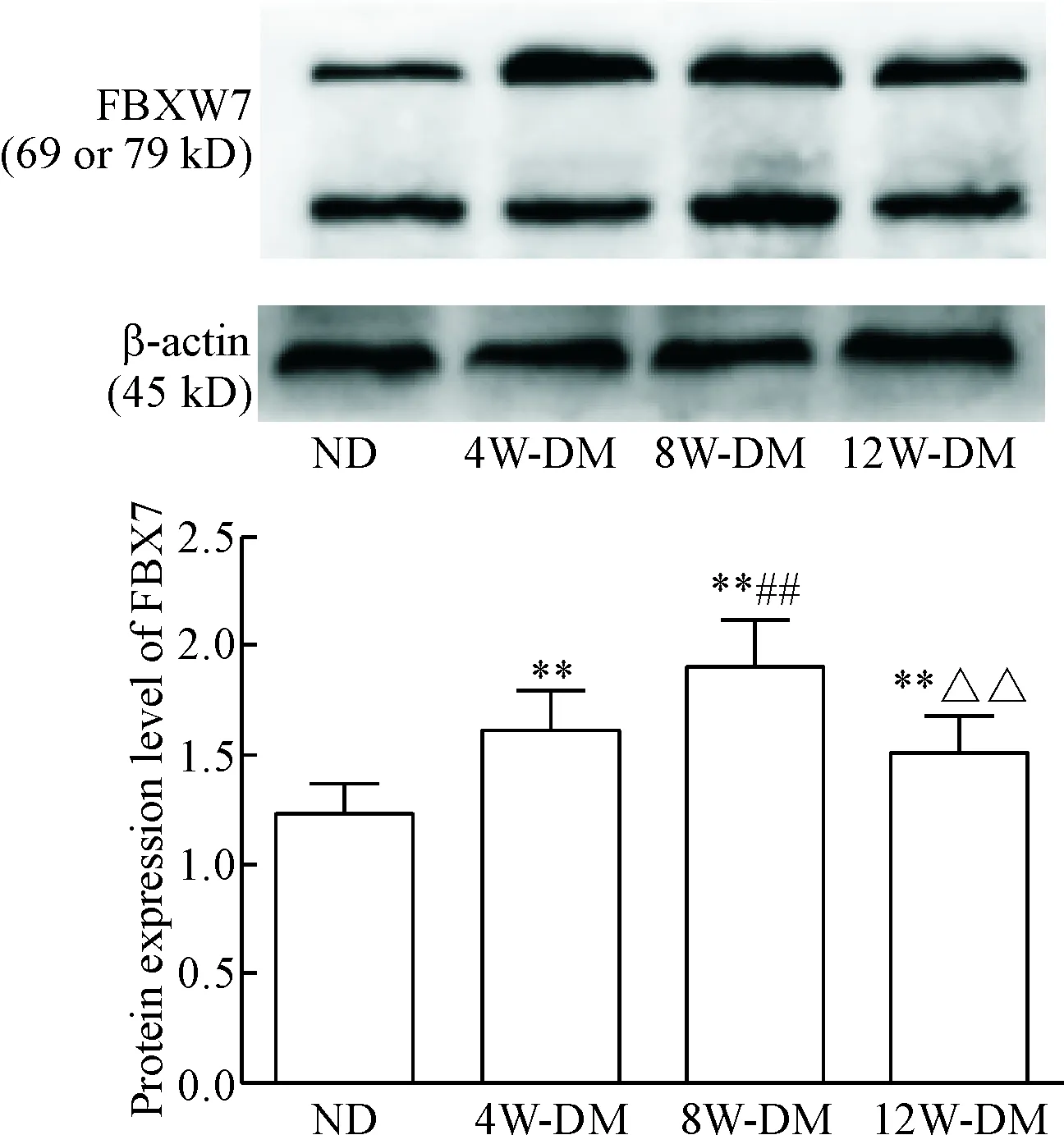
Figure 2. The myocardial expression levels of FBXW7 in diffe-rent groups tested by Western blot. Mean±SD. n=5. **P<0.01 vs ND group; ##P<0.01 vs 4W-DM group; △△P<0.01 vs 8W-DM group.
免疫组化观察结果显示,FBXW7在心肌细胞中主要表达于细胞核,少量在细胞质中表达。FBXW7在各组中的表达量趋势与Western blot 实验结果一致:4周和8周DM组表达量显著高于ND组(P<0.01),且8周DM组表达量高于4周DM组(P<0.05);12周DM组表达量相对于8周DM组显著减少(P<0.01),但仍明显高于ND组(P<0.05),见图3。
讨 论
DCM的始动因素是心肌能量代谢异常,包括糖和乳酸盐代谢减少,脂肪代谢增加,从而导致游离脂肪酸的堆积,在此基础上出现氧化应激、线粒体损伤,进而导致细胞凋亡、炎症反应增加和心肌纤维化等病理改变,同时出现心肌结构和功能的改变[12-13]。本研究中,DM组大鼠FBG明显升高,体重明显低于ND组;4、8和12周DM组大鼠心脏及左心室重量均明显降低,但心脏指数和左心室指数均明显高于ND组,表明DM组大鼠可能出现心肌肥大。随着研究时期的延长,DM组大鼠心肌出现局部变性甚至坏死,表明DM组大鼠心肌出现了不同程度时间依赖性的心肌损伤以及DCM模型的成功。
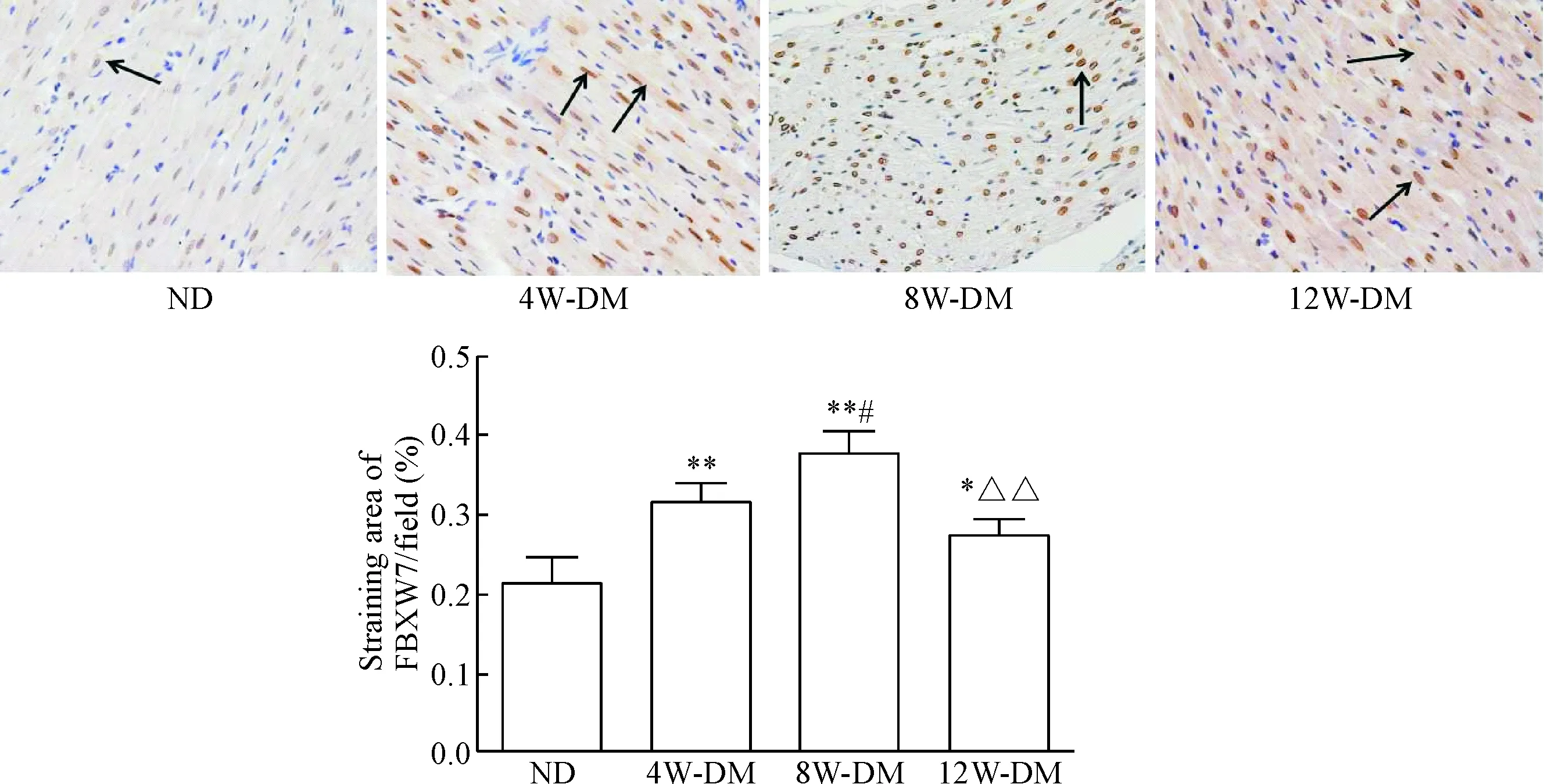
Figure 3.The myocardial expression of FBXW7 in different groups tested by immunohistochemistry (×400). Positive expression was visualized by brown staining. Mean±SD. n=5. *P<0.05, **P<0.01 vs ND group; #P<0.05 vs 4W-DM group; △△ P<0.01 vs 8W-DM group.
FBXW7作为近年来发现的一种重要的抑癌基因,在人体细胞周期的进程、细胞的生长和分化起重要的调节作用,其缺失能引起和加快癌细胞增殖。Matsuoka等[14]发现 FBXW7是造血系统重要的防御因子,其缺失会导致造血系统细胞不成熟和急性淋巴细胞白血病的发生;Yokobori等[15]发现p53控制FBXW7的转录,从而导致FBXW7在胃癌组织中的表达降低,不良预后增加;Iwatsuki等[16]发现大肠癌组织中 FBXW7的表达明显低于相应正常组织,FBXW7表达低提示预后不良。越来越多的研究显示,FBXW7可通过参与各种信号通路对恶性肿瘤的发生发展起调控作用。Li 等[17]运用Pearson相关系数分析表明FBXW7在胃癌组织中的表达与RhoA蛋白表达呈负相关关系,且FBXW7 通过调控泛素蛋白酶体的降解来调节RhoA水平,说明胃癌中 FBXW7 通过 RhoA信号通路来调节肿瘤细胞凋亡、生长停滞和上皮间质转化。有研究[18]发现Polo样激酶2(Plk2)通过靶向结直肠癌中的FBXW7/细胞周期蛋白E途径来调节肿瘤生长和凋亡,通过恢复FBXW7表达和细胞周期蛋白E的消耗,Plk2的促肿瘤活性可以被反转。涂康生等[19]证实FBXW7是一个肝细胞癌的抑癌基因,且其通过泛素化蛋白酶解下调YAP蛋白表达来诱导肝癌细胞凋亡和生长停滞,因此FBXW7可以通过Hippo-YAP信号通路发挥抑癌功能。
另有相关研究表明FBXW7与冠心病的发生具有相关性。Onoyama等[20]研究结果显示,FBXW7调节小鼠肝脏脂质代谢和脂肪细胞分化;还有研究[21]发现,FBXW7通过针对性降解C/EBPα,从而控制脂肪细胞分化。因此,FBXW7可能是一个重要的调节能量和脂质代谢的蛋白,提示FBXW7可能与冠心病有关。FBXW7还能通过调节内皮细胞迁移,促进血管生成,可以在一定程度上起到减轻冠心病的作用[9-11]。我们通过Western blot和免疫组化实验检测了FBXW7在DCM中的表达情况,研究结果显示FBXW7在大鼠心肌中主要表达于细胞核,少量在细胞质中表达;各糖尿病模型组大鼠相对于正常对照组心肌组织中FBXW7 的表达量显著增加,且8周 DM组表达量明显高于4周 DM组,维持在较高水平,12周DM组表达增加量减少,明显低于8周DM组。FBXW7在4周、8周和12周DM组大鼠心肌组织中的表达变化趋势,我们猜测可能是由机体代偿反应引起的,但是,FBXW7在糖尿病心肌病发生发展过程中的具体作用还需进一步研究。
糖尿病心肌病是糖尿病性心脏病的特异性病变,是糖尿病心血管严重并发症的重要组成部分。本实验揭示了FBXW7在糖尿病心肌病中有表达且随病程延长其表达呈一定变化趋势, 下一步我们将深入研究其在糖尿病心肌病中的作用并阐明其机制,以期为糖尿病心肌病的治疗提供新的理论依据。

