梅花鹿BST-2真核表达质粒的构建和表达
边 帅,赵 月,白雪媛,王思明,赵大庆,王佳雯
(长春中医药大学 吉林省人参科学研究院,吉林 长春 130117)
BST-2是一个干扰素诱导蛋白,在受感染细胞中能够抑制病毒粒子的释放[1]。其抗病毒谱非常广泛,包括逆转录病毒、丝状病毒、弹状病毒、甲病毒、黄病毒、HBV以及甲型流感病毒[2-12]。同时,BST-2在病毒敏感性以及胞内信号传导方面也起到了重要的作用[13]。此外,多种病毒蛋白能够拮抗BST-2的抗病毒功能,例如HIV-1 Vpu蛋白,SIV Nef蛋白,甲型流感病毒M2蛋白等等[2,11,14]。
BST-2是一种II型单次跨膜蛋白,在不同的细胞类型中表达不同[1]。其抗病毒功能是基于其独特的膜拓扑学结构,包括一个胞外较短的N端,一个胞内段和一个GPI锚定区[15-16]。在N端具有一个进化保守的YxY区域,能够介导NF-κB活性[17]。胞内段存在两个潜在的N连接糖基化位点和3个半胱氨酸位点,在不同物种中高度保守。
近来,BST-2在多种非灵长类动物包括牛、羊、猫中鉴定出来[18-21]。它们都显示出了较强的抗病毒活性。梅花鹿在亚洲尤其中国是一种重要的经济动物,病毒对鹿群的感染会带来严重的经济损失。鹿科动物宿主限制因子的研究目前尚无报道。本研究中通过克隆梅花鹿BST-2基因,构建其真核表达载体并转染表达,为研究BST-2的抗病毒功能以及信号转导功能提供了有力的工具。
1 材料与方法
1.1 材料 E.coli DH5α菌株、表达载体VR1012和293T细胞由本实验室保存。淋巴细胞提取液,TRIZol和双抗,购自Invitrogen公司;反转录试剂盒、PCR相关试剂、pMD-18 T Vector、DNA连接酶、限制性内切酶、胶回收试剂盒及质粒提取试剂盒等,购自TaKaRa公司;转染试剂 Fugene©6,购自 Promega公司;鼠抗Tubulin单克隆抗体和鼠抗HA单克隆抗体,购自Covance公司;Alexa Fluor 488绿色荧光标记二抗,购自Thermo Fisher公司;碱性磷酸酶标记的羊抗小鼠二抗,购自Jackson公司;DAPI,购自Roche公司;DMEM高糖培养基、胰蛋白酶、胎牛血清购自Gibco公司;细胞爬片、6孔板,购自Nest公司;其他生化试剂均为国产分析纯或进口分装试剂。PCR引物由长春华大中天生物技术有限公司合成。
1.2 方法
1.2.1 细胞培养和转染 293T细胞在含有10%胎牛血清的DMEM中培养,培养条件为37℃,5%CO2浓度。将处于对数生长期的293T细胞使用胰酶消化,离心收集,接种于细胞培养板中。至汇合度达到70%,使用Fugene©6转染试剂将质粒转入293T细胞。
1.2.2 RNA提取及基因扩增 使用淋巴细胞提取液分离鹿血中的淋巴细胞,TRIZol法提取总RNA,使用琼脂糖凝胶电泳检测RNA提取情况,Nano测定RNA浓度。以转录组测序得到的序列设计引物,进行PCR扩增,片段进行胶回收并连入pMD-18 T亚克隆载体。转化大肠杆菌DH5α,挑单克隆,过夜培养后提取质粒,进行双酶切鉴定以及测序鉴定。
1.2.3 生物信息学分析 使用Vector NTI软件分析梅花鹿BST-2蛋白的氨基酸组成,相对分子质量以及等电点等理化性质,以及不同种属间BST-2的同源性。使用在线软件TMHMM 2.0、NetNGlyc、SWISS-MODLE以及SUMOplot分析BST-2蛋白的跨膜区、糖基化位点、二聚位点和泛素化位点。
1.2.4 引入IHA标签构建真核表达载体 取测序正确的pMD18T-BST-2质粒进行Overlap PCR,在第132个氨基酸后引入HA标签,所得产物经胶回收后使用Xba I和BamH I切去保护碱基,酶切产物纯化后使用T4 DNA连接酶与真核表达载体VR1012连接,连接产物转化大肠杆菌DH5α,挑取单克隆,过夜培养后提取质粒,进行双酶切鉴定以及测序鉴定。
1.2.5 点突变PCR 设计不同突变引物,以VR1012-BST-2 IHA为模板,进行PCR反应,所得产物经琼脂糖凝胶电泳鉴定后,使用Dpn I消化,去除模板DNA,转化大肠杆菌DH5α,挑取单克隆,过夜培养后提取质粒,进行双酶切鉴定以及测序鉴定。
1.2.6 免疫印迹 转染48 h后收集细胞,Rippa裂解液裂解细胞,加入上样缓冲液煮沸10 min致蛋白变性,利用SDS聚丙烯酰胺凝胶电泳分离样品。通过半干转仪将凝胶上的蛋白转移至硝酸纤维素膜上。5%脱脂牛奶封闭30 min,一抗孵育过夜,二抗孵育45 min。加入酶联二抗的显色底物,至特异性条带清晰可见,终止显色反应。
1.2.7 免疫荧光 293T细胞铺于6孔细胞培养板中,待细胞汇合度至20% ~50%时使用Fugene©6转染试剂转染相关质粒。24 h后弃去上清,4%多聚甲醛室温固定10 min。弃去固定液,10%FBS封闭10 min。一抗孵育1~2 h。二抗孵育1 h。PBS冲洗3次。加入含有1μg/mL 4′,6-二脒基 -2-苯基吲哚 (DAPI)的PBS,孵育5 min后用PBS冲洗一次。使用荧光显微镜采集荧光图像,分析蛋白的细胞定位情况。
2 结果
2.1 BST-2 cDNA的PCR扩增结果 在梅花鹿转录组数据库中获得预测的梅花鹿BST-2基因序列并设计引物。从梅花鹿PBMC中提取总RNA,Nano测定OD260/280值为1.88,琼脂糖凝胶电泳可见三条条带,分别为28S、18S和5S(图1,第3泳道),说明RNA纯度较高且无降解。使用反转录PCR法获得cDNA,以其为模板,引物如表1所示,进行PCR反应。经琼脂糖凝胶电泳分析,在500 bp左右可见一特异性条带(图1,第2泳道),符合预期大小。

表1 试验用引物
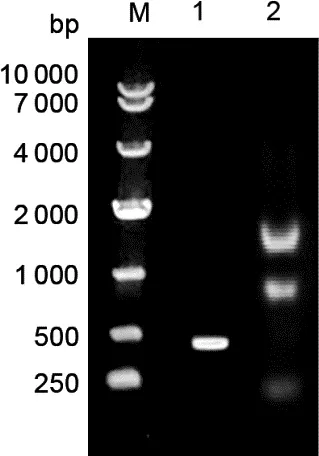
图1 梅花鹿BST-2基因扩增示意图
2.2 真核表达质粒的构建及鉴定结果 回收PCR产物并连接pMD18-T亚克隆载体。重组质粒经Xba I和BamH I双酶切鉴定,在500 bp和2 000~3 000 bp两处可见特异性条带(图2,第2道),说明目的片段插入成功。使用通用引物测序,测序结果与转录组数据库中序列匹配率为100%。使用Overlap PCR引物,分别获得BST-2 N端和C端两个片段,且这两个片段都带有HA序列,回收后的这两个片段利用HA序列为互补区进行Overlap PCR反应,获得具有内部HA(IHA)的BST-2片段(图2,第3道),将这个片段连入真核表达载体VR1012中,进行双酶切鉴定,在5000 bp和500 bp处分别可见特异性条带(图2,第5道),证明构建成功。将质粒进行测序发现,在第132位氨基酸后确实连入了HA标签,证明构建成功。
2.3 梅花鹿BST-2基因及蛋白序列分析 梅花鹿BST-2基因包含480个碱基,编码159个氨基酸。蛋白质理论分子量为17.69 kDa,预测等电点为5.66。对蛋白二级结构进行分析,可知其含有70.44% α-螺旋,9.43% β-片层,1.26%的β-折叠和18.87%的无规卷曲。将梅花鹿BST-2催化域与不同物种的BST-2进行同源性比较,得出蛋白同源性分别为37.8%、30.1%、67.3%、74.2%和53.1%。说明在进化上梅花鹿BST-2与羊的BST-2A较为接近(图3)。使用生物信息学软件对梅花鹿BST-2进行分析,发现其具有两个穿膜区,其中1~14位氨基酸是胞内段,15-37位氨基酸是跨膜区,38~135位氨基酸是胞外段。一个可能的泛素化位点(K96,阈值为0.5),三个保守的半胱氨酸残基(C46,C56,C84),对其二聚结构具有重要作用,两个潜在的N-连接糖基化位点(N85,N137)(见中插彩版图4)。
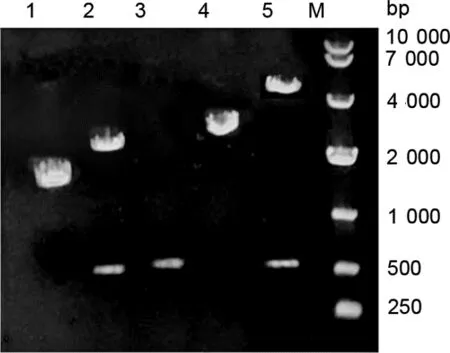
图2 真核表达载体质粒的构建和鉴定示意图

图3 不同种属间BST-2氨基酸序列同源性比对
2.4 BST-2突变体的构建及鉴定 对梅花鹿BST-2的六个潜在功能位点进行突变,设计这几个氨基酸突变至丙氨酸的引物,以VR1012-BST-2 IHA为模板,使用pfu酶对这几个位点进行突变PCR,琼脂糖凝胶电泳显示均在4 000~7 000 bp处获得了扩增产物(图5),经过测序证明,PCR产物均突变成功。
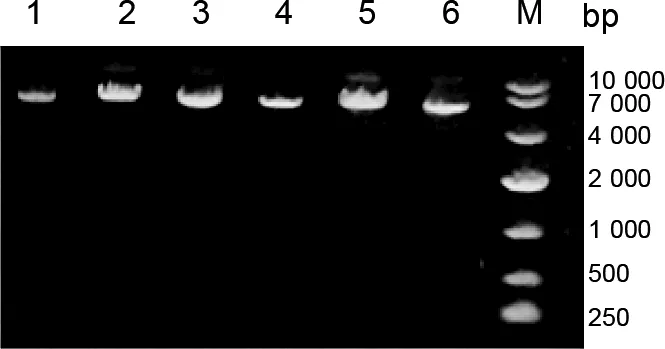
图5 梅花鹿BST-2突变体的构建
2.5 免疫印迹分析结果 人BST-2、梅花鹿BST-2野生型以及突变体真核表达质粒转染293T细胞,48小时后收取细胞进行Western Blotting分析,结果表明,与人BST-2类似,梅花鹿BST-2在WB分析中展示出三条带的特征(图6,第2道),分布于20~35 kDa之间。这可能是由于N-连接糖基化现象导致的。在对潜在的糖基化位点N85和N137进行突变后发现,BST-2的糖基化现象减少,变成了两条带(图六,第7、8道)。三个半胱氨酸残基以及K96A的突变对其蛋白表达形式没有影响(图6,第3至第6道)。

图6 BST-2在293T细胞中过表达的Western Blot分析
2.6 细胞表面表达分析结果 通过荧光显微镜观察可见,与转染空载体的阴性对照相比,转染了梅花鹿BST-2表达质粒的细胞表面明显可见绿色荧光(中插彩版图7),说明梅花鹿BST-2与人BST-2相同,能够在细胞膜表面表达,是一种膜蛋白。
3 讨论
本研究通过对梅花鹿外周血淋巴细胞中BST-2基因进行PCR扩增以及分子克隆,首次获得了梅花鹿BST-2基因的编码区,长度为480 bp编码159个氨基酸。通过同源性对比发现,梅花鹿BST-2蛋白氨基酸序列与牛和羊的BST-2A蛋白氨基酸序列同源性相对较高,分别为67.3%和74.2%。而与其他物种的同源性较低,为30% ~60%。近来的报道认为,BST-2的抗病毒活性主要依赖于其独特的结构特征,而非氨基酸序列,这解释了为什么BST-2在物种间的序列同源性较低。通过生物信息学软件分析,梅花鹿BST-2蛋白为两次跨膜蛋白,具有三个潜在的二聚化位点,两个潜在的糖基化位点以及一个潜在的泛素化位点。对潜在糖基化位点突变引起了BST-2蛋白在免疫印迹中高分子量条带减少,暗示了糖基化的抑制。
BST-2是一个两端跨膜蛋白,且N端胞浆区具有重要的功能,因此无论N端还是C端均不适合引入标签。为了更好的对其进行检测,我们引入了HA标签在其胞外段,并连入VR1012载体。通过转染293T细胞以及免疫印迹分析,可以看到BST-2在细胞内高效表达,免疫荧光分析证实了梅花鹿BST-2确实是一个膜蛋白,可以在细胞膜表面表达。
BST-2抑制包膜病毒释放的能力使其抗病毒谱非常广泛,梅花鹿作为一种重要的经济动物和保护动物,其抗病毒相关蛋白一直较少报道。本研究的发现填补了这一空白,为未来进一步研究梅花鹿相关病毒限制因子及其生物学活性奠定了基础。

