丹红注射液对阿托伐他汀钙在大鼠体内药动学的影响Δ
朱金燕,彭灿,胡容峰#,汤继辉,金涌
(1.安庆医药高等专科学校药学系,安徽 安庆 246052;2.安徽中医药大学药学院,合肥 230031;3.安徽医科大学药学院,合肥 230032)
阿托伐他汀钙(ATV)是临床上治疗高胆固醇血症、混合型高脂血症,防治冠心病和脑卒中的常用选择竞争性3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂[1]。该药可抑制体内胆固醇的合成,降低血清低密度脂蛋白(LDL)含量,从而达到调整体内血脂水平的目的[2]。丹红注射液是由丹参和红花组方制成的中药注射剂,其主要功能为活血化瘀、通脉舒络,常用于治疗冠心病、心绞痛、心肌梗死等[3]。临床上常采用丹红注射液联合ATV治疗冠心病、心绞痛等,研究显示联合用药后临床疗效显著增强[4],但两者联用后的药动学研究尚未见报道。
研究表明,多药耐药基因编码的P糖蛋白(P-gp)、微粒体混合功能氧化酶系中的细胞色素P450(CYP450)等均可影响ATV的血药浓度及降脂效果[5]。据报道,丹参的主要成分能够抑制P-gp的表达[6-8]及大鼠肝微粒体酶的活性[9-10]。因此,丹红注射液联合给药后,可能通过影响P-gp或CYP450而对ATV的体内药动学行为产生影响,进而影响后者药效的发挥。基于此,笔者通过研究丹红注射液单次给药对ATV在大鼠体内药动学行为的影响,为探究临床联合使用丹红注射液与ATV的安全性及合理性提供实验依据。
1 材料
1.1 仪器
Waters AcquityTM超高效液相色谱(UPLC)系统,包括Waters串联质谱(MS/MS)检测器、Masslynx 4.1工作站(美国Waters公司);LC-4016型低速离心机(安徽中科中佳科学仪器有限公司);TG16-WS型高速离心机(长沙湘仪离心机仪器有限公司);AB135-S型十万分之一电子天平[梅特勒-托利多仪器(上海)有限公司];XW-80A型微型涡旋混合器(上海沪西分析仪器厂有限公司);BCD-225CHC型冰箱(合肥美菱股份有限公司);Milli-Q GradientA10型超纯水系统[密理博(上海)贸易有限公司]。
1.2 药品与试剂
丹红注射液(陕西步长制药有限公司,批号:13101001,规格:10 mL/支);阿托伐他汀钙片(辉瑞制药有限公司,批号:J01570,规格:10 mg);阿托伐他汀钙对照品(批号:100590-201303,纯度:>95.3%)、盐酸噻氯匹定对照品(内标,批号:20120812,纯度:>99%)均来自中国食品药品检定研究院;甲醇为色谱纯,其余试剂均为分析纯,水为超纯水(实验室自制)。
1.3 动物
健康SD大鼠24只,雌雄各半,体质量为(200±20)g,由安徽省实验动物中心提供,动物生产许可证号:SCXK(皖)2011-002。
2 方法与结果
2.1 色谱与质谱条件
色谱条件:色谱柱为AcquityTMBEH C18(50 mm×2.1 mm,1.7 μm);流动相A为5 mmol/L甲酸铵溶液(含0.1%甲酸)、流动相B为甲醇,梯度洗脱(0→1.0 min,20%B;1.0→1.3 min,20%B→80%B;1.3→2.0 min,80%B→60%B;2.0→4.0 min,60%B→80%B;4.0→7.0 min,80%B→20%B;7.0→8.0 min,20%B);柱温为30 ℃;流速为0.2 mL/min;进样量为5 μL。
质谱条件:离子源为电喷雾离子源(ESI),采用正离子检测方式;毛细管电压为3.60 kV;离子源温度为150℃,去溶剂化温度为500℃;喷雾气为氮气,碰撞气为氩气;ATV和盐酸噻氯匹定(内标)的锥孔电压分别为44、30 V,碰撞能分别为22、26 eV;采用多反应离子监测(MRM)模式,质荷比(m/z)分别为 559.20→440.20(ATV)、264.20→154.05(内标)。
2.2 溶液的制备
精密称取ATV对照品2.00 mg于50 mL量瓶中,用甲醇溶解并定容,摇匀,即得40 μg/mL的ATV对照品贮备液;精密量取该贮备液适量,用甲醇逐级稀释制成相应质量浓度的ATV系列对照品溶液。精密称取盐酸噻氯匹定适量,用甲醇配制成质量浓度为20 μg/mL的内标贮备液;精密量取该贮备液适量,用甲醇稀释制成20 ng/mL的内标溶液。上述溶液均于4℃冷藏保存备用。
2.3 血浆样品预处理
取大鼠血浆100 μL置于肝素化处理过的离心管中,加入20 ng/mL的内标溶液100 μL,涡旋混合2 min;然后加入甲醇200 μL沉淀蛋白,涡旋混合3 min后,12 000 r/min离心10 min;吸取上清液,以0.22 μm有机滤膜滤过,取5 μL进样,进行UPLC-MS/MS分析。
2.4 方法学考察
2.4.1 专属性考察 取大鼠空白血浆、大鼠空白血浆+丹红注射液(空白血浆与丹红注射液体积比为10∶1)、大鼠空白血浆+ATV对照品(ATV在血浆中的终质量浓度为62.50 ng/mL)、大鼠灌胃ATV(10 mg/kg)后2 h时血浆及大鼠灌胃ATV(10 mg/kg)+尾静脉注射丹红注射液(2 mL/kg)后2 h时血浆,按“2.3”项下方法预处理(其中大鼠空白血浆、空白血浆+丹红注射液不加内标),按“2.1”项下色谱与质谱条件进样测定,总离子流色谱图见图1。结果显示,血浆中的内源性物质和丹红注射液中的各成分均不干扰ATV和内标的测定,本方法专属性良好;ATV保留时间约为5.8 min,内标保留时间约为3.5 min,两者峰形均良好。
2.4.2 标准曲线制备和定量下限考察 取大鼠空白血浆,分别加入不同质量浓度的ATV对照品溶液适量,配制成 ATV 质量浓度分别为 62.50、25.00、12.50、6.25、2.50、1.25、0.25 ng/mL的血浆样本,按“2.3”项下方法预处理,并按“2.1”项下色谱与质谱条件进样测定。以ATV的血药浓度(c)为横坐标、ATV与内标的峰面积比值(Y)为纵坐标进行线性回归,求得标准曲线方程Y=0.101 9c+0.149 6(R2=0.999 4)。结果表明,ATV的血药浓度线性范围为0.25~62.50 ng/mL,定量下限为0.25 ng/mL(RSD=5.8%,n=6)。
2.4.3 精密度试验 取大鼠空白血浆,分别加入不同质量浓度的ATV对照品溶液适量,配制成ATV低、中、高质量浓度(1.25、6.25、25.00 ng/mL)的血浆样本,每个浓度平行配制6份,按“2.3”项下方法预处理,并按“2.1”项下色谱与质谱条件进样测定,单日内测定3次,连续测定3 d,考察日内及日间精密度。结果显示,ATV低、中、高质量浓度血浆样本的日内RSD分别为8.34%、4.52%、9.31%(n=18),日间RSD分别为6.25%、8.13%、10.79%(n=18),表明本方法精密度良好,符合生物样品分析要求。
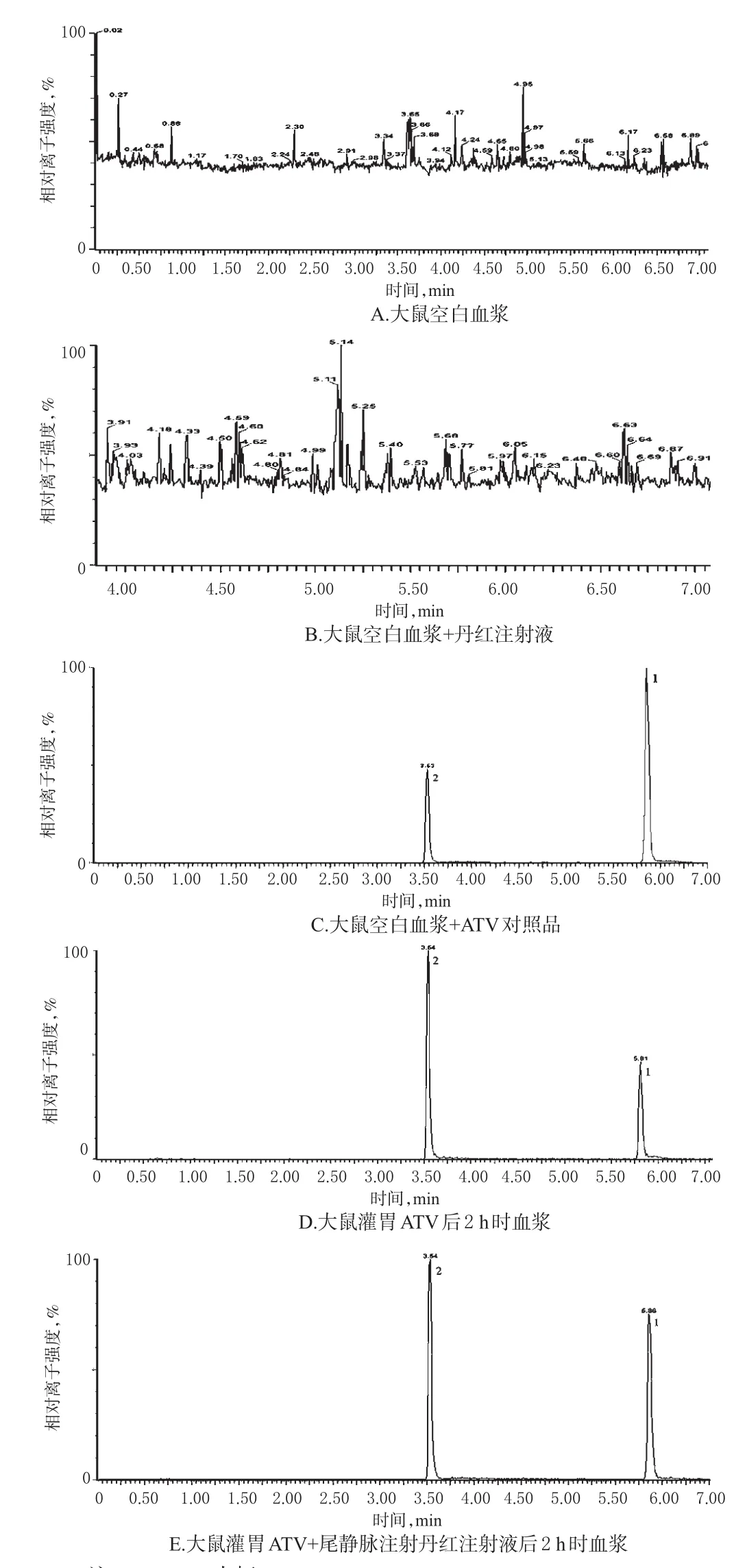
图1 各血浆样本总离子流色谱图Fig 1 TIC chromatogram of plasma samples
2.4.4 提取回收率试验 按“2.4.3”项下方法配制ATV低、中、高质量浓度(1.25、6.25、25.00 ng/mL)的血浆样本,每个浓度平行配制6份,同法预处理后进样,测得ATV与内标的峰面积比值(Y1);另取空白血浆,同法预处理后加入适量ATV对照品溶液,进样,测得ATV与内标的峰面积比值(Y空白)。按公式Y1/Y空白×100%计算提取回收率。结果显示,ATV低、中、高质量浓度血浆样本的平均提取回收率分别为88.30%、91.46%、87.64%,RSD均小于11%(n=6)。
2.4.5 稳定性试验 按“2.4.3”项下方法配制ATV低、中、高质量浓度(1.25、6.25、25.00 ng/mL)的血浆样本,每个浓度平行配制6份,分别在室温放置12 h、-80℃-室温反复冻融3次、-80℃放置14 d后,按“2.3”项下方法预处理,并按“2.1”项下色谱与质谱条件进样测定。结果显示,ATV低、中、高质量浓度血浆样本的血药浓度RSD分别为5.45%、6.78%、11.53%,RSD均小于15%(n=6),表明血浆样本中的ATV在上述条件下均较稳定。
2.4.6 基质效应考察 按“2.4.3”项下方法配制ATV低、中、高质量浓度(1.25、6.25、25.00 ng/mL)的血浆样本,每个浓度平行配制6份,同法预处理后进样,测得ATV与内标的峰面积比值(Y2);另以水代替血浆配制样本,同法预处理后进样,测得ATV与内标的峰面积比值(Y水)。按公式Y2/Y水×100%计算基质效应(ME)。结果显示,ATV低、中、高质量浓度血浆样本的平均ME分别为89.42%、86.54%、94.24%,RSD均小于10%(n=6)。
2.5 药动学实验
取24只大鼠,随机分为ATV单用组和丹红注射液低、中、高剂量联用组,每组6只。结合文献[11-13]并按人与大鼠体表面积比进行换算,确定各组ATV的给药剂量均为10 mg/kg,联用丹红注射液低、中、高剂量分别为1、2、4 mL/kg。实验前大鼠禁食不禁水12 h,次日清晨除ATV单用组大鼠尾静脉注射等体积生理盐水外,其余大鼠尾静脉注射相应剂量的丹红注射液;5 min后,各组大鼠均灌胃ATV(将ATV片剂以羟甲基纤维素钠溶液溶解后给药)。灌胃给药前(0 h),给药后5、10、15、30、45 min和1、2、4、6、8、12、24 h时在大鼠眼底静脉丛取血0.4 mL,置于肝素化处理的试管中,3 500 r/min离心10 min分离血浆。血浆样本按“2.3”项下方法预处理,并按“2.1”项下色谱与质谱条件进样测定,将测得的ATV与内标的峰面积比值代入随行标准曲线计算血药浓度。各组大鼠体内ATV的平均血药浓度-时间曲线见图2。
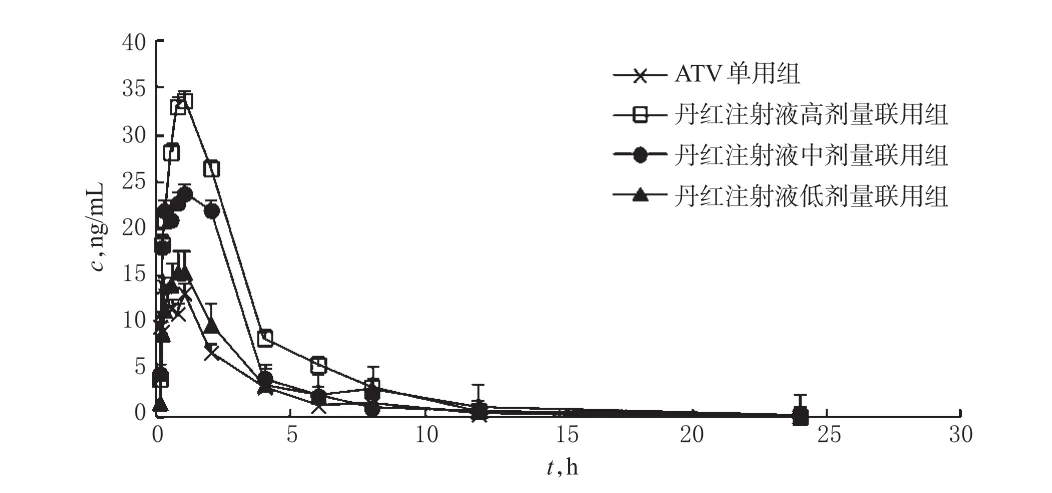
图2 各组大鼠体内ATV的平均血药浓度-时间曲线(n=6)Fig 2 Average plasma concentration-time curves of ATV in rats in each group(n=6)
采用3p97软件计算各组大鼠体内ATV的药动学参数,详见表1。ATV在各组大鼠体内的药动学特征均符合非房室模型。采用SPSS 17.0软件进行组间单因素方差分析,结果表明丹红注射液低、中、高剂量联用组的cmax、AUC0-24、AUC0-∞均高于ATV单用组,差异有统计学意义(P<0.05或P<0.01)。

表1 各组大鼠体内ATV的药动学参数(x±s,n=6)Tab 1 Pharmacokinetic parameters of ATV in rats(x±s,n=6)
3 讨论
本实验建立了大鼠血浆中ATV药物浓度的UPLC-MS/MS测定法,该方法简便,精密度、回收率高,稳定性较好,且不受内源性物质干扰,专属性好。筛选色谱条件时发现,在流动相中加入甲酸铵和甲酸后,可有效改善ATV的峰形及响应值。该检测方法定量下限低至0.25 ng/mL,可准确测定大鼠血浆中ATV的含量,灵敏度高。
药动学实验结果显示,与ATV单用组比较,除丹红注射液低剂量联用组的cmax之外,丹红注射液各剂量联用组的ATV药动学参数cmax、AUC0-24h、AUC0-∞均大幅度提高,差异均有统计学意义,但tmax、t1/2、MRT0-24h等参数却无显著差异。笔者分析其原因可能为:(1)ATV是P-gp的底物[14],当ATV与丹红注射液联合用药时,丹红注射液中的主要成分如羟基丹参酮ⅡA[6]、红花黄色素A[7]、隐丹参酮[8]等可能通过竞争性抑制P-gp而使ATV在体内的吸收量增加,从而使cmax等参数明显增大;(2)CYP3A4是ATV代谢的关键酶[15],而有研究证实丹红注射液不会影响CYP3A4的活性[16],故不会影响ATV在体内的代谢速度,因此t1/2等参数无显著差异。
另外,丹红注射液临床静脉注射给药剂量为4 mL,根据人体表面积换算后的大鼠给药剂量为0.8 mL/kg。参考文献[11-13],本研究最终确定丹红注射液的低、中、高剂量分别为1、2、4 mL/kg。ATV的临床起始给药剂量为10 mg,根据人体表面积换算后的大鼠起始给药剂量应该为1 mg/kg。然而,Shu N等[17]采用10 mg/kg作为ATV的大鼠给药剂量;Galani V等[18]研究格列美脲与ATV的相互作用时选择ATV的大鼠给药剂量为60 mg/kg。综合以上文献并考虑到本研究所建立检测方法的灵敏度,最终选择10 mg/kg ATV作为大鼠给药剂量。由于药物给药剂量直接影响药物间相互作用结果,因此后续在检测方法灵敏度进一步提高的情况下,可考虑在降低ATV给药剂量的实验条件下继续探讨其联合用药后受到的影响,以更接近临床实际用药情况。
综上,本研究结果表明,丹红注射液联合给药可影响ATV在大鼠体内的药动学行为,即可增加ATV在大鼠体内的暴露量。考虑到实际用药中两药的给药次数、给药剂量及人与大鼠对ATV代谢存在的种属差异,因此有必要开展后续研究以明确两者在临床上合并用药时的药动学相互作用,以确保安全、合理用药。

