牦牛KDM1A基因克隆及其在不同发育时期睾丸中的表达规律
韩 杰,熊显荣,王 艳,杨显英,阿果约达,黄向月,李 键
(西南民族大学 生命科学与技术学院,成都 610041)
牦牛(Bosgrunniens)生活在中国高原地区,能够适应高寒、缺氧的生态环境,能充分利用高原地区天然草地为人们提供优质健康的食品。此外,牦牛在动物基因遗传资源研究中也是一个极其珍贵的基因库,在自然繁殖的牦牛群中,牦牛的繁殖力仅为30%~40%。近些年,虽然对牦牛育种的研究不断深入,并取得了较大的进展[1]。牦牛繁殖力低的问题严重阻碍了牦牛业及高原地区的经济发展。因此,牦牛繁殖性能的研究对提高牧区人们的生活水平和丰富中国遗传资源多样性具有重大意义[2]。
组蛋白去甲基化酶1A(lysine-specific histone demethylase 1A)是一种黄素腺嘌呤二核苷酸(FAD)依赖性单胺氧化酶,是胺氧化酶家族中的一员,其主要包括Tower、SWIRM和胺氧化酶3个结构域[3-4]。同时,KDM1A介导的是H3K4me1/2和H3K9me1/2去甲基化作用[5]。对该基因的研究发现,KDM1A在哺乳动物组织中普遍表达,并且可通过抑制或激活相关基因转录,来调控DNA损伤、还原转录子的活性以及纺锤体和染色体的缺失,进而在多种生物体的生殖细胞系中发挥重要作用[6-11]。此外,该基因同样参与了细胞增殖、凋亡和转移、胚胎发育的调节、机体造血的调控以及性激素受体介导基因的转录调控等过程[6,12-16],由此可知,KDM1A基因在哺乳动物生殖发育调控、造血系统、多能干细胞的调控及内分泌等相关生物学活动的调节中均起重要作用。
关于KDM1A基因的研究主要集中在人和动物的生长发育及肿瘤等相关疾病上[17-19],而该基因在牦牛上的研究未见相关报道。为进一步研究KDM1A基因在牦牛睾丸中的表达情况,本研究克隆牦牛KDM1A基因,并对KDM1A序列的蛋白结构和生物信息学功能进行分析和预测;应用实时荧光定量PCR技术检测牦牛KDM1A基因在睾丸中的表达情况,为进一步研究牦牛的KDM1A基因及其在牦牛生殖生理过程中所发挥的作用奠定基础。
1 材料与方法
1.1 主要试剂与仪器
Trizol Reagent购自Invitrogen(美国)公司,SYBRTMPremix Ex TaqTMⅡ试剂盒、PrimeScriptTMRT Reagent Kit反转录试剂盒、Premix TaqTMDNA聚合酶、pMDTM19-T载体均购自TaKaRa(大连)公司,感受态细胞DH5α购于天根生化科技有限公司,DNA胶回收试剂盒购自Axygen公司,其他无特殊说明均为国产分析纯;荧光定量PCR仪、电泳仪、琼脂糖凝胶成像系统均购自美国Biodine Rad公司。
1.2 牦牛组织样本采集
样本均采自成都青白江屠宰场,无菌采集健康牦牛(4~5岁)的不同组织:心、脾、肝、卵巢、肺、大脑、肾、子宫、睾丸、胃、大肠;采集胎牛(5~6月)、幼年时期(1~2岁)、性成熟时期(4~5岁)、老年时期(9~10岁)牦牛睾丸组织。所需样本均采集3头,保存于液氮中。
1.3 牦牛组织总RNA的提取及其完整性检测
Trizol法提取样本RNA,对所提取的RNA使用1%的琼脂糖凝胶电泳进行完整性检测,结果显示,两条以上亮条带,且无弥散和拖带的现象,表明所得RNA完整性很好。应用核酸分析仪检测浓度和OD值,选取OD260 nm/OD280 nm值为1.8~2.0的RNA作为模板,按照PrimeScriptTMRT Reagent Kit反转录试剂盒说明书合成cDNA,使用GAPDH基因的特异性引物检测cDNA的质量,对琼脂糖凝胶电泳结果显示单一清晰条带的cDNA进行编号,-20 ℃保存备用。
1.4 引物设计及合成
根据NCBI已报道的野牦牛(Bosmutus)KDM1A(GenBank登录号:XM_005905175.2)和GAPDH基因mRNA序列(GenBank登录号:AC_000162.1),使用Primer 5.0分别设计引物(表1)。由上海生工生物工程有限公司合成。
1.5 目的基因的扩增与克隆
PCR反应体系为25 μL,其中Premix TaqTMDNA聚合酶12.5 μL, cNDA 1.0 μL, ddH2O 9.5 μL,上、下游引物(10 μmol·L-1)各1.0 μL。PCR扩增条件: 94 ℃预变性4 min; 94 ℃变性45 s, 58 ℃退火1 min(3段的退火温度分别为62.2、56.4和53.0 ℃),72 ℃延伸1 min,35个循环;72 ℃ 7 min。10 g·L-1琼脂糖凝胶电泳检测PCR产物,紫外光下切取目的条带并按照胶回收试剂盒说明书回收目的DNA。然后将回收产物与pMDTM19-T载体在16 ℃连接过夜,转化到感受态细胞DH5α中。将菌液均匀涂于LB固体培养基(AMP+)平板上,37 ℃培养过夜,随机挑去单菌落,在摇床震荡培养8 h,以菌液为模板进行PCR鉴定,将呈阳性结果的菌液,送上海生物工程有限公司测序。
表1引物信息
Table1Primerinformation
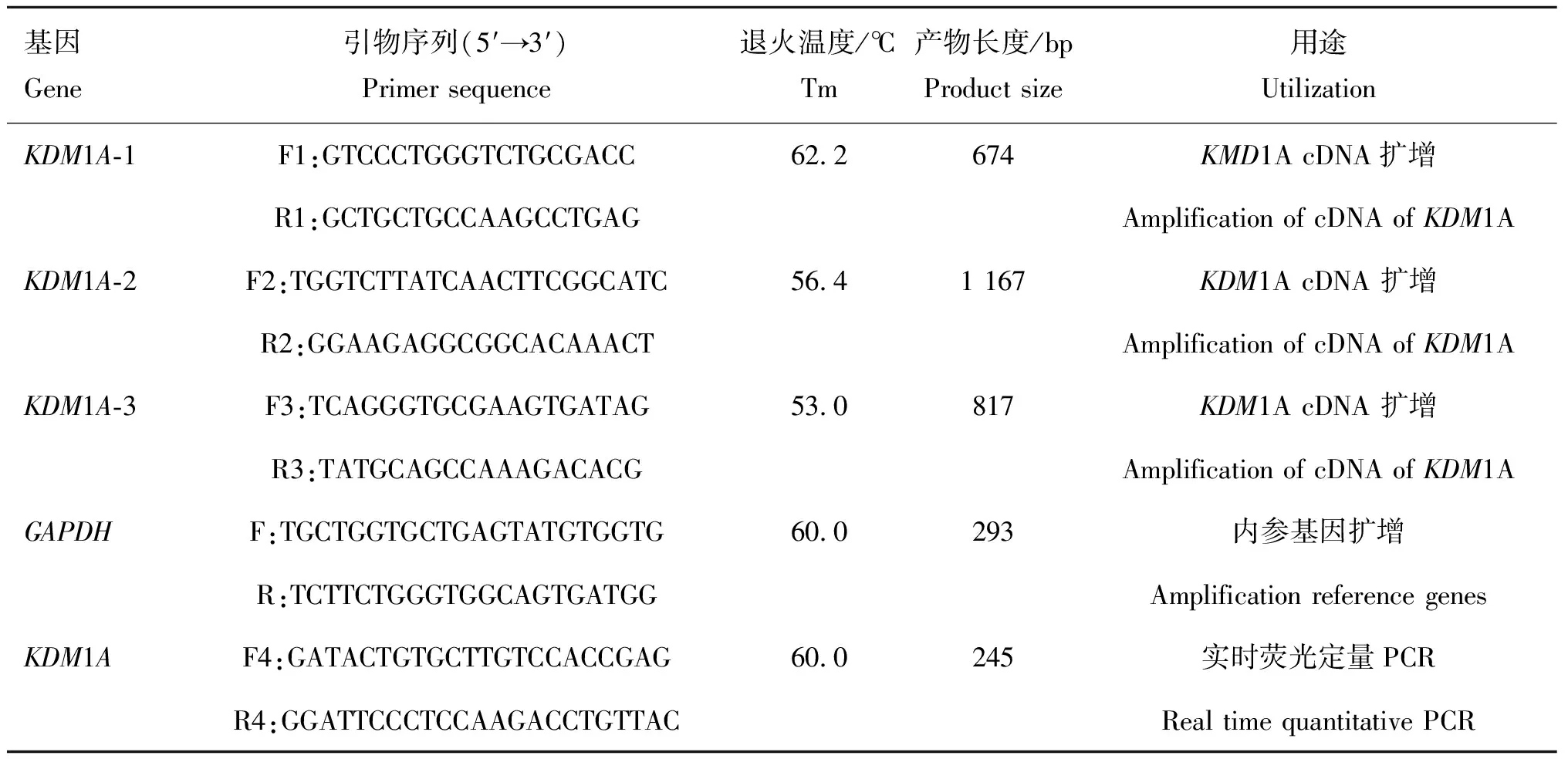
基因Gene引物序列(5′→3′)Primer sequence退火温度/℃Tm产物长度/bpProduct size用途UtilizationKDM1A-1F1:GTCCCTGGGTCTGCGACC62.2674KMD1A cDNA扩增R1:GCTGCTGCCAAGCCTGAGAmplification of cDNA of KDM1AKDM1A-2F2:TGGTCTTATCAACTTCGGCATC56.41 167KDM1A cDNA 扩增R2:GGAAGAGGCGGCACAAACTAmplification of cDNA of KDM1AKDM1A-3F3:TCAGGGTGCGAAGTGATAG53.0817KDM1A cDNA 扩增R3:TATGCAGCCAAAGACACGAmplification of cDNA of KDM1AGAPDHF:TGCTGGTGCTGAGTATGTGGTG60.0293内参基因扩增 R:TCTTCTGGGTGGCAGTGATGGAmplification reference genesKDM1AF4:GATACTGTGCTTGTCCACCGAG60.0245实时荧光定量PCRR4:GGATTCCCTCCAAGACCTGTTACReal time quantitative PCR
F.正向引物;R.反向引物
F.Forword primer; R.Reverse primer
1.6 牦牛KDM1A基因生物信息学分析
NCBI中ORF Finder分析KDM1A序列的开放阅读框,并获得氨基酸序列,BLAST在线工具进行同源性比对;使用在线软件Protparam、ProtScale(理化性质、疏水性)、SignalP(信号肽)、TMHMM(跨膜区)、NetPhos(磷酸化位点)、SOPMA、SWISS-MODEL(二级结构、三级结构)对KDM1A蛋白进行生物信息学分析;在NCBI中找到需要建树的相关物种该基因序列,并利用MEGA 5.0软件进行比对和系统进化树构建。
1.7 牦牛KDM1A基因组织表达谱检测
采用实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)检测KDM1A基因在牦牛心、脾、肝、卵巢、肺、大肠、大脑、肾、子宫、睾丸、胃中的表达。RT-qPCR反应体系为15 μL,其中SYBR®Premix Ex TaqTMⅡ 7.5 μL,cNDA 1.0 μL,上、下游引物(10 μmol·L-1)各0.5 μL,ddH2O 5.5 μL。PCR扩增条件:95 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,共40个循环,重复3次。
1.8 牦牛睾丸组织中KDM1A基因表达分析
采用实时荧光定量PCR(quantitative real-time PCR, RT-qPCR)检测不同时期牦牛睾丸中KDM1A基因的表达。RT-qPCR反应体系同1.7。每个样本进行3次重复,用2-△△Ct法对定量结果进行分析。
1.9 数据分析
荧光定量结果用“平均值±标准误(Mean±SEM)”表示。采用SPSS软件进行显著性分析,P<0.01差异极显著,P>0.05差异不显著,P<0.05差异显著。
2 结 果
2.1 样本RNA完整性检测
用琼脂糖凝胶电泳检测RNA完整性,结果显示,所提组织RNA均出现两条清晰明亮的条带(18S和28S),且无弥散和拖带的现象,无蛋白和DNA等杂质的污染,表明所得RNA完整性很好(图1)。
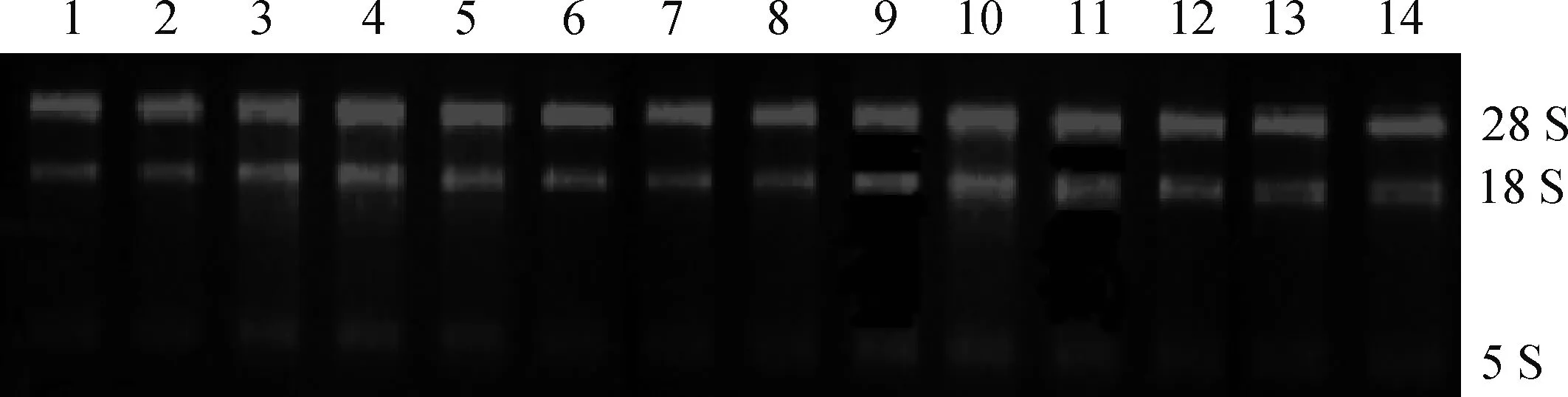
1.肝;2.睾丸;3.心;4.脾;5.肺;6.大肠;7.卵巢;8.肾;9.子宫;10.大脑;11.胃;12.胎牛睾丸;13.幼年期睾丸;14.老年期睾丸1.Liver; 2. Testis; 3. Heart; 4. Spleen; 5. Lung; 6. Large intestines; 7. Ovary; 8. Kidney; 9. Uterus; 10. Cerebrum; 11.Stomach; 12. Fetal bovine testis; 13. Juvenile testis; 14. Senile testis图1 各组织RNA的琼脂糖凝胶电泳结果Fig.1 Result of agarose gel electrophoresis of different tissues RNA
2.2 牦牛KDM1A基因CDS扩增及克隆测序
以牦牛睾丸组织的总RNA为模板,利用RT-PCR对KDM1ACDS区进行扩增,得到单一清晰条带(图2),并使用DNAMAN对所得序列进行拼接。获得核苷酸序列为2 401 bp(图3),开放阅读框为2 331 bp,共编码776个氨基酸。
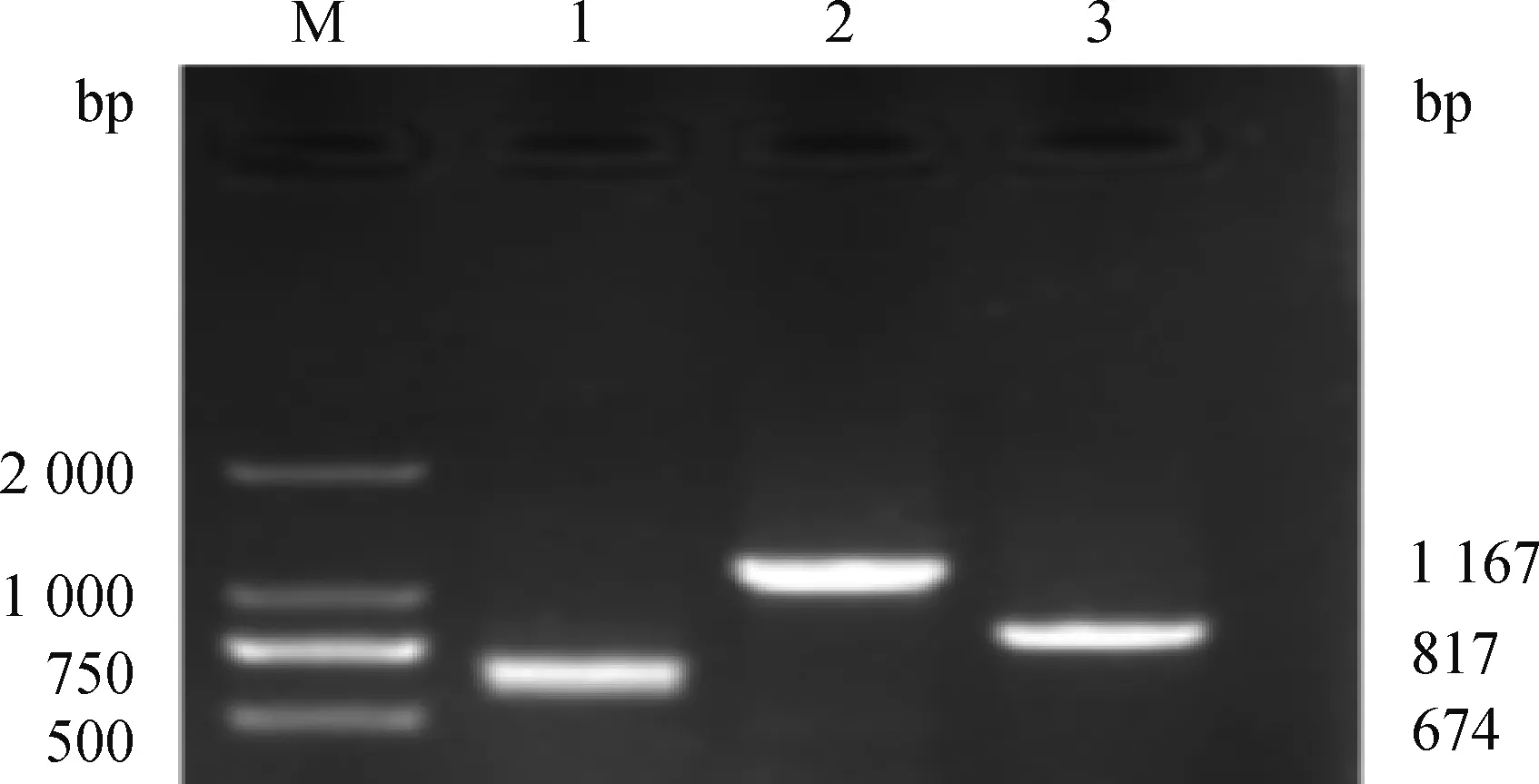
M.DL2000 DNA marker;1~3. KDM1A-1、 KDM1A-2、 KDM1A-3的PCR产物M.DL2000 DNA marker; 1-3.The PCR products of yak KDM1A-1, KDM1A-2, KDM1A-3图2 牦牛KDM1A基因PCR扩增结果Fig.2 Result for PCR amplification of yak KDM1A
2.3 物种间KDM1A基因同源性比较及进化树构建
将克隆测序的牦牛KDM1A基因与黄牛(XM_005203319.1)、野牦牛(XM_005905175.2)、绵羊(XM_012152442.2)、山羊(XM_995676880.3)、野猪(NM_001112687.1)、骆驼(XM_010979844.1)、人(KJ_904681.1)、犬(XM_022413506.1)、猫(XM_019836867.1)、马(XM_014737273.1)、家鼠(NM_001356567.1)、兔(XM_008265704.2)、原鸡(XM_015297587.1)、非洲爪蟾(XM_002936594.4)进行比对,同源性分别为99.6%、99.7%、97.6%、97.6%、93.6%、93.8%、90.9%、93.0%、92.9%、93.0%、89.4%、89.5%、81.5%、77.9%。随后对15个物种KDM1A基因进行系统进化树构建,结果表明,该基因在物种进化过程中有很高的保守性,其中与牦牛KDM1A基因亲缘关系最近的是野牦牛,其次是黄牛、绵羊、山羊等(图4)。
2.4 牦牛KDM1A蛋白结构和功能预测
采用ExPASY在线工具分析KDM1A蛋白的理化性质,该蛋白分子质量为85.96 ku,分子式C3823H6038N1052O1155S23,等电点5.82,脂肪系数84.21,半衰期30 h,不稳定指数为41.46,带负电残基数(Asp + Glu) 97,带正电残基数(Arg + Lys) 85。推测该蛋白可能是不稳定的酸性蛋白。出现频率较高的氨基酸残基有Glu(8.1%)、Val(7.1%)、Leu(9.9%)、Ala(8.4%),且不包括吡咯赖氨酸(Pyl)和硒半胱氨酸(Sec)。疏水性预测分析,KDM1A蛋白亲水性分值在第15位最小为-3.144,第628位最大为2.656,总平均亲水性-0.378<0,且较大多数氨基酸残基具有亲水性,推测为亲水性蛋白,与所分析的蛋白理化性质结果一致。SignalP、TMHMM分析表明,KDM1A蛋白为不含跨膜结构和信号肽的蛋白。蛋白修饰磷酸化位点预测发现,该蛋白有31个Ser位点,28个Thr位点和14个Tyr位点。KDM1A蛋白二级结构预测知,295个α-螺旋占38.02%,64个β-转角占8.25%,271个无规卷曲占34.92%,146个延伸链占18.81%(图5),同时该蛋白的三级结构进一步验证了二级的预测。
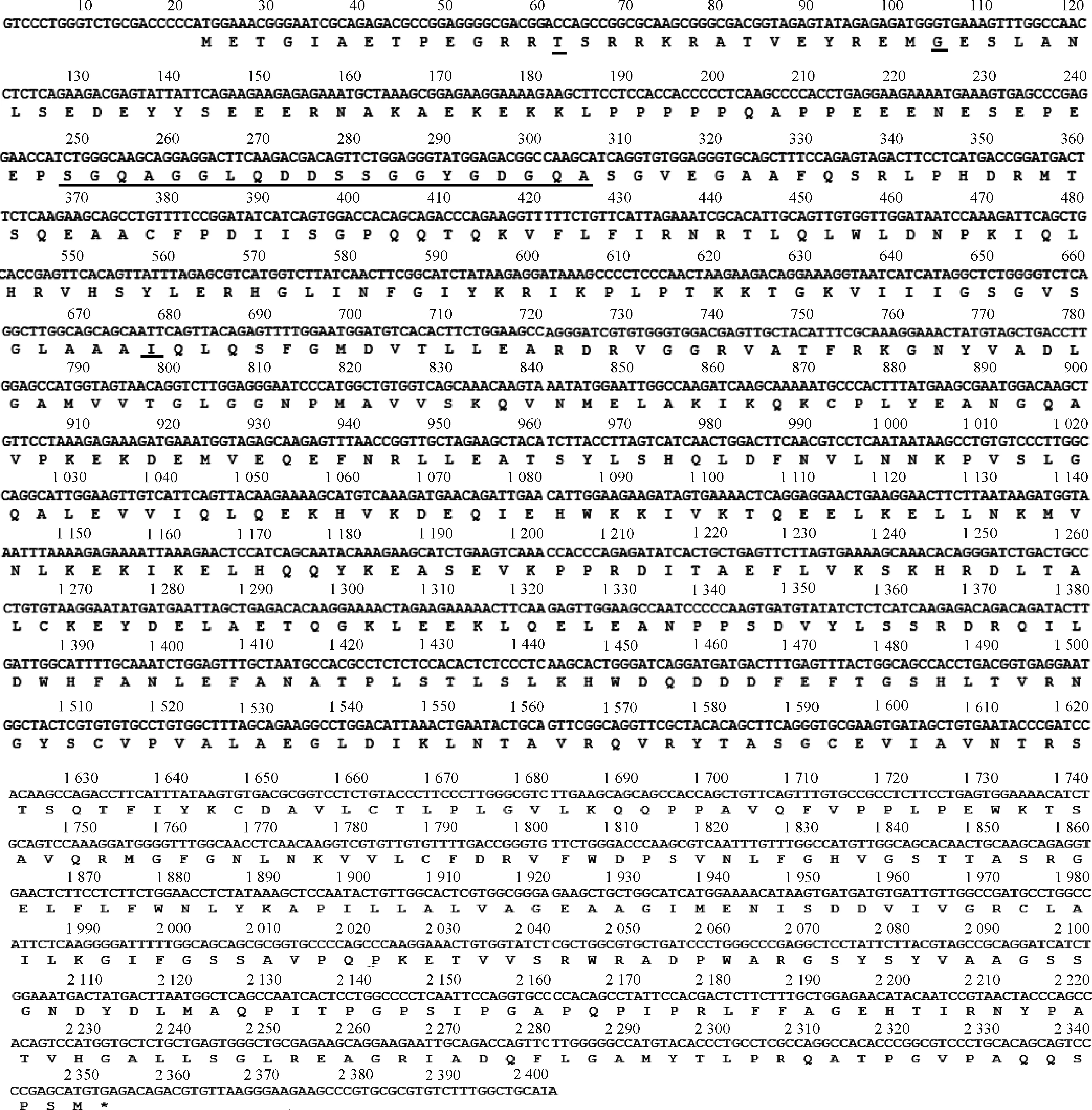
上行表示牦牛KDM1A基因核苷酸序列;下行表示推测的氨基酸序列;下划线表示突变碱基;*表示终止密码子The upper lines show the nucleotide sequences and the lower lines show the deduced amino acid sequences.Base mutations are underlined;* shows termination codon图3 牦牛KDM1A基因核苷酸及其推测的氨基酸序列Fig.3 Nucleotide sequences and the deduced amino acid sequences of yak KDM1A
2.5 牦牛KDM1A基因的组织表达谱
以内参基因GAPDH作为参照,利用RT-qPCR检测KDM1A基因在牦牛心、肝、脾、肺、肾、小肠、卵巢、子宫、胃、睾丸、大脑组织中表达,结果显示,其在牦牛各组织中普遍表达,但仍存在差异,其中该基因在睾丸和肝中的表达相对较高,心和卵巢中的表达次之,脾、肺、肾、子宫、大脑、大肠、胃中的表达相对较低(图6)。
2.6 牦牛不同发育时期睾丸中KDM1A基因的表达
以内参基因GAPDH作为参照,利用RT-qPCR检测KDM1A基因在牦牛不同时期睾丸中mRNA的表达情况(图7)。结果显示,KDM1A基因从胎牛~老年期睾丸中表达水平呈明显的先上升后下降趋势,以胎牛时期该基因的表达量作为参考,幼年和老年期约为胎牛时期的15倍(P<0.01);以幼年期的作为参考,该基因在性成熟时期的表达量显著高于幼年期,约为其表达量的1.6倍(P<0.05),与老年期睾丸中KDM1A的表达水平差异不显著(P>0.05)。
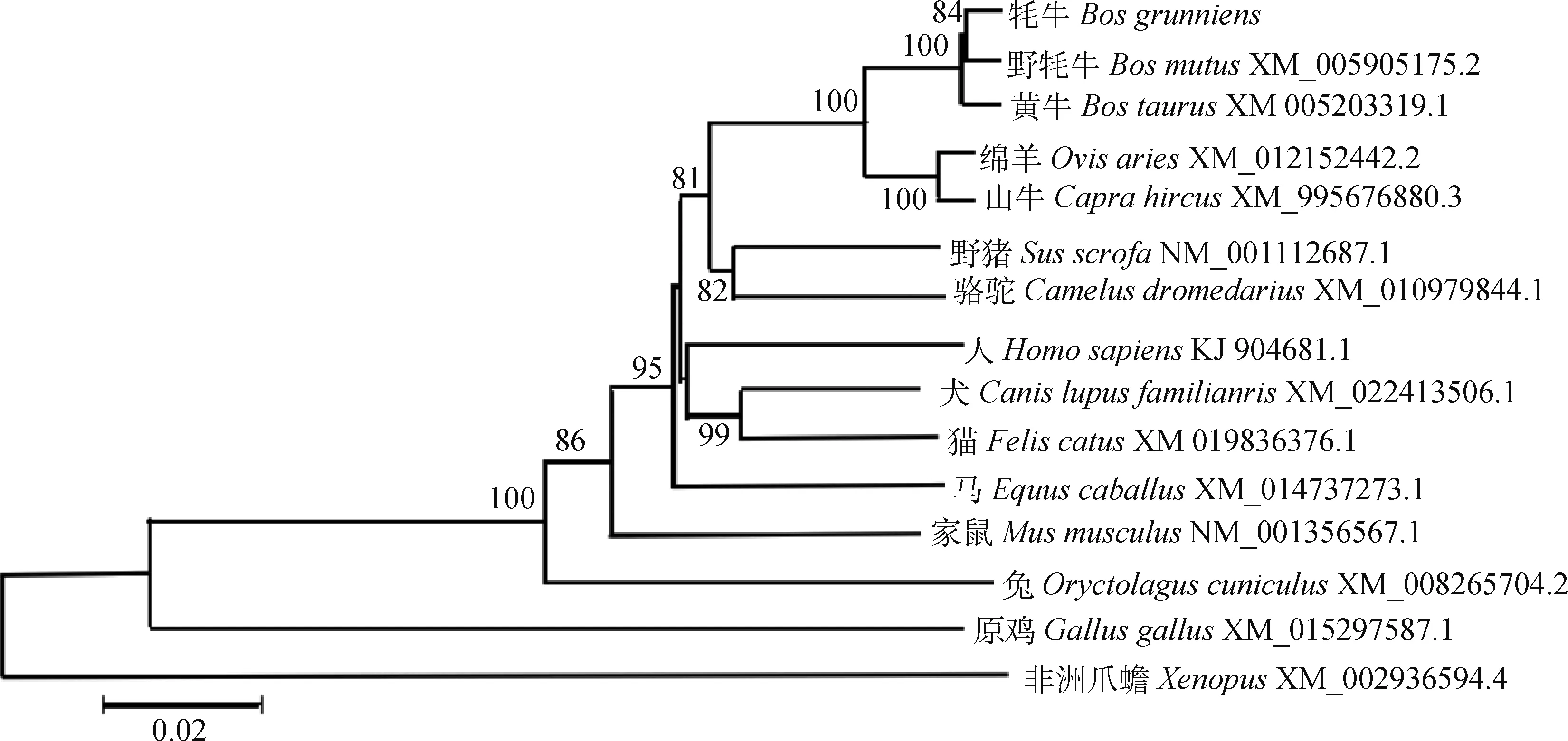
图4 不同物种间的系统进化树Fig.4 Phylogenetic tree of KDM1A of various species
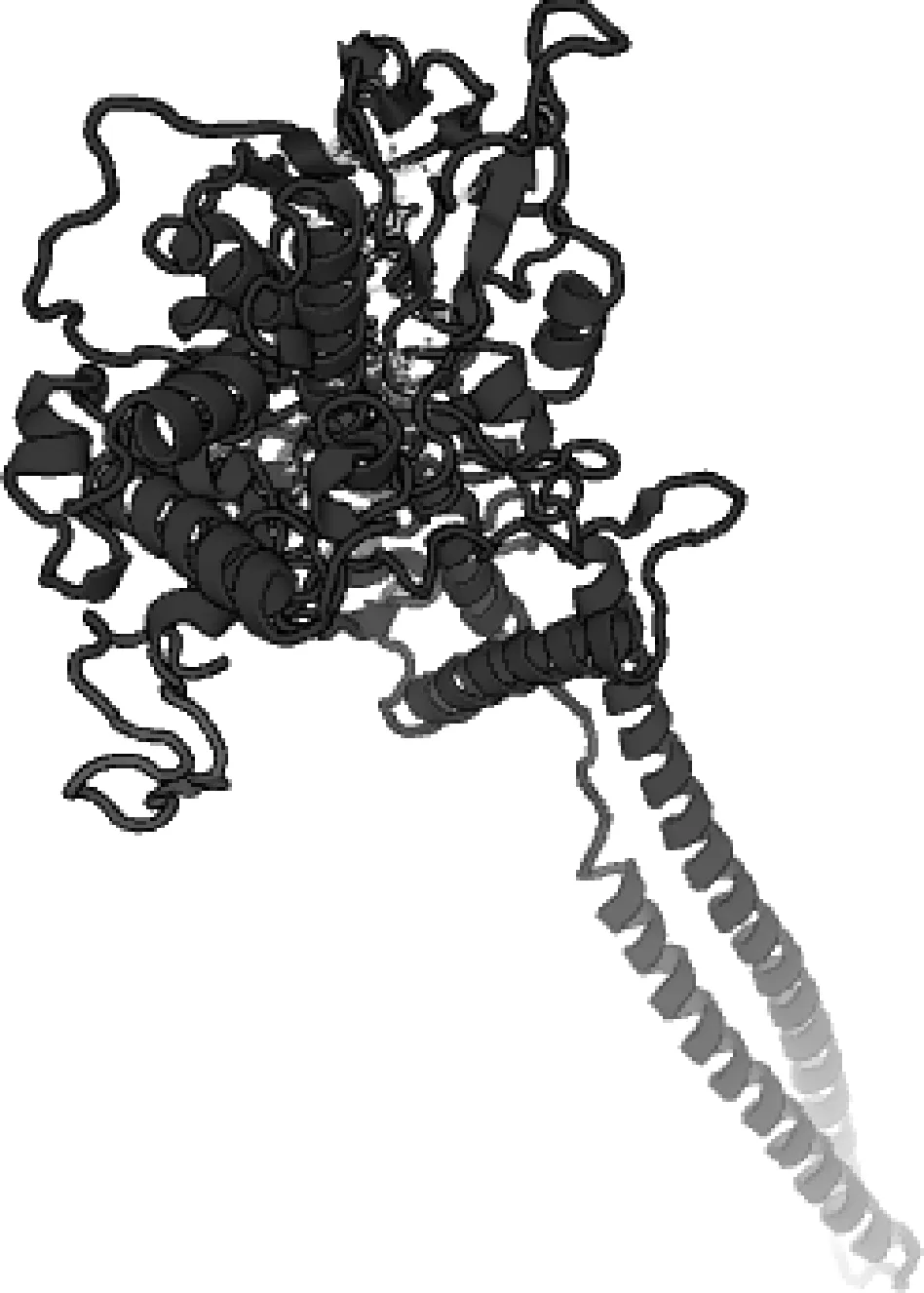
图5 牦牛KDM1A蛋白三级结构预测Fig.5 Tertiary structure prediction of KDM1A protein of yak
3 讨 论
KDM1A是位于细胞核上的一种黄素腺嘌呤二核苷酸(FAD)依赖性单胺氧化酶,是胺氧化酶家族中的一员。KDM1A主要催化H3K4me1/2和H3K9me1/2的去甲基化,并且可通过调控相关基因表达来介导精子的发生过程[20]。本研究克隆获得牦牛KDM1A基因核苷酸序列,与野牦牛对比,发现编码区除了存在4处碱基突变,使编码区第28位、35位、223位氨基酸,变化由K→T,D→G,R→I,还发现从250 bp开始,比野牦牛多出了连续的60 bp碱基,导致多编码20个氨基酸,依次是SGQAGGLQDDSSGGYGDGQA。但这种氨基酸的突变是否会导致蛋白功能改变,有待深入的研究。同源性分析发现,该基因与野牦牛、黄牛的同源性最高,暗示牦牛KDM1A基因在进化过程中具有较高的保守性。
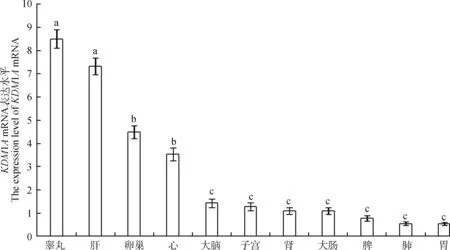
组织间比较:不同字母代表差异显著(P<0.05)Comparison among tissues: Different letters show significant differences(P<0.05)图6 KDM1A基因在牦牛不同组织中的表达Fig.6 The expression of KDM1A in yak different tissues

与胎牛比较:**.差异极显著(P<0.01);*.差异显著(P<0.05)Comparison with fetal bovine: ** show very significant difference(P<0.01),* show significant differences(P<0.05)图7 KDM1A基因在牦牛不同发育时期睾丸中的表达水平Fig.7 The expression of KDM1A in different growth periods of yak testis
组织表达谱分析结果发现,该基因mRNA在所选牦牛组织中均有表达,这与文献[8]的结果一致,且其表达量在睾丸、肝中较高,在睾丸中表达量高的原因可能和其在调控精子形成过程中起重要作用有关[20]。其在肝中表达量较高可能是和Wnt信号通路调节肝干细胞增殖、分化以及谷氨酰胺新陈代谢作用相关。已有研究证明,Wnt/β-Catenin信号通路在肝的发育、再生、新陈代谢以及氧化应激等方面发挥着重要作用,其中编码谷氨酰胺转移酶、鸟氨酸转氨酶和谷氨酰胺转运体(参与谷氨酰胺新陈代谢活动的酶)基因的表达受该通路的调控作用。敲减KDM1A可解除Wnt信号通路的抑制,进一步调控与该通路相关基因的表达[21-24]。
睾丸是产生雄激素、精子的重要场所,其包括不同发育阶段的生精细胞、支持细胞和分泌雄性激素以维持雄性功能和促进精子形成的间质细胞等多种功能各异的细胞。有研究发现,KDM1A可通过调控相关基因的表达活性来介导精原干细胞的维持和分化过程,进而在精子发育和形成过程中发挥至关重要的作用[21]。
本试验采用实时荧光定量PCR的方法检测了该基因在不同发育时期牦牛睾丸中的表达差异。结果表明,KDM1AmRNA在不同时期睾丸中均有表达,但其表达量存在差异,表明KDM1A基因在睾丸发育过程中发挥一定作用。胎牛(5~6月)时期的睾丸仅有少量支持细胞、未分化的精原干细胞,出生后,随着年龄增长,性成熟后(3~4岁)的牦牛睾丸较幼年期(1~2岁)的变化较大,主要包括间质细胞数量、生精上皮和生精细胞数量种类以及生精细胞层的明显增厚、增多[25]。有研究发现,雄激素受体多存在于间质细胞和支持细胞,同时,KDM1A可与该受体结合,调控其依赖性基因的表达,进一步介导睾丸发育以及睾酮调控精子发生的过程。因此,随着幼年牦牛步入性成熟,其睾丸内的间质细胞增多,迫使了更多的雄激素受体激活以便于睾丸的正常发育以及保证精子的发生过程的顺利进行[26-27]。综上表明,KDM1A在精子发生的分化过程发挥着重要功能。因此,从胎牛(出生前)~性成熟(3~4岁)的不同时期,KDM1A表达量呈显著上升趋势。这一变化主要和睾丸发育过程中间质细胞以及生精细胞种类和数量增多有关,也是精子发生所必须的变化趋势。然而随着年龄增长,生精功能逐渐下降,生精细胞层数也明显减少,精原细胞、精母细胞和精子细胞均有不同程度的减少,精子细胞数明显减少,老年期较性成熟时期的KDM1A表达量又显著下降。由此推测,KDM1A基因可能参与了牦牛睾丸发育过程。
4 结 论
本研究成功克隆了牦牛KDM1A序列。生物信息学分析表明,KDM1A基因CDS区的保守性较高。同时,KDM1A基因在牦牛不同发育时期睾丸中的表达规律表明,该基因可能参与牦牛睾丸的发育。此结果为进一步研究KDM1A基因对牦牛生殖机能的调控提供基础资料。

