澳洲坚果蛋白夹心ELISA方法的建立及应用
贾增艳 王晓敏 沙志聪 周柔柔 生 威 张 燕
(1. 食品营养与安全国家重点实验室﹝天津科技大学﹞,天津 300457;2. 天津科技大学食品工程与生物技术学院,天津 300457;3. 天津市食品科学与健康重点实验室﹝南开大学﹞,天津 300071;4. 南开大学医学院,天津 300071)
坚果是八大类过敏原之一,其中澳洲坚果营养丰富,临床试验[1-2]表明,天然澳洲坚果、经烘焙加工的澳洲坚果都会引起患者不同程度的过敏反应,出现全身瘙痒、眼睛、嘴唇肿胀呼吸困难甚至晕厥等症状。Ekbote等[3]对过敏患者进行皮肤点刺试验(SPT)发现,澳洲坚果中可能存在一种分子量约为17 kDa的主要过敏原;Herbst等[4]通过免疫印迹分析,报道了澳洲坚果中另2种过敏原蛋白,其分子量分别在12,45 kDa左右。过敏原的有效检测是避免易致敏人群误食过敏原的有效手段之一,当前研究最多、应用最广泛的检测方法是基于蛋白过敏原的酶联免疫吸附分析法(ELISA)[5]和基于DNA的PCR检测法[6-7]。Brezna等[8]建立了一种实时PCR方法,用于检测食品中的澳洲坚果,检测限为1.45 pg/mL,并通过14种样品验证PCR方法的实际适用性,此方法能够灵敏地检测食物样品中的澳洲坚果,但并未报道是否适用于热加工后的坚果中过敏原的检测。经过热加工后食物中的DNA会受损难以提取,极易造成PCR检测结果的假阴性,因此PCR法检测食物中过敏原会对检测结果的准确性造成影响[9]。热处理会使蛋白结构发生变化从而对与抗体的结合造成不同程度的影响。因此,基于抗原抗体特异性结合原理建立的ELISA方法应用于热加工食品中过敏原蛋白的检测也存在检测适用性的难题。Maleki等[10]研究表明焙烤花生比生花生过敏原与IgE有更强的结合能力。刘珂等[11]研究表明加热使得OVT、OVA、OVM蛋白结构发生变化,相比于未处理蛋白,与抗体结合能力减弱。不同的过敏原蛋白热稳定性不同,对澳洲坚果蛋白在经过热加工后的结构变化及过敏原的定量检测尚未有报道。本研究拟针对澳洲坚果蛋白制备多克隆抗体,建立双抗夹心ELISA方法,并对该方法应用于热加工后的澳洲坚果及焙烤食品中的澳洲坚果蛋白的定量检测进行评价,以期为加工食品中澳洲坚果过敏原的检测提供有效方法。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
澳洲坚果(Macadamia integrifolia):HAEA294,云南江城中澳农业科技发展公司;
大豆、核桃、榛果、杏仁、花生、开心果、腰果和小麦:市售;
免疫动物:3月龄雄性新西兰白兔、6~7周龄雌性BALB/c小鼠,中国食品药品检定研究所;
弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白(BSA)、羊抗兔IgG-HRP、羊抗鼠IgG-HRP、Tris、甘氨酸、BCA蛋白定量试剂盒、十二烷基磺酸钠(SDS)、过氧化氢脲(CH6N2O3)、3,3,5,5-四甲基联苯胺(TMB)、脱脂乳粉、鱼皮胶、明胶、酶标稳定剂:含量≥99%,美国Sigma公司;
Tween 20:化学纯,海浦东化工试剂厂;
β-环糊精、二甲基亚砜(DMSO):化学纯,德国Merck公司;
预制胶:12%,美国Bio-Rad公司;
其他试剂均为分析纯。
1.1.2 主要仪器设备
免疫亲合层析柱:Protein A-Sepharose 4B、Protein G-Sepharose 4B型,美国Amersham公司;
蛋白纯化仪:731-8300型,美国BIO-RAD公司;
酶标仪:F200 PRO型,美国Thermo公司;
磁力搅拌器:RH-KT型,德国IKA公司。
1.2 方法
1.2.1 澳洲坚果蛋白的制备与验证
(1) 除脂:将无壳生澳洲坚果仁充分研磨,用料液比为1∶20 (g/mL)的正己烷室温下搅拌浸提16 h,经过0.45 μm 有机系纤维素膜过滤,收集果粉重复上述操作,挥发残留的正己烷。将得到的坚果粉过50目筛,真空包装后于-20 ℃保存备用。
(2) 提取:采用正己烷脱脂、碱提取(MAPI)方法提取澳洲坚果蛋白[12],用去离子水溶解得到的蛋白沉淀冷冻干燥,将得到的蛋白质粉在-20 ℃保存备用[13-15]。
(3) SDS-PAGE:参照Zhang等[16]方法,对制备的澳洲坚果蛋白进行SDS-PAGE分析。
1.2.2 澳洲坚果蛋白的兔多克隆抗体制备 以所制备的澳洲坚果蛋白为免疫原对雄性新西兰白兔进行免疫,2周免疫1次。初次免疫的乳化剂使用完全佐剂,免疫剂量1 mg/只,后4次增强免疫选择不完全佐剂,免疫剂量0.5 mg/只。第2次免疫1周后开始耳部静脉取血,第5次免疫结束1周后采股动脉全血,用IC-ELISA法测定血清效价,用Protein A-Sepharose-4B免疫亲合层析柱纯化获得抗体[17]。
1.2.3 澳洲坚果蛋白鼠多克隆抗体的制备 选择6~7周龄雌性BALB/c小鼠进行免疫。初次免疫时免疫原与弗氏完全佐剂1∶1体积混合乳化,每隔2周与不完全佐剂混合加强免疫,免疫剂量均为100 μg/只,第5次免疫结束1周后取全血,Protein G-Sepharose-4B免疫亲合层析纯化,于-20 ℃ 保存备用。
1.2.4 澳洲坚果蛋白双抗夹心ELISA检测步骤 将兔抗澳洲坚果蛋白抗体以100 μL/孔包被于96孔酶标板上,在4 ℃下孵育12 h后用PBST洗板3次,加封闭液(200 μL/孔)于37 ℃下封闭1 h。用PBST洗板3次,加入梯度稀释的澳洲坚果蛋白溶液(100 μL/孔),室温下孵育1 h后PBST洗板4次。加入鼠抗血清(100 μL/孔),室温下孵育1 h后用PBST 洗板4次。将HRP标记的鼠二抗(100 μL/孔)加到酶标板上,室温反应30 min后用PBST洗板5次,加入底物A和B的混合液(100 μL/孔),37 ℃下显色(15~20 min),每孔加入50 μL硫酸终止液后在波长450~650 nm读取吸光度值。以蛋白浓度为横坐标,吸光度值(A450-A650)为纵坐标绘制标准曲线。检出限(LOD)为A空白平均值±3SD对应的蛋白浓度,定量限(LOQ)为A空白平均值±10SD对应的蛋白浓度。
1.2.5 双抗夹心ELISA检测方法特异性的测定 选择大豆、核桃、榛果、杏仁、花生、开心果、腰果和小麦8种常见过敏原,采用与澳洲坚果蛋白相同的方法制备相应的蛋白,采用建立的双抗夹心ELISA方法进行检测。PBS缓冲液作为阴性对照。样品孔和阴性对照孔的吸光度值分别用P和N来表示。如果P/N>2,则表明样品中的蛋白与抗体有交叉反应。
1.2.6 双抗夹心ELISA检测方法的应用 自制饼干,定量添加澳洲坚果,同时以不含澳洲坚果的饼干为对照,采用本研究建立的蛋白提取方法提取样品中的澳洲坚果蛋白,采用建立的双抗夹心ELISA方法检测饼干中澳洲坚果过敏原蛋白的含量,按式(1)计算回收率:
(1)
式中:
P——回收率,%;
成立于1997年的广州松兴电气有限公司主要从事电阻焊机、自动焊专机及机器人焊接系统的开发、制造、销售和技术服务。近年来,除了不断完善和发展电阻焊标准产品外,松兴公司还致力于各种大型自动焊接设备、焊接生产线的开发制造,努力向行业纵深发展,先后承接并成功设计、制造了一大批面向国内外知名企业的自动焊接生产线。
C1——添加澳洲坚果蛋白样品的检测值,mg;
C0——未添加澳洲坚果蛋白样品的检测值,mg;
C2——澳洲坚果蛋白理论添加值,mg。
1.3 数据处理
所有试验平行测定3次,利用统计学软件SPSS 22.0对试验结果进行方差分析(P<0.05),用Origin 8.0绘制检测方法的相关曲线图。
2 结果与分析
2.1 澳洲坚果蛋白的验证
将所制备的澳洲坚果蛋白(1 mg/mL)通过SDS-PAGE分析(图1),由图1可见,澳洲坚果蛋白分子量主要分布在15~50 kDa 左右,其中分子量在20,45 kDa左右的蛋白含量较高,与Herbst等[4]研究结果一致。

M. 蛋白分子量标准参照 1. 澳洲坚果蛋白
2.2 双抗夹心ELISA免疫检测方法的建立
在以澳洲坚果蛋白为免疫原制备的兔多克隆抗体和鼠多克隆抗体基础上,优化双抗夹心ELISA免疫检测条件。
2.2.1 捕获抗体及封闭液的选择 由于夹心ELISA方法检出限与空白值大小密切相关,先对捕获抗体和封闭液进行优化。将兔抗和鼠抗分别作为捕获抗体包被于酶标板上,1 g/100 mL 的脱脂乳粉、BSA、鱼皮胶、明胶、酪蛋白作为封闭液,检测抗体分别为鼠抗和兔抗,测得空白的吸光度值见表1。
由表1可见,以兔多克隆抗体作为捕获抗体时,采用不同封闭液的空白吸光度值均低于鼠抗,说明所制备的兔多抗的特异性要好于鼠多抗,以其为捕获抗体时非特异性吸附较小,因此确定该方法的捕获抗体为兔多抗,检测抗体为鼠多抗,可在一定程度上提高检测方法的灵敏度和特异性。同时,1 g/100 mL脱脂乳粉为封闭液时空白值最小,说明脱脂乳粉对酶标板上空余位点的封闭效果最好,且与鼠抗的非特异性吸附最弱,有助于提高检测的灵敏度。因此选择脱脂乳粉作为封闭液,并进一步优化封闭液浓度。
由表2可知0.5 g/100 mL的脱脂乳粉空白值最小,低浓度(0.1 g/100 mL)脱脂乳粉封闭的空白值比0.5 g/100 mL脱脂乳粉的大,可能是封闭液中蛋白浓度小导致未能完全封闭酶标板上未被捕获抗体占据的空余位点,造成检测抗体与空余位点结合的非特异性吸附;1.0 g/100 mL脱脂乳粉空白值最大,可能是浓度大使非特异性吸附增加所致。因此优化后的封闭液为浓度0.5 g/100 mL的脱脂乳粉。

表2 不同脱脂乳粉浓度下空白的平均吸光度值
2.2.2 捕获抗体包被量的优化 将兔多克隆抗体作为捕获抗体,分别稀释至0.025,0.050,0.100 μg/孔进行包被,分别绘制标准曲线(图2)。捕获抗体的包被量对检测方法的灵敏度有很大影响,捕获抗体量越多,特异性结合的过敏原越多,因此会对待检过敏原起到富集的作用,相应提高方法的灵敏度。但捕获抗体过高,会造成非特异性吸附增加,使空白值增大,又会降低检测灵敏度。因此捕获抗体量需要通过试验优化确定。结果表明,包被量为0.050,0.100 μg/孔时空白值相差不大且都具有良好的线性相关性,同时比0.025 μg/孔包被量在同一浓度蛋白对应的检测吸光度值高,从节约抗体角度考虑,将捕获抗体的包被量确定为0.050 μg/孔。

图2 捕获抗体包被量对澳洲坚果蛋白双抗夹心酶联免疫检测方法的影响
Figure 2 Effect of coating quantity of capture antibody on macadamia nut protein sandwich ELISA
2.2.3 检测抗体稀释倍数的优化 固定优化后的捕获抗体包被量和封闭液,将检测抗体(鼠多抗)分别按1∶1 000,1∶1 500,1∶2 000,1∶2 500的比例进行稀释,绘制标准曲线(图3)。检测抗体(鼠多抗)除与澳洲坚果蛋白过敏原发生特异性结合外,当其浓度过高时会使非特异性吸附增加造成空白值增大,降低特异性检测的灵敏度。结果说明,1 000倍稀释抗体所得到的空白值最高,而以1 500,2 000,2 500倍稀释检测抗体得到的空白值相差不大,以1∶2 000比例进行稀释检测抗体得到线性相关性最好,因此检测抗体的最佳稀释倍数确定为2 000。
2.2.4 酶标二抗稀释倍数的优化 固定优化后的捕获抗体包被量、封闭液和检测抗体浓度,用PBS(pH 7.4,0.1 mol/L)缓冲液将羊抗鼠酶标二抗按1∶10 000,1∶20 000,1∶30 000 进行稀释,绘制标曲,结果见图4。羊抗鼠酶标二抗能特异性识别检测抗体鼠多抗,利用二抗上结合的酶作为整个体系的检测信号,理论上其浓度越大,催化酶底物产生的信号越强,方法越灵敏,但酶浓度过高时会导致蛋白类物质的非特异性结合,造成酶标二抗的非特异性吸附,会降低待测物与检测信号间的线性相关性,因此酶标二抗浓度的优化非常关键。优化结果表明,以1∶20 000,1∶30 000稀释时R2均接近于1,吸光度值无明显差异,为节约抗体,选择羊抗鼠酶标二抗的稀释倍数为30 000倍。

图3 检测抗体稀释倍数对澳洲坚果蛋白双抗夹心ELISA的影响
Figure 3 Effect of detection antibody dilution factor on macadamia nut protein sandwich ELISA
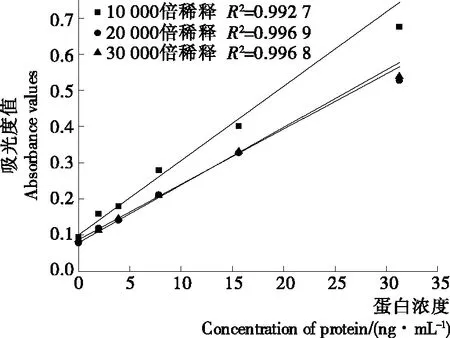
图4 酶标二抗稀释倍数对澳洲坚果蛋白双抗夹心酶联免疫检测的影响
Figure 4 Effect of dilution factor of enzyme labeled second antibody on macadamia nut protein sandwich ELISA
2.2.5 双抗夹心ELISA法标准曲线的绘制 配制系列蛋白标准溶液,采用优化的分析条件进行检测,以蛋白浓度作为横坐标,吸光度值作为纵坐标绘制双抗夹心ELISA检测澳洲坚果过敏原蛋白的标准曲线(图5),计算得LOD值为 (0.95±0.17) ng/mL,LOQ值为(3.13±0.57) ng/mL。
2.2.6 双抗夹心ELISA方法的特异性 为评价所建立方法的特异性,将大豆、核桃、榛果、杏仁、花生、开心果、腰果和小麦蛋白用PBS缓冲液分别配制成浓度分别为0.1,1.0,10.0 μg/mL 的蛋白溶液。以PBS缓冲液作为阴性对照,采用建立的澳洲坚果蛋白双抗夹心ELISA方法测定,读取相应的吸光度值,结果见表3。

图5 澳洲坚果过敏原蛋白双抗夹心酶联免疫检测方法

表3 双抗夹心酶联免疫检测方法的特异性
从表3中可以看出,榛果和开心果蛋白与澳洲坚果抗体有较弱的结合反应,其他6种过敏原蛋白均无交叉反应。说明榛果蛋白和开心果蛋白与澳洲坚果蛋白具有相似的结构,与Sutherland 等[18]的研究结果一致。
2.3 双抗夹心ELISA检测方法的检测稳定性
用PBS缓冲液稀释澳洲坚果蛋白,浓度为30.0,16.0,8.0,4.0 ng/mL,以板内变异与板间变异对建立的双抗夹心ELISA进行精密度测试。
将4个浓度的蛋白溶液在同一酶标板上分别进行5个平行测试,计算A450-A650的板内变异系数为3.36%~7.20%。相同条件综合5 d测得的吸光度值,计算板间变异系数为3.83%~12.05%,均低于15%,说明该方法具有较好的稳定。
2.4 双抗夹心ELISA方法的应用
2.4.1 烘焙加工处理对澳洲坚果蛋白提取率的影响 将澳洲坚果经170 ℃处理20 min,以未处理的生澳洲坚果作为对照样品,探讨常见焙烤条件对澳洲坚果蛋白提取率的影响,结果见表5。
澳洲坚果经170 ℃加热处理后,蛋白得率显著降低(P<0.05),是未加工处理蛋白得率的90%左右,说明热加工在一定程度上降低了蛋白提取率,可能是加热改变了蛋白的结构,使蛋白溶解度降低。
2.4.2 饼干中澳洲坚果蛋白的测定 自制定量添加澳洲坚果的饼干,用碱溶酸沉法提取饼干中的澳洲坚果蛋白。用建立的双抗夹心ELISA法进行测定,以未添加澳洲坚果的饼干为对照。根据表5蛋白得率计算澳洲坚果蛋白的理论添加量,以及焙烤饼干中可被提取的澳洲坚果蛋白的理论含量,按照式(1)分别计算回收率,结果见表6。

表4 澳洲坚果蛋白双抗夹心ELISA检测的板内及板间变异

表5 焙烤加工处理对蛋白提取率的影响†
† 同列不同字母表示差异显著(P<0.05)。

表6 双抗夹心ELISA检测饼干中澳洲坚果蛋白的添加回收率
不考虑热加工处理对澳洲坚果蛋白得率的影响,以焙烤后的澳洲坚果蛋白理论含量计算,添加回收率为82.07%~85.49%,表明该方法用于澳洲坚果蛋白检测的准确度较好。以未处理的澳洲坚果蛋白的理论添加量计算,添加回收率为73.67%~77.03%,回收率偏低的原因可能是热加工使部分澳洲坚果蛋白的结构发生变化,导致样品中蛋白提取率降低,另外空间结构的变化可能导致抗原表位变化,从而与抗体识别力下降,表现为ELISA检测结果整体偏低。
3 结论
本试验通优化封闭液、捕获抗体的包被浓度,检测抗体、酶标二抗的稀释倍数,建立了澳洲坚果蛋白的双抗夹心ELISA方法。选用抗体包被量为0.05 μg/孔,封闭液为0.5 g/100 mL 脱脂乳粉,检测抗体稀释倍数为2 000,羊抗鼠HRP-酶标二抗稀释倍数为30 000,方法的最低检出限为(0.95±0.17) ng/mL,定量限为(3.13±0.57) ng/mL,检测线性范围为3.13~30.00 ng/mL。测定结果的变异系数<12.05%,说明所建立的澳洲坚果蛋白双抗夹心ELISA方法有良好的特异性与稳定性。该法应用于焙烤的澳洲坚果和饼干中澳洲坚果蛋白检测,回收率较高,说明该方法适用于焙烤食品中澳洲坚果蛋白的定量检测。

