时辰过敏学:生物钟如何影响过敏反应
Atsuhito Nakao, MD, PhD
翻译:李俊达 中国医学科学院 北京协和医学院 北京协和医院变态(过敏)反应科
审校:洪建国 上海交通大学附属第一人民医院儿科
昼夜节律是指约以24 h为周期的一种生物节律,可以在所有生物体的行为和生理上观察到。“circadian”这个词来源于拉丁文circā(关于)和diēs(一天),表示关于一天。生物钟是驱动昼夜节律的内源性时间维护机制[1-3]。甚至在缺乏外部刺激时,生物钟可以产生极强的约24 h的节律。它也可以根据环境(例如光线、用餐时间、锻炼和强烈的社交活动)而调节时间。
有充分的证据表明,过敏性疾病表现为昼夜节律性波动。过敏性疾病患者的许多症状和实验室检测指标都存在明显的昼夜变化[4-5]。例如:大多数过敏性鼻炎患者夜间或者清晨(“清晨发作”)症状加重,从而影响夜间睡眠,导致白天生活质量下降[4]。然而,直到现在,这些现象的确切机制仍然是个谜。
新的研究发现,免疫系统与生物钟系统有着根本的联系[6-10]。过敏反应作为一种免疫反应类型,本质上受到生物钟的调控[11-13]。本文从对生物钟控制过敏反应的了解、昼夜节律紊乱对过敏的影响和生物钟调节剂对过敏性疾病控制的可能应用等方面的进展进行阐述。
1 哺乳动物细胞内的分子钟
通过地球自转几乎所用生物体都受到以24 h为周期的外部环境变化影响。这些环境变化包括昼夜周期、温度和食物供应以及被捕食者攻击的风险。因此,生物体进化出了驱动其行为和生理昼夜节律的内在计时器,被称作生物钟,这使他们能够预测和适应环境的日常变化[1-3]。
哺乳动物的昼夜节律通过基因周期性表达产生,这些基因表达受细胞内自主和自我维持的分子钟调控[2-3]。这些分子钟由以转录因子大脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(BMAL1)和昼夜运动输出周期故障蛋白(CLOCK)为中心的串联转录翻译反馈环组成(图1)。BMAL1与CLOCK形成异二聚体并结合到E-box基序上,从而作用于基因组并启动周期抑制因子1(Per1)、Per2和Per3及隐花色素1(Cry1)和Cry2等靶基因转录,而PER和CRY蛋白形成寡聚体进入核内抑制BMAL1/CLOCK的活性。这种负反馈环以及多种转录后调节结合,大约需时24 h才能完成,其作为分子振荡器调节启动子/增强子区域内具有E-box基序的数千个时间控制基因(CCGs)的周期性表达。绝大多数CCGs编码了代谢、激素、神经和免疫功能中多种细胞信号通路的关键调节因子。事实上,Bmal1缺陷小鼠缺乏功能性分子钟,导致大多数组织CCGs波动缺失,从而出现行为和生理节律失调[14]。
除了这个核心反馈环,还存在一个调节Bmal周期和振幅的稳定回路。其由核受体维甲酸相关孤儿受体(ROR)α和REV-ERBα(Nrld1)形成。BMAL1/CLOCK异二聚体激活RORα和REV-ERBα转录,而RORα和REV-ERBα分别激活和抑制BMAL1转录。哺乳动物生物钟转录调控的细节,包括每日染色质重塑的动态控制已经在其他文献进行了阐述[15-16]。
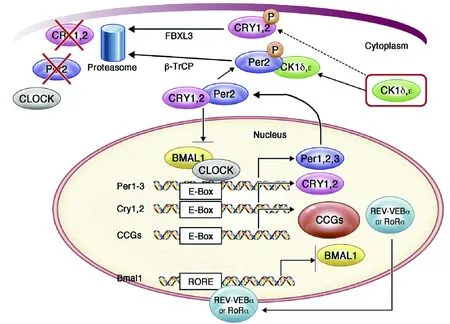
图 1 哺乳动物分子钟标准模型
哺乳动物昼夜节律的分子基础是每个细胞中的几个“生物钟基因”组成的一个转录翻译反馈环。转录因子Bmal/Clock异二聚体通过结合启动区/增强区E-box(CANNTG)基序激活Per和Cry转录、RORα和Nr1d1(REV-ERBα)和其他CCGs编码。生成的PER和CRY蛋白二聚体重新进入细胞核通过抑制Bmal/Clock活性抑制自身表达。这个负反馈环同时受到转录后调控,通过CK1δ/ε介导的磷酸化降解PER和CRY。磷酸化的PER和CRY分别是泛素化配体β-TrCP和FBXL3的活性靶点,从而引导泛素化和蛋白酶体依赖的降解。相应的,核心生物钟周期大约24 h,从而形成大约24 h的CCG表达节律。这个核心环受到RORα和REV-ERBα辅助反馈环的影响。Bmal/Clock异二聚体激活RORα和REV-ERBα的转录,它们分别活化和抑制BMAL1转录。PF-670432是抑制CK1δ/ε活性的化合物,减缓PER降解并延长昼夜节律周期。请注意这是经典模型,近期研究揭示了分子钟由更多复杂的生物钟基因网络构成
分子钟通过以控制大量CCGs循环的方式来调节细胞活动周期。例如,小鼠腹腔巨噬细胞表达的17 398个基因中的1403(约8.1%)个基因以昼夜节律方式波动[17],这些基因包括许多病原体识别和细胞因子分泌的重要调节因子,这导致对细菌或病毒免疫应答的昼夜变化[6-10]。通常,周期基因表达水平很高,而且用于合成和降解周期间mRNAs和蛋白水平的能量是非周期基因的2倍[18]。因此,为了节约能量可能需要以周期方式选择性下调高表达基因,并且节律性基因表达可能优化全基因表达的代谢值[18]。
通常情况下,分子钟以大约24 h为周期自行波动(自由运行,小鼠大约23.5 h),因此需要每天调整以适应周期性环境信号。分子钟的每部分都可以受到非周期蛋白的调节,例如核激素受体(如糖皮质激素受体)[2-3]。这些调控导致分子钟的时相、振幅和周期的调整,以应答时间相关事件(如光和进食)的信号输入,如下文所述。
2 多种细胞生物钟在整体水平上同步生物节律
人体由约40万亿个细胞组成,每一个细胞都具有自己的生物钟。我们体内众多细胞生物钟是如何协调运作的呢?哺乳动物的昼夜节律系统由主振荡器和外周振荡器组成,主振荡器位于下丘脑的视交叉上核(SCN)神经元,外周振荡器几乎存在于各类细胞,包括免疫细胞(外周生物钟;图2)[2-3]。SCN由视网膜神经支配,使它受到太阳光昼夜周期影响。实际上,光线信号使SCN神经元Per表达上调并引起昼夜节律变化。随后,中央SCN钟通过下丘脑-垂体-肾上腺轴和自主神经系统传递时间信息给外周生物钟[19-20]。因此,SCN钟的主要功能是维持外周振荡器稳定在相应时相。这个分层组织系统保持了中央与外周时象一致,并且使大多数组织的生理时间状态同步。小鼠SCN消融确实导致多数组织昼夜节律一致性消失和行为、生理节律的失调。
目前并没有完全了解到体内来自SCN的系统时间信号是如何使大量免疫细胞同步的。然而,体液因子可能在免疫细胞生物钟的同步中起重要作用。例如小鼠活体成像分析显示,肥大细胞PER2的表达呈现昼夜节律,在活动相达到峰值,而在静息相出现谷值[21]。实施肾上腺切除术后,昼夜节律消失(图3A)[21-22]。此外,合成的糖皮质激素地塞米松可在体内外同步肥大细胞的生物钟,并伴有Per的表达(图3B)[21]。提示糖皮质在体内肥大细胞生物钟同步中发挥作用。确实,糖皮质激素受体结合的糖皮质激素反应元件存在于Per1和Per2的启动子区[20]。肾上腺糖皮质激素分泌(人体的皮质醇和小鼠的皮质酮)的昼夜节律受SCN和肾上腺钟的调节,在活动相开始之前达到最高峰值[23]。因此,SCN诱导的糖皮质激素升高能在整体水平上每天同步肥大细胞生物钟一次。
交感神经兴奋既可以直接通过肾上腺受体影响免疫细胞,也可以通过调节血液或淋巴流量、介导神经肽释放(如P物质)至感觉神经末端或调节白细胞分布来间接影响免疫细胞[24]。有趣的是,最近基于小鼠研究发现,交感神经末梢释放的去甲肾上腺素能通过同步淋巴细胞生物钟和整体水平上维持淋巴细胞促迁移因子节律性表达来控制淋巴细胞向淋巴结迁移[25-26]。因此,受SCN调控的交感神经兴奋也可能通过去甲肾上腺素作为免疫细胞生物钟的时间引导。
3 非光信号导致生物钟周期转换
生物周期转换指生物钟活动与24 h为周期的环境信号(称作“授时因子”)同步的过程。如前所述,光,尤其蓝光是极强的授时因子,使中央SCN钟周期转换和进行时间调整(相和周期)。
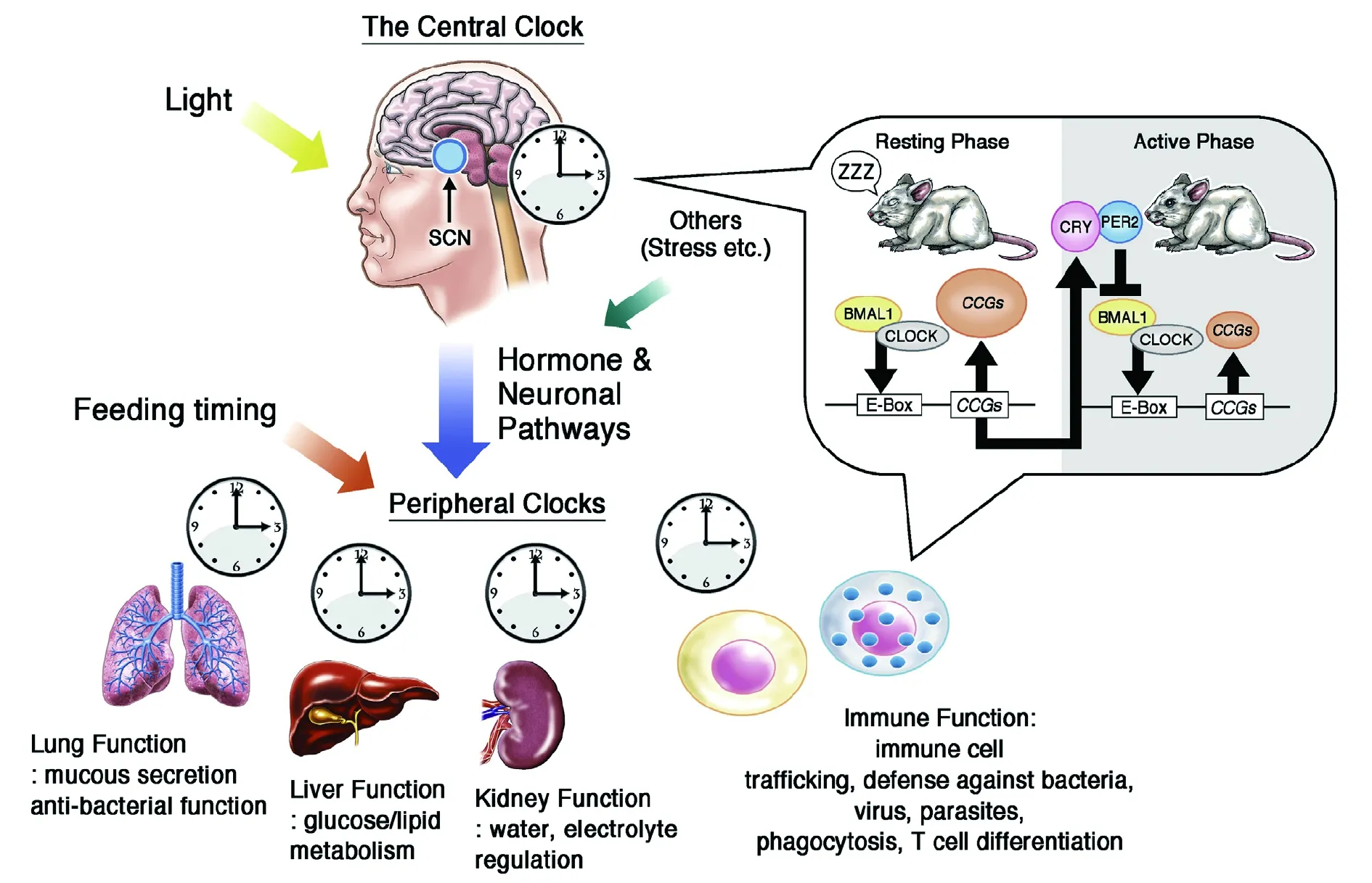
图 2 哺乳动物昼夜节律系统层次结构图

图 3 肥大细胞生物钟的昼夜节律调节和IgE介导的肥大细胞活化
最近研究发现外周生物钟可以通过非光授时因子,如进食时间、温度、压力,而不依赖SCN进行周期转换[27-28]。例如,小鼠在夜间(活动期)喂食和自由采食时其肝脏基因表达周期相似。反之,白天喂食小鼠几乎完全颠倒了肝脏振荡器基因表达周期[29-30]。这个结论提示在相反时段进食,外周生物钟可以摆脱光敏感SCN建立新的昼夜节律。非光因素对外周生物钟周期影响的具体机制尚不清楚。
重要的是,这种外周生物钟与SCN节律的不一致(内部昼夜节律紊乱)会破坏生理和昼夜节律,以至于危害健康[31]。大量流行病学研究发现,长期内部昼夜节律紊乱,如夜班工作者不规律的进食时间,将增加代谢疾病发生风险。
3.1 过敏性疾病的昼夜节律性
早在20世纪60年代,已经有多项关于过敏性疾病昼夜节律性的报告[4-5]。过敏性鼻炎和哮喘患者的鼻部和支气管反应性、炎症程度都会在夜间、睡眠中和清晨加重。夜间瘙痒是特异性皮炎(AD)的典型症状,这与皮肤温度、pH和表皮水分损失(TEWL)等昼夜变化相关[5,32]。近期一项基于过敏原引起的嗜碱性粒细胞CD203c表达(嗜碱性粒细胞活化实验)的研究发现,季节性过敏性鼻炎患者表现出每日时相变化[33],虽然尚需要进一步的研究得以证实[34]。过敏症状的节律变化提示,这些变化可能是临床管理患者的实践中的重要考虑因素。
3.2 生物钟导致过敏反应的节律性
过敏临床症状节律性产生的机制仍待研究。然而,新的啮齿类过敏动物模型研究发现,生物钟通过免疫细胞固有生物钟和/或免疫细胞外在生物钟依赖性机制影响过敏反应节律性。
被动皮肤过敏反应(PCA)试验是啮齿类模型IgE/肥大细胞依赖的速发皮肤过敏发应。野生型小鼠PCA反应表现为昼夜节律性,峰值出现在静息期,而谷值出现在活动期[35]。在选择性肥大细胞生物钟突变小鼠中,发应的节律性发生紊乱(图3C和D),提示肥大细胞是PCA反应节律性的主要影响因素[21]。具体来说,肥大细胞生物钟调控FcεRI(Fcer1b)β亚基表达,从而暂时性关闭肥大细胞对IgE的应答[21]。
有趣的是,肾上腺切除小鼠的PCA反应节律性也会消失[35]。正如前所述,糖皮质激素(小鼠的皮质酮)可能作为周期信号,通过SCN在整体水平上同步肥大细胞生物钟来影响节律性。因此,肾上腺切除小鼠PCA反应节律性消失可能由肥大细胞生物钟同步性缺失造成,这种缺失可能是由于皮质酮释放异常或缺失,和随之在整体水平上肥大细胞对IgE应答解偶联所造成[21]。综上所述,这些数据提示PCA反应节律性可能是由糖皮质激素调控中央SCN生物钟和肥大细胞生物钟共同影响的。
刮痕和皮肤屏障功能紊乱(例如TEWL增多)是AD的关键特征,在AD患者、NC/Tnd小鼠和AD模型中均表现为昼夜节律性[5,36]。野生小鼠表皮水通道蛋白3(Aqp3,水分和TEWL的调节因子)的表达为昼夜节律性,生物钟突变小鼠中节律性消失[37]。具体来说,小鼠Aqp3和人AQP3为同源基因,分别在小鼠皮肤和人角质细胞表现出表达的周期波动性,这种波动性受到分子钟调控。因此AQP3、瘙痒相关分子和皮肤屏障功能可能通过皮肤细胞生物钟控制AD病理生理昼夜变化的产生。
遗憾的是,哮喘的昼夜节律性并没能在啮齿动物模型中得到重现,不过在卵清蛋白致过敏性哮喘的模型中,骨髓细胞Bmal1缺陷小鼠相比于健康小鼠哮喘症状更明显[38]。类似的,Bmal1缺陷小鼠由于仙台病毒、流感及引起哮喘的常见病毒诱发的急性病毒性细支气管炎症状加重,气道并有更多的哮喘样改变[39]。这些结果提示骨髓细胞Bmal1可能是哮喘炎症发生的负调控因子。因此肺部BMAL1的周期节律活动可能导致哮喘节律性,而具体机制目前尚不清楚。有趣的是,相比于健康对照,哮喘患者在静息时(夜间)Bmal1表达下降[39]。当Bmal1表达降低时,哮喘患者症状会加重。
除了免疫细胞生物钟以外,上皮细胞生物钟可能同样在肺部炎症节律性变化中发挥作用。LPS引起的小鼠肺部炎症存在昼夜周期变化。支气管上皮细胞Bmal1通过调控上皮细胞Cxcl5(一种强效嗜中性粒细胞趋化因子)的产生来暂时调节炎症[40]。因为肺部对LPS应答决定了哮喘的发生和严重度[41-42],肺上皮细胞生物钟介导对LPS应答的暂时调控同样影响哮喘的节律性。
仅有极少数研究报告了食物过敏和严重过敏反应的昼夜节律性。不过在一项食物过敏的小鼠模型中,在静息期进行抗原激发比在活动期激发能引起更重的过敏性腹泻和体重减轻现象[43]。这与小肠紧密连接分子表达下调和静息期抗原吸收增加有关。此外,被动全身过敏反应(IgE/肥大细胞依赖的全身过敏反应模型)程度和PCA反应一样在野生小鼠中表现为昼夜节律性,而在SCN缺陷小鼠中消失[44]。因此食物抗原的摄入时间可能影响食物过敏症状和全身过敏的严重程度,部分可能原因是由于紧密连接分子表达和肠屏障功能的周期变化引起的。
综上所述,过敏反应的节律性可能通过免疫细胞或局部细胞生物钟调节的病理生理关键分子节律表达,这种节律性受到通过体液和神经信号调节的中央SCN生物钟的影响。重要的是,这表明功能性生物钟紊乱会导致活动期过敏反应抑制丧失(例如PCA反应:图3C和D),提示这种生物钟机制主要是在活动期抑制过敏反应。
3.3 节律紊乱可促进过敏
过敏相关外周生物钟(如肥大细胞生物钟)可能是过敏反应节律性的主要影响因素。因此我们假定环境时间因素(授时因子)周期恒定的情况下,例如正常的昼夜和进食/禁食周期,过敏相关外周生物钟通过体液/神经介导的SCN节律性与过敏反应节律性一致。相应的,任何改变过敏相关外周生物钟活性的基因和环境因子都能影响生物钟调节的基因表达和过敏反应症状的变化。这些包括啮齿动物的生物钟基因改变或SCN机制的紊乱、授时因子不匹配、激素分泌异常、自主神经活性和外周生物钟的直接改变。由于上文中已经讨论生物钟基因改变和SCN机制紊乱的影响,这部分将讨论其他节律紊乱因子对过敏反应的影响。
环境授时因子不匹配(例如,时差或夜班造成的光线环境和进食时间节律性紊乱)能导致中央生物钟、外周生物钟甚至两者连续的周期复位、空运转或整体水平的节律紊乱。这将导致过敏相关细胞外周生物钟周期节律性破坏,但导致这个结果的具体机制尚不明确。
最近研究发现,模拟时差形成的昼夜条件异常会加重病毒诱导的哮喘样炎症[39]。此外,将小鼠关在昼夜为10/10 h周期,而非正常12/12 h昼夜周期的环境中8周,IL-33或化合物48/80介导的肥大细胞反应节律变化将消失(即活动期抑制作用消失),并且在全天周期中炎症反应都加重[45-46]。更有意思的是,昼夜节律异常会破坏肠上皮屏障功能,从而使小鼠更容易食物过敏。轮班工作的护士,其食物过敏发病率与白夜班轮换具有正相关性,提示昼夜节律能影响对食物过敏原的致敏[47]。综上所述,这些研究提示环境授时因子不匹配能加重过敏反应,甚至增加过敏性疾病易感性。
激素或自主神经活动使大量外周生物钟与SCN节律同步。因此激素和自主神经活动异常将导致外周生物钟不同步甚至整体水平上破坏外周生物钟节律性,从而影响过敏反应。例如,长期压力与皮质醇水平异常有关[48]。受到长期束缚应激的小鼠确实表现为肥大细胞PER2表达节律性紊乱,伴随肥大细胞活化的周期节律变化消失[46]。此外,我们可以推测接受长效糖皮质激素治疗的过敏性患者会出现过敏反应节律紊乱,因为糖皮质激素生理节律紊乱对外周生物钟具有极大影响,包括肺和鼻粘膜[49-50]。
炎症和组织损伤因素可以直接影响外周生物钟的活性。例如,正常肺组织生物钟基因的时相、周期和幅度,以及CCG的表达在暴露于香烟、病毒或细菌感染、炎症介质(例如TNF-α和LPS)的条件下均会发生改变[51]。过敏性鼻炎患者进行鼻激发试验时,在迟发相中Clock、Bmal1和Th2细胞因子上调[52]。外周细胞这些生物钟基因表达的改变会破坏或改变过敏反应的节律性。
有趣的是,对LPS处理的小鼠肺进行全基因组昼夜节律表达分析,发现这些小鼠中出现了新的细胞和分子昼夜节律[53]。例如,在内毒素血症小鼠肺中发现,一种炎症组分Nlrp3表达节律性,而正常肺中没有。表明外周生物钟具有可塑性,将改变昼夜节律基因转录组作为自适过程,从而根据环境变化在组织和器官水平上优化功能。
3.4 睡眠障碍可通过节律紊乱影响过敏
睡眠是从蠕虫和水母到鸟和哺乳动物在进化过程中的一种保守行为[54]。越来越多关于果蝇、斑马鱼、老鼠和人类的数据表明,中央和外围生物钟使用不同的机制来调节睡眠的不同方面[54]。由于观察到小鼠和人生物钟基因突变会改变睡眠节律,或许是最有效地证明了生物钟是睡眠和清醒的重要调节因素[55-56]。
过敏性疾病患者经常出现睡眠障碍并影响生存质量。总体而言,过敏症状的严重程度与睡眠障碍关系紧密[4-5,13,32,57]。因此,过敏性疾病患者与疾病严重程度相关的夜间症状频率增加可能是由于睡眠障碍所致。不过目前对过敏性疾病患者睡眠障碍的病理生理学知之甚少[32]。
绝大多数过敏性疾病患者的睡眠障碍与生理昼夜节律改变有关,包括丧失了褪黑素的分泌节律[32,57]。这表明睡眠障碍本身可以引起过敏性疾病患者正常生物钟的改变。生物钟与睡眠的关系的确是双向的。剥夺睡眠会改变核心生物钟基因的表达和DNA结合活性[58-61]。因此可能存在一种恶性循环:夜间过敏症状引起睡眠障碍,睡眠障碍反过来影响中央SCN生物钟活动,导致正常昼夜节律发生改变。最终,通过SCN调控的神经或激素通路调节导致过敏相关外周生物钟节律紊乱,从而影响过敏反应。这种情况下,通过干预修复正常生物钟活动(例如,褪黑素治疗;见下文)可能对过敏性疾病患者睡眠障碍有益。
然而,需要强调的是目前很难断定睡眠障碍是通过生物钟节律紊乱来影响过敏,因为在不涉及生物钟的条件下,睡眠质量就能影响多种信号通路,这些通路涉及对代谢、激素、神经和免疫功能的调节。同时,生物钟和睡眠互相影响也是一个先有鸡还是先有蛋的问题。
3.5 调节生物钟可能被用于治疗过敏
过敏性疾病是最适合接受时辰疗法(即在症状的特定周期同步用药)。例如,在晚上服用抗组胺药美喹他嗪相比于早晨能更好的改善过敏性鼻炎患者症状[62]。
因为生物钟影响过敏反应,所以合成能够调节生物钟基因表达的周期、时相和幅度的化合物可能是新的抗过敏药研发策略。迄今为止,调节生物钟酪蛋白激酶(CK)1δ/ε和REV-ERBα的两种药物广泛应用于生物节律紊乱志愿者研究,包括飞行时差、睡眠障碍、代谢性疾病、炎症和癌症[63-66]。
CK1δ/ε在分子生物钟的翻译后修饰中起重要作用。CK1δ/ε使PER蛋白磷酸化,导致泛素化依赖的蛋白降解并决定细胞生物钟的固有周期(图1)。因此CK1δ/ε的抑制减缓了PER蛋白的转化,减缓了周期变化和延长了昼夜节律周期[64]。
在肥大细胞中CLOCK直接调节FCERIB的表达节律性,并且在静息期促进细胞对IgE的应答[21]。相应的,PF-670432(CK1δ/ε激酶抑制剂,图1)在体外(图3B) 和体内通过增加肥大细胞PER2(一种CLOCK活性负向调节剂)表达来下调IgE介导的肥大细胞活化[22]。
REV-ERBα是调节基因表达、代谢和炎症应答相关基因的转录抑制物。野生型小鼠血清IL-6对腹腔注射LPS激发的应答具有时间差异,尽管Rev-erba缺陷小鼠的细胞仍然保持着昼夜节律性,但是小鼠和培养的巨噬细胞对LPS应答的节律性已经消失[65]。此外, REV-ERBα合成配体抑制人巨噬细胞LPS诱导的IL-6产生。因此REV-ERBα可能将生物钟与固有免疫功能联系在一起,合成的REV-ERBα配体可能在对全身生物钟活性影响很小的情况下,有效地治疗炎性疾病,包括过敏。
褪黑素是由松果体以昼夜节律方式分泌的一种激素,在午夜到达峰值[67]。褪黑素通过对中央SCN生物钟的直接时相改变和降低核心体温来促进睡眠,核心体温降低可以诱导睡眠[67]。此外,褪黑素还具有免疫调节和抗氧化能力[32]。例如,在NC/Nga小鼠中褪黑素通过抑制CD4+T细胞从而抑制AD样皮炎的发生[68]。基于这些特性,且不良反应小,适合作为同时治疗过敏性疾病患者睡眠障碍和炎症的候选药物。在一项随机临床研究中,褪黑素确实促进了AD儿童的入睡并减轻了疾病症状[69]。
糖皮质激素作为外周生物钟的强效同步剂,是生物钟的调节剂[70]。因此,合成糖皮质激素对过敏性疾病的影响部分是由于外周生物钟时相变化引起的。实际上,只有当地塞米松上调肥大细胞和嗜碱性粒细胞PER2水平(类似PF-670432)时,地塞米松才能在体内和体外抑制IgE介导的脱颗粒[22]。
有趣的是,生物钟突变肥大细胞和嗜碱性粒细胞中,肥大细胞并不能发挥如此作用,提示糖皮质激素发挥作用需要功能性生物钟存在[22]。实际上,生物钟和糖皮质激素是相互作用的。在糖皮质激素信号传递过程中需要几种生物钟蛋白(如PER2或CRY)[71-72]。例如,CRY可以与糖皮质激素受体相互作用,小鼠成纤维细胞Cry缺陷导致大量基因表达下降和地塞米松诱导的基因成倍增加,提示Cry拮抗糖皮质激素受体活性并发挥抑制作用[72]。相应的,合成糖皮质激素治疗的影响(或不良反应)根据靶向细胞或组织生物钟表现出昼夜变化。未来的一个研究方向是规律或不规律的生活方式是否影响类固醇对过敏性疾病治疗的效果和不良反应。
值得注意的是目前大多用于过敏性疾病的药物都可能改变生物钟节律,例如糖皮质激素、β2受体激动剂、磷酸二酯酶抑制剂(活化环AMP信号通路,如氨茶碱)和组胺H1受体拮抗剂[22,73-74]。这同样预示着生物钟与过敏的密切关系。然而,这些药物对过敏性患者生物钟的实际生理影响尚不清楚。不过,这可能是评价生物钟对过敏性疾病患者重要性的混杂因素。
4 未来研究方向
关于过敏的昼夜节律性调节还有很多问题尚待解决[11]。以下是此领域的3个重要问题。
第一,生物钟与过敏反应联系的具体机制尚不完全清楚。过敏相关CCGs(例如,Fcerib[21]、St2[45]、OCT-3[46]、AQP3[37]和紧密连接分子[43,75])确实是连接生物钟和过敏的重要基因。然而,生物钟是一个调节神经元活动、新陈代谢和免疫细胞功能的多模式系统[1-3]。目前认为神经元活性和新陈代谢对免疫影响极大[76-77]。因此,重要的是要确定生物钟在多大程度上通过调节这两个因素影响过敏反应。
第二,目前对于因环境光线周期异常或进食时间不规律导致人类生物钟或节律紊乱,影响疾病易感性、病因、维持和进展的流行病学和临床研究甚少。虽然由于生物钟功能与过敏之间相互影响,这类研究可能很难证明生物钟与过敏性疾病的因果联系,但是这些研究显然是必需的。
迄今为止,就我们所知,只有一项这样的相关性研究:斋月禁食对穆斯林哮喘患者不同特征的影响[78]。研究显示斋月禁食1月对哮喘没有不良影响,不过可能对于哮喘严重程度有一些有益影响,降低了血清C反应蛋白浓度和喘息。这项发现可以与最近一项研究相联系,小鼠血清IL-5水平和血嗜酸性粒细胞计数呈昼夜节律性,而16 h禁食后小鼠血清IL-5和血嗜酸性粒细胞计数下降[79]。
第三,即使在健康人,鼻黏膜、肺、肠道和皮肤等局部生理特征也表现出节律性变化。因此,一个关键问题是什么导致过敏性疾病患者局部生理特征节律性强于健康对照(例如,对气道中乙酰胆碱的敏感程度)。换句话说,过敏性疾病是否为生物钟紊乱性疾病?为了回答这个问题,对过敏性疾病患者病灶生物钟基因和CCG表达的程度和这些基因表达是怎样变化的研究尤为重要。考虑到大多数过敏症状是由于靶组织/器官的神经系统改变所致[80],研究在过敏性疾病病灶中涉及神经元活动的CCG表达动力学可能是有意义的。总之,目前对于过敏性疾病病灶分子水平昼夜节律调控知之甚少。
结语
生物钟活性涉及过敏反应的调节,过敏并不仅仅只是担当昼夜计时作用。相应的,昼夜节律紊乱将从时间、强度和易感性方面严重影响过敏反应。因此研究周期节律如何影响过敏反应将成为变态反应学中重要的分支,可以称其为“时辰变态反应学”。
发达国家的大多数人居住在与其内源昼夜节律不同步的日常活动的社会中,包括睡觉、工作、吃饭[31]。由于在夜间会接受大量SCN生物钟敏感的蓝光,对于轮班工作者、常跨时区旅行者和大量智能手机和电脑使用者尤为明显。因此临床医生要多关注患者个人生活习惯细节,例如何时睡觉和起床,每天何时进食和一日几餐和心理压力,因为这些因素可以通过对生物节律的调节,改变症状和实验室检测结果(例如,嗜碱性粒细胞活化CD203c的表达[33]或血清IL-5水平和血嗜酸性粒细胞数量[79]),并且选择过敏性疾病患者最佳的治疗时间(图4)[81-82]。通过这样做,临床医生可以根据患者自身状态提出生活干预方案以更好地控制过敏症状。

图 4 多种环境变化可以通过调整生物钟影响过敏反应
生物钟受多种环境因素变化影响,包括昼夜周期,进食时间、社交(例如压力)和睡眠障碍,这些因素可能通过调节昼夜节律从时相、强度和易感性方面改变过敏反应,并且影响过敏性疾病患者症状、实验室检测结果和最佳的治疗时间。图示为花粉症患者。除了此处显示的环境变化外,近期研究表明肠道微生物和年龄均影响昼夜节律[81-82]
例如,我们假设过敏性鼻炎患者有不规律的饮食习惯,肥大细胞生物钟可能出现昼夜节律紊乱,导致全天持续性IgE/肥大细胞介导的炎症发生。给这类患者简单的规律用餐建议,就可能通过重置正常肥大细胞生物钟节律而减轻活动期(白天)症状,从而减少抗过敏药物使用剂量。
智能手机和新软件应用的实用性使客观地和长期监测自由个体睡眠、饮食和锻炼习惯成为可能[83],并能帮助临床医生发现合适的生活方式干预控制过敏。生物钟影响过敏的发现提醒我们管理过敏患者生活的重要性。
已知
·过敏性疾病症状、实验室检测结果和治疗应答具有显著的昼夜变化。
·啮齿类研究揭示,节律性过敏反应的基础是称为生物钟的内部时间管理系统。
·生物钟节律紊乱不仅会破坏过敏反应患者的昼夜节律性,还会加重器官的过敏反应及易感性。
未知
·昼夜节律活性紊乱如何加重器官的过敏发应及易感性。
·昼夜节律紊乱对过敏性疾病的影响程度有多大。
·是什么导致健康人群和过敏性疾病患者生物钟控制的局部生理差异。
参考文献请见原文:
J Allergy Clin Immunol, 2018,142:1021-1031

