自体吞噬在肌萎缩侧索硬化症中的研究进展
贾 旭,罗 果
(遵义医学院 医学与生物学研究中心,贵州 遵义 563099)
肌萎缩侧索硬化症(Amyotrophic lateral sclerosis,ALS)又称渐冻症,是一种累及神经[1]、肌肉[2]、骨骼[3]、肠道[4]等多系统的渐进性致命性疾病,其主要病理特征表现为在运动神经元和骨骼肌细胞中出现线粒体病变和错误折叠蛋白的累积[2]。95%的病人通常会在发病5年之内死亡,病程进展迅速。ALS患者中多数为散发性(Sporadic Amyotrophic Lateral Sclerosis,SALS),10%~15%为家族性(Familial Amyotrophic Lateral Sclerosis,FALS)[5]。ALS是多因素多系统复杂的疾病,早期诊断困难,发病机制复杂,包括:氧化应激、谷氨酸盐兴奋毒性、线粒体损伤、疾病相关蛋白聚集、轴突运输异常、RNA代谢异常等[6]。自体吞噬(Autophagy)是生物体内清除功能异常的细胞器、错误折叠的蛋白质、被氧化的脂类等有害大分子物质的重要途径。研究表明自噬会从多方面影响ALS的发生和发展,通过调控自噬来清除错误蛋白质是ALS研究领域的热点。本文将对ALS相关的主要突变蛋白以及自噬在ALS中的作用和机制进行综述。
1 与ALS相关的主要突变蛋白研究
与其他神经退行性疾病类似,ALS的关键发病机制是疾病相关蛋白质在运动神经元及其周围细胞中异常表达,以及形成错位蛋白与其相互作用物的细胞质聚集体,表明ALS疾病进程中蛋白质调节失衡[7]。目前研究证实与发病相关的主要蛋白有下列几种。
1.1 铜-锌超氧化物歧化酶及其相关蛋白 超氧化物歧化酶(superoxide dismutase,SOD)是一种抗氧化酶,能催化O2转化为 H2O2,维持细胞内活性氧内稳态的平衡。Rosen等[8]首次报道超氧化物歧化酶1(SOD1)基因突变与FALS相关。迄今为止,超过100种SOD1基因的涉及5个全部外显子的不同致病性突变已被鉴定,为大多数FALS的致病原因[9]。突变SOD1蛋白的错误折叠和聚集与毒性机制紧密相关,其毒性可由与锌的结合力下降、Cu/Zn SOD蛋白稳定性下降引发,导致线粒体空泡化和膨胀,引发运动神经元的毒性反应,产生过量的自由基,继而经过毒性机制诱导神经变性[10-11]。对运动神经元细胞系NSC34和小鼠运动神经元的原代培养物的功能研究显示,SOD1突变p.E121G诱导了SOD1和泛素阳性的聚集,以及降低细胞存活率[12]。因此,抑制突变SOD1蛋白导致的毒性反应有望成为治疗ALS的可行策略。
1.2 TAR DNA 结合蛋白-43( TDP-43) TDP-43蛋白被鉴定为泛素化神经元细胞质内含物的主要成分,其沉积于额颞叶痴呆(FTD)的皮层神经元和ALS中的脊髓运动神经元[13], 43kDa的DNA结合蛋白(TDP-43)作为交换反应的异质核核蛋白,是额颞叶变性(FTLD)和肌萎缩侧索硬化/运动神经元病(ALS / MND)中的主要病理蛋白。在20%~50%的散发性阿尔茨海默病例中合并发现TDP-43异常[14]。
1.3 肉瘤中融合/脂肪肉瘤转位蛋白( FUS/TLS) 肉瘤中融合蛋白(FUS)是一种丰富的核RNA结合蛋白,也称为脂肪肉瘤转位蛋白(TLS),FUS影响多个RNA生物合成水平。FUS将RNA聚合酶II(RNA Pol II)直接结合并募集至DNA,并抑制或重定向多种转录活化因子的活性[15]。FUS的突变是ALS的原因之一[16],占FALS的5%和SALS的1%[15]。
2 自体吞噬
2.1 自体吞噬的分类及过程 细胞中蛋白质降解途径主要为:泛素蛋白酶体系统(UPS)和自噬-溶酶体途径[7],相比UPS,自噬是一种更广泛的降解途径。越来越多的证据证明自噬在个体的生存和疾病的发生发展过程中扮演十分重要的角色。自噬根据发生过程分为3类:大自噬(Macroautophagy)、微自噬(Microautophagy)和分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA)。Macroautophagy即研究最广泛的自噬; Microautophagy是指溶酶体主动、直接吞噬胞浆成分的一种方式; CMA指一些分子伴侣如 hsp70,能帮助未折叠蛋白转位入溶酶体而形成自噬。自噬的形成包括4个阶段:自噬泡(phagophore)的发生、自噬体(autophagosome)的形成、自噬的运输融合(fusion)、自噬的降解(degradation)[7,17],如图1[18]所示。
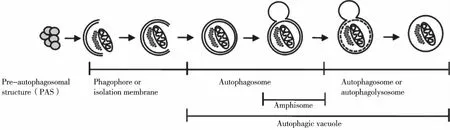
图1 自噬的过程[18]
2.2 自噬形成的分子机制 目前发现的自噬相关蛋白质有30多种,自噬相关蛋白质相互结合,形成自噬复合体。自噬受mTOR依赖性和非依赖性途径调控[19]。mTOR 作为一个丝-苏氨酸蛋白激酶,能够感知细胞内ATP、生长因子、胰岛素的水平,进而感受细胞内营养和能量的变化,参与组成mTORC1 和mTORC2,并可以受上游多种不同信号通路的调控,如经典的 PI3K、MAPK等通路,影响自噬的发生[20]。mTOR的活化和抑制主要受到TSC1/TSC2 的调控[21]。而mTOR非依赖性通路则主要包括 RAS-MAPK、Ca-AMPK、p53、PTEN以及内质网应激等[22]。雷帕霉素(Rapamycin)作为mTORC依赖性调控剂能激活自体吞噬反应,减少错误蛋白的累积,并且减轻神经退行性疾病的症状,例如帕金森病、阿尔茨海默病、霍奇金病[19,23-26]。
3 自噬在ALS疾病中的研究
3.1 自噬对ALS运动神经元的影响 在对ALS运动神经元中关于mTOR非依赖性调节剂的研究中,Zhang等[27]发现非依赖mTOR的自噬增强剂海藻糖减少了SOD1和SQSTM1 / p62的聚集,降低泛素化蛋白的积累,并改善SOD1G93A小鼠运动神经元的自噬流,自噬保护了运动神经元并延长运动神经元的存活,改善ALS小鼠模型中的自噬通量缺陷,从而减缓疾病的发展。Barmada等[28]研究发现在ALS运动神经元模型中,诱导自噬可直接改善TDP-43蛋白的聚集,减轻神经变性。提示自噬在ALS疾病模型运动神经元中的错误蛋白清除方面发挥了积极作用。
另有研究表明,自噬在ALS运动神经元模型中起到了加速疾病发展的反作用,Zhang等[29]研究显示雷帕霉素诱导了自噬泡的进一步积累,却未能降低ALS小鼠中突变SOD1聚集的水平,加快了运动神经元丢失和病程发展。Bhattacharya等[30]的研究表明雷帕霉素对ALS的SOD1 H46R / H48Q小鼠模型的疾病发作和存活无益。Rudnick 等[31]通过对Atg7 cKO小鼠与SOD1G93A小鼠杂交模型研究发现抑制自噬加速了疾病早期运动神经元细胞死亡和肌肉的萎缩,但是却通过减少神经胶质炎症延长了杂交小鼠模型的寿命。另一种调节剂Rilmenidine强烈诱导体内自噬,降低可溶性突变的SOD1水平,但加重了SOD1G93A小鼠的运动神经元变性和疾病发展[32],并造成了线粒体的损伤[32-33]。虽然增加的自噬可能是细胞对自身损伤的调控反应,以清除错误蛋白和损伤的线粒体,但是失控的自噬可能会引起运动神经元内蛋白质或者细胞器的过度消耗,从而在 ALS 疾病进程中影响细胞稳态和加速细胞死亡。
3.2 自噬对ALS骨骼肌的影响 与ALS运动神经元模型中自噬的研究相似,自噬在ALS肌肉模型研究方面也存在“双刃剑”的作用。Oliván S等[34]在SOD1G93A小鼠疾病模型中发现骨骼肌中存在自噬清除错误蛋白,但并未发现细胞凋亡的激活。Xiao等[35]发现SOD1G93A小鼠肌肉在疾病进展中出现自噬流的显着减少,骨骼肌细胞的保护性自噬途径被抑制。Ching等[36]研究也发现自噬的增加损害了肌肉正常功能。现有研究提示通过调节自噬可能改善ALS进程中骨骼肌萎缩的状况。
3.3 自噬对ALS骨骼系统的影响 ALS患者的骨折发生率很高,表明患者可能存在骨量缺失。骨骼肌和骨骼之间关系密切,在ALS进程中严重的肌肉退化可能对骨功能产生重要影响,并且骨稳态的失衡也可能在疾病进程中促进神经肌肉退化[37]。Zhu 等[3]研究发现ALS的G93A突变小鼠模型与WT小鼠相比,G93A小鼠骨小梁和皮质骨量显著减少,且出现肌肉萎缩的G93A小鼠中破骨细胞的形成和骨吸收显着增强,该研究首次证明ALS会导致骨重建异常。另有研究发现SOD1G93A突变蛋白在线粒体内的累积直接导致培养的MLO-Y4骨细胞的线粒体动力学功能障碍[38]。自噬在骨骼系统中的研究表明自噬对于维持骨稳态及成骨细胞矿化方面起到一定作用[39-40],提示通过调控自噬清除骨细胞中累积的突变蛋白、改善骨细胞中的线粒体功能及骨稳态可能会成为ALS治疗的新途径。
3.4 自噬对ALS肠道菌群的影响 哺乳动物肠道含有大量微生物,这些微生物对维持肠上皮稳态和健康至关重要。Wu 等[4]通过检测SOD1G93A小鼠模型的肠道发现,肠道的紧密连接结构受损并且通透性增加,炎性细胞因子水平升高,且肠道中宿主先天免疫反应和维持肠道微生物中发挥关键作用的Paneth细胞数量增加,首次证明了肠稳态失衡与ALS疾病进展的关系。Zhang 等[41]研究发现经丁酸盐治疗的G93A小鼠,其肠道微生物稳态恢复,肠道完整性得到改善,小鼠生存期延长,且在ALS肠上皮细胞模型中,丁酸盐能使SOD1突变蛋白的聚集减少,减缓疾病进程。自噬在先天免疫系统中对不同的肠道微生物起着重要作用[42]。丁酸盐能够促进肠道的自噬,在肝癌[43]、结肠癌[44]等可促进自噬从而抑制结肠、直肠癌细胞增殖,并导致癌细胞凋亡。目前自噬是否直接参与ALS肠道菌群调节的研究较少,其具体的关系和机制有待进一步研究。
4 展望
自噬是一把“双刃剑”,是细胞对自身损伤的调控反应,以清除错误蛋白和损伤的细胞器,但是过度的自噬,可能会引起细胞内蛋白质和细胞器的过度消耗,从而在ALS疾病进程中影响细胞稳态和加速细胞死亡[5]。进一步深入研究自噬在ALS疾病各系统中的机制及在疾病发展各阶段中的作用,将对ALS及其他神经退行性疾病的治疗提供更好的思路和依据。

