辛伐他汀对2型糖尿病认知功能障碍的保护作用及其机制研究
张禾伟,房辉,孙雪玲,张雅中,田金莉
本文意义:
本文通过行为学检测及组织学观察,确定2型糖尿病大鼠认知功能障碍的存在,应用Western blotting证实雷帕霉素靶蛋白(mTOR)/p70核糖体蛋白S6激酶(p70S6K)信号通路的激活和氧化应激相关蛋白的增多,并通过给予辛伐他汀改善2型糖尿病大鼠认知功能,抑制mTOR/p70S6K信号通路和氧化应激相关蛋白表达,为2型糖尿病认知损伤发生机制的研究提供新思路,为辛伐他汀在2型糖尿病患者中枢神经系统并发症中的临床应用提供理论依据。
糖尿病是目前患病率较高的慢性代谢性疾病之一。根据国际糖尿病联盟(IDF)统计,预计到2030年,中国糖尿病人群将增加至1.3亿[1],其中大部分为2型糖尿病(T2DM)患者。T2DM除了可导致周围神经病变外,目前有研究表明T2DM可能对中枢神经系统(CNS)功能产生不利影响,其中认知功能障碍是最常见的症状[2]。MIJNHOUT等[3]提出了“糖尿病相关认知衰退(DACD)”一个新的术语,但糖尿病认知功能障碍的发病机制目前尚未十分明确,改善DACD的药物也亟待深入研究。有研究表明,辛伐他汀具有改善阿尔茨海默病(AD)患者认知功能的作用,潜在作用机制涉及多个方面[4-6]。认知功能障碍包括学习记忆能力、注意力、执行力下降,处理速度减慢和语言流畅度下降[7]。目前关于辛伐他汀对T2DM患者认知功能的作用及潜在机制的研究尚不多见,本实验通过观察辛伐他汀对T2DM大鼠学习记忆能力的影响,探讨哺乳动物雷帕霉素靶蛋白(mTOR)/p70核糖体蛋白S6激酶(p70S6K)信号通路在辛伐他汀改善认知功能中的作用,旨在为临床T2DM认知功能障碍的诊断和治疗寻找新思路。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠120只,8周龄,体质量(260±10)g,购自北京维通利华实验动物公司〔许可证号:SYXK(京)2017-0022〕,温度21~26 ℃,相对湿度40%~70%,饲养2周适应环境后用于实验。本研究经唐山市工人医院伦理委员会批准。
1.2 实验药品与试剂 链脲佐菌素(STZ)购自Sigma公司,辛伐他汀片(40 mg/片)购自美国默沙东公司,兔抗大鼠mTOR多克隆抗体(ab2732)、兔抗大鼠p70S6K多克隆抗体(ab32529)、兔抗大鼠tau多克隆抗体(ab32057)、兔抗大鼠丙二醛(MDA)多克隆抗体(ab194225)、兔抗大鼠谷胱甘肽(GSH)多克隆抗体(ab19534)、兔抗大鼠p-mTOR多克隆抗体(ab177734)、兔抗大鼠p-p70S6K单克隆抗体(ab59208)、兔抗大鼠p-tau多克隆抗体(ab109390)均购自美国Abcam公司,辣根过氧化物酶(HRP)标记二抗(ZB-2306)购自北京中杉金桥生物技术有限公司,增强化学发光试剂(ECL)(PP2403)购自北京艾德莱生物科技有限公司,苏木素、伊红染液、Western转膜液、BCA蛋白浓度测定试剂盒、十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)凝胶配制试剂盒和SDS-PAGE电泳液均购自碧云天生物技术研究所。
1.3 仪器与设备 Morris水迷宫(上海欣软科技有限公司),FluorChen 5500凝胶成像分析系统(美国Thermo公司),BX-60型显微镜(日本Olympus公司),显微照相机(日本Olympus公司),Leica1512型石蜡切片机(德国Leitz公司),病理组织包埋机(德国LEICA公司),病理组织包埋冷冻台(德国LEICA公司),电泳转移槽(北京六一仪器厂),S-1000脱色摇床(其林贝尔仪器制造有限公司),SZ-93型自动双重纯水蒸馏器(上海亚荣生化仪器厂),AL204电子分析天平〔梅特勒-托利多仪器(上海)有限公司〕,TGL-16G-A型低温离心机(上海安亭科学仪器厂)。
1.4 方法
1.4.1 模型制备 于2016年9月采用随机数字表法将120只健康雄性SD大鼠分为对照组(40只)、糖尿病组(40只)和辛伐他汀组(40只),各组自由进食水,糖尿病组和辛伐他汀组制备T2DM大鼠模型,高脂饲料饲养8周后,将STZ(40 mg/kg)溶解于0.1 mol/L枸橼酸-枸橼酸钠缓冲液中,腹腔注射。72 h后,抽取鼠尾静脉血,采用罗氏血糖仪测定血糖。T2DM大鼠模型评价标准:血糖≥16.7 mmol/L为T2DM大鼠模型造模成功。对照组腹腔注射等体积枸橼酸-枸橼酸钠缓冲液。糖尿病组、辛伐他汀组分别造模成功38、37只,造模成功后各组大鼠标准饲料饲养14周。
1.4.2 干预方法 造模成功后,将辛伐他汀溶于2 ml 0.9%氯化钠溶液,辛伐他汀组大鼠采用辛伐他汀灌胃(20 mg·kg-1·d-1),对照组和糖尿病组大鼠灌胃等体积0.9%氯化钠溶液。干预后各组大鼠标准饲料饲养14周。
1.4.3 Morris水迷宫实验 大鼠进行Morris水迷宫实验,检测其空间学习和记忆能力。在直径为1.2 m的水池的南西(SW)象限内设置一个平台,作为目标象限,直径为10 cm,位于水面下1 cm。实验室的物品和人员位置在实验期间固定不变,作为空间参照物。第1天进行定位航行实验(place navigation),大鼠第1、4次从目标象限对侧的北东(NE)象限面朝池壁入水,第2、3次采用随机数表法选择象限(遇奇数时入东南象限,遇偶数时入西北象限)面朝池壁入水,测试4次/d,休息时间为10 min/次,监测时间为100 s,持续4 d,记录大鼠从入水到登岛成功的时间,即逃避潜伏期,大鼠在平台上停留>2 s判为登岛成功,若大鼠100 s内未成功则记为100 s。训练后,用干毛巾将大鼠擦干,以防止低体温造成的应激。第5天进行空间搜索实验,拆除平台,大鼠在NE象限面朝池壁下水,观察并记录120 s内大鼠在SW象限内的停留时间,评估大鼠的记忆能力,停留时间越长,表示记忆能力越强。
1.4.4 超微病理检测 大鼠进行Morris水迷宫实验后,采用电子分析天平称量大鼠体质量,通过腹腔注射10%水合氯醛(4 ml/kg)深度麻醉大鼠(角膜反射消失),沿胸骨旁线剪开胸腹腔,充分暴露心脏、肝脏及主动脉,针头经左心室穿刺入升主动脉,剪开右心耳,以0.9%氯化钠溶液快速心脏灌注,至右心耳流出清亮液体,肝脏变白后,采用约250 ml的4%多聚甲醛溶液(pH为7.4)灌注至肢体僵硬,灌注速度先快后慢。待肢体充分固定后取两侧海马组织,一侧海马组织放入液氮速冻,-80 ℃保存;另一侧海马组织放入4%多聚甲醛溶液中,4 ℃固定24 h,将海马组织脱水,石蜡包埋,以2 μm连续切片,常规烤片,二甲苯脱蜡,梯度乙醇脱水,苏木素、伊红染色,常规梯度乙醇脱水,中性树胶封固,于显微镜下观察各组大鼠海马结构的改变。
1.4.5 Western blotting 取出备用的海马组织,用预冷的眼科剪剪碎组织,冰浴中用匀浆器将组织匀浆,加入裂解液(每20 mg组织加入120 μl裂解液),4 ℃低温离心机,12 000 r/min离心15 min(离心半径为10 cm),取上清液,按每泳道50 μg总蛋白上样进行SDS-PAGE电泳,电泳转移槽调为稳压状态,电压为80 V,使样品通过浓缩胶;当溴酚蓝入分离胶后,将电压调至120 V,继续电泳,至溴酚蓝达分离胶底部结束电泳。分离后转膜,浸入封闭液,室温孵育1.5 h。分别加入兔抗大鼠mTOR多克隆抗体(ab2732)(1∶1 000)、兔抗大鼠p70S6K多克隆抗体(ab32529)(1∶1 000)、兔抗大鼠tau多克隆抗体(ab32057)(1∶1 000)、兔抗大鼠MDA多克隆抗体(ab194225)(1∶1 000)、兔抗大鼠GSH多克隆抗体(ab19534)(1∶1 000)、兔抗大鼠p-mTOR多克隆抗体(ab177734)(1∶1 000)、兔抗大鼠p-p70S6K单克隆抗体(ab59208)(1∶1 000)、兔抗大鼠p-tau多克隆抗体(ab109390)(1∶1 000),4 ℃反应过夜,再加入HRP标记二抗(ZB-2306)工作液,室温避光缓慢摇90 min,ECL显色,曝光成像,重复3次。将实验结果用扫描仪进行扫描,在同一条件下,以β-actin为内参基因,采用ImageJ 1.41医学图像分析系统测定条带平均光密度(OD)值,进行比较。
1.5 统计学方法 采用SPSS 20.0软件进行统计学分析。计量资料以(±s)表示,多组间不同时间比较采用重复测量方差分析,同组不同时间及多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 3组大鼠空腹血糖、体质量比较,差异均有统计学意义(P<0.01);其中,糖尿病组和辛伐他汀组大鼠空腹血糖高于对照组,体质量低于对照组,差异均有统计学意义(P<0.01,见表1)。对照组大鼠的精神状态较好,呼吸节律平稳,毛色发亮,反应灵敏,动作灵活,摄食摄水正常;糖尿病组大鼠精神萎靡,行动迟缓、嗜睡,皮毛枯黄无光泽,少数被毛脱落,饮水量增加,偶有大便干结;辛伐他汀组大鼠较糖尿病组,精神良好,体能恢复,皮毛少有枯黄,饮水量减少。
2.2 Morris水迷宫实验结果 对照组不同时间的逃避潜伏期比较,差异有统计学意义(F=2 487.91,P<0.01),其中,对照组第1天的逃避潜伏期长于第2、3、4、5天,第2天的逃避潜伏期长于第3、4、5天,第3天的逃避潜伏期长于第4、5天,第4天的逃避潜伏期长于第5天,差异均有统计学意义(P<0.05)。处理方法与时间对逃避潜伏期存在交互作用(P<0.01);干预方法、时间对逃避潜伏期的影响,主效果均显著(P<0.01)。其中,糖尿病组和辛伐他汀组第2、3、4、5天的逃避潜伏期长于对照组,差异均有统计学意义(P<0.05);辛伐他汀组第2、3、4、5天的逃避潜伏期短于糖尿病组,差异均有统计学意义(P<0.05,见表2)。
2.3 海马组织病理观察结果 显微镜观察显示,对照组海马神经元细胞结构完整,形态正常,无明显病理学改变,细胞膜结构完整、胞核完整、胞质丰富;糖尿病组海马神经元细胞形态不规则,排列紊乱、数量显著减少,细胞膜失去原有完整结构,核固缩,核仁部分消失;辛伐他汀组海马神经元细胞结构大致正常,数量略减少,少数细胞膜失去完整结构,胞核完整(见图1)。
2.4 mTOR/p70S6K信号通路蛋白表达水平 3组的p-mTOR/mTOR、p-p70S6K/p70S6K、p-tau/t-tau比较,差异均有统计学意义(P<0.01);其中,糖尿病组和辛伐他汀组的p-mTOR/mTOR、p-p70S6K/p70S6K、p-tau/t-tau高于对照组,差异均有统计学意义(P<0.01);辛伐他汀组的p-mTOR/mTOR、p-p70S6K/p70S6K、p-tau/t-tau低于糖尿病组,差异均有统计学意义(P<0.01,见表3、图2)。
2.5 氧化应激相关蛋白表达水平 3组的MDA/β-actin、GSH/β-actin比较,差异均有统计学意义(P<0.01);其中,糖尿病组和辛伐他汀组的MDA/β-actin、GSH/β-actin高于对照组,差异均有统计学意义(P<0.01);辛伐他汀组的MDA/β-actin、GSH/β-actin低于糖尿病组,差异均有统计学意义(P<0.01,见表4、图3)。
3 讨论
糖尿病是世界上最常见的代谢性疾病之一,由于其患病率日益增加,已经成为全球严重的公共卫生问题[8]。据估计,截至2035年,全球219个国家的糖尿病患者将达到381.8万人[9]。越来越多的证据表明T2DM与认知功能障碍和痴呆相关[10-11]。许多流行病学研究已经证明,T2DM患者发展为AD的风险明显增高[12-13]。T2DM与AD的发生密切相关,胰岛素信号传导障碍、糖基化终末产物(AGEs)的增加以及氧化应激水平的增强与AD的发生发展相关[14]。另外,以MDA和GSH为代表的氧化应激相关蛋白,也与糖尿病所致认知功能障碍有关[15]。高血糖能够通过多条途径影响认知功能,如mTOR/p70S6K信号通路、Akt/GSK3β信号通路和胰岛素降解途径,从而影响研究对象认知功能[16-17]。目前临床上还没有针对T2DM认知功能障碍的药物。他汀类药物作为经典的降低胆固醇、低密度脂蛋白和极低密度脂蛋白的药物,已被证实具有中枢神经系统保护作用[18]。其中辛伐他汀更是具有抗炎、免疫调节和改善认知功能等多重获益[19],不仅能够通过激活相关通路,抑制海马细胞凋亡[20],而且能够改善细胞氧化应激水平[21],增强空间定位和学习记忆能力。这种神经保护作用已经在多种动物模型中得到证实[22-23],而辛伐他汀在T2DM认知功能障碍中的作用及潜在机制尚未被深入研究。
表1 3组大鼠空腹血糖和体质量比较(±s)Table 1 Comparison of fasting blood glucose and body mass among the three groups of rats
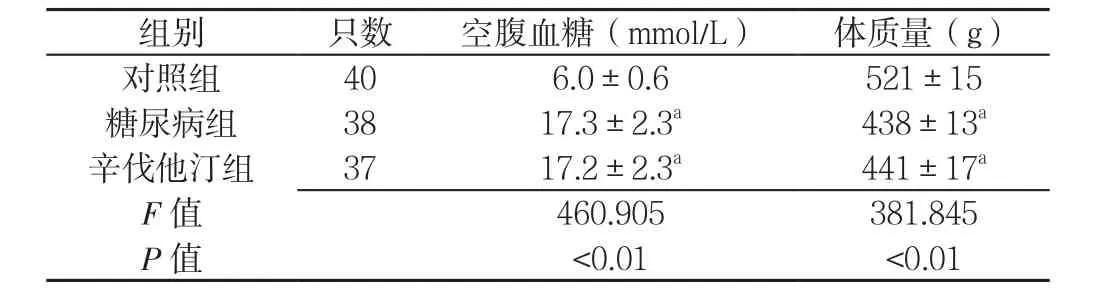
表1 3组大鼠空腹血糖和体质量比较(±s)Table 1 Comparison of fasting blood glucose and body mass among the three groups of rats
注:与对照组比较,aP<0.01
组别 只数 空腹血糖(mmol/L) 体质量(g)对照组 40 6.0±0.6 521±15糖尿病组 38 17.3±2.3a 438±13a辛伐他汀组 37 17.2±2.3a 441±17a F值 460.905 381.845 P 值 <0.01 <0.01
表2 3组大鼠逃避潜伏期比较(±s,s)Table 2 Comparison of the escape latency among the three groups of rats
注:与对照组相比,aP<0.01;与糖尿病组相比,bP<0.01
组别 只数 第1天 第2天 第3天 第4天 第5天对照组 40 97.3±1.8 80.5±3.2 74.3±1.8 67.7±0.9 53.3±1.9糖尿病组 38 97.2±1.8 92.5±3.0a 84.4±3.2a 78.6±4.2a 69.6±1.0a辛伐他汀组 37 97.3±0.9 85.4±4.1ab 77.3±1.9ab 74.4±3.2ab 60.2±2.2ab F 值 F交互=148.62,F组间=196.38,F时间=10 359.79 P 值 P交互<0.01,P组间<0.01,P时间<0.01
表3 3组大鼠mTOR/p70S6K信号通路蛋白表达水平比较(±s)Table 3 Comparison of mTOR/p70S6K pathway protein expression levels among the three groups of rats

表3 3组大鼠mTOR/p70S6K信号通路蛋白表达水平比较(±s)Table 3 Comparison of mTOR/p70S6K pathway protein expression levels among the three groups of rats
注:mTOR=雷帕霉素靶蛋白,p70S6K=p70核糖体蛋白S6激酶;与对照组比较,aP<0.01;与糖尿病组比较,bP<0.01
组别 只数 p-mTOR/mTOR p-p70S6K/p70S6K p-tau/t-tau对照组 40 0.51±0.10 0.48±0.10 0.55±0.02糖尿病组 38 0.81±0.06a 0.81±0.08a 0.79±0.08a辛伐他汀组 37 0.69±0.07ab 0.68±0.08ab 0.78±0.09ab F值 336.789 262.511 248.456 P值 <0.01 <0.01 <0.01
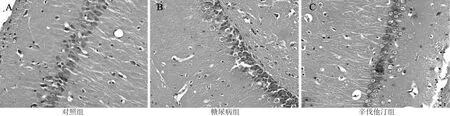
图1 3组大鼠海马组织超微病理检测结果(HE染色,×400)Figure 1 Ultrastructural pathological test results of the hippocampus among the three groups of rats
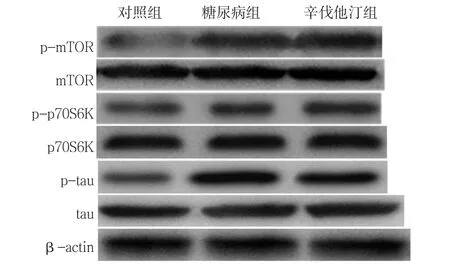
图2 3组大鼠mTOR/p70S6K信号通路蛋白的表达Figure 2 Expression of protein in the mTOR/p70S6K pathway among the three groups of rats
表4 3组大鼠氧化应激相关蛋白表达水平比较(±s)Table 4 Comparison of oxidative stress-related protein expression levels among the three groups of rats
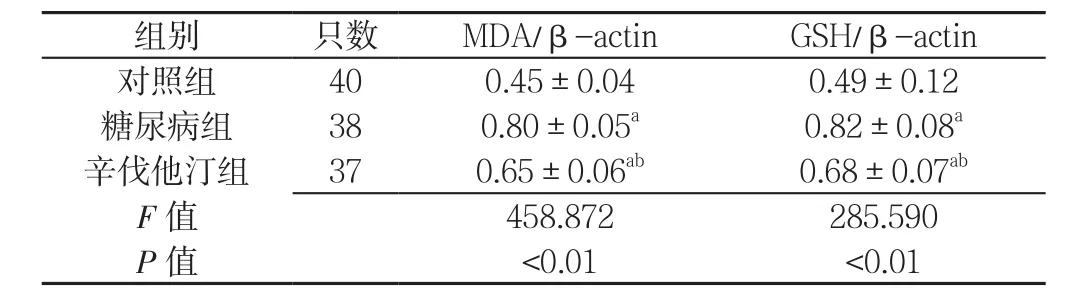
表4 3组大鼠氧化应激相关蛋白表达水平比较(±s)Table 4 Comparison of oxidative stress-related protein expression levels among the three groups of rats
注:MDA=丙二醛,GSH=谷胱甘肽;与对照组比较,aP<0.01;与糖尿病组比较,bP<0.01
组别 只数 MDA/β-actin GSH/β-actin对照组 40 0.45±0.04 0.49±0.12糖尿病组 38 0.80±0.05a 0.82±0.08a辛伐他汀组 37 0.65±0.06ab 0.68±0.07ab F值 458.872 285.590 P值 <0.01 <0.01
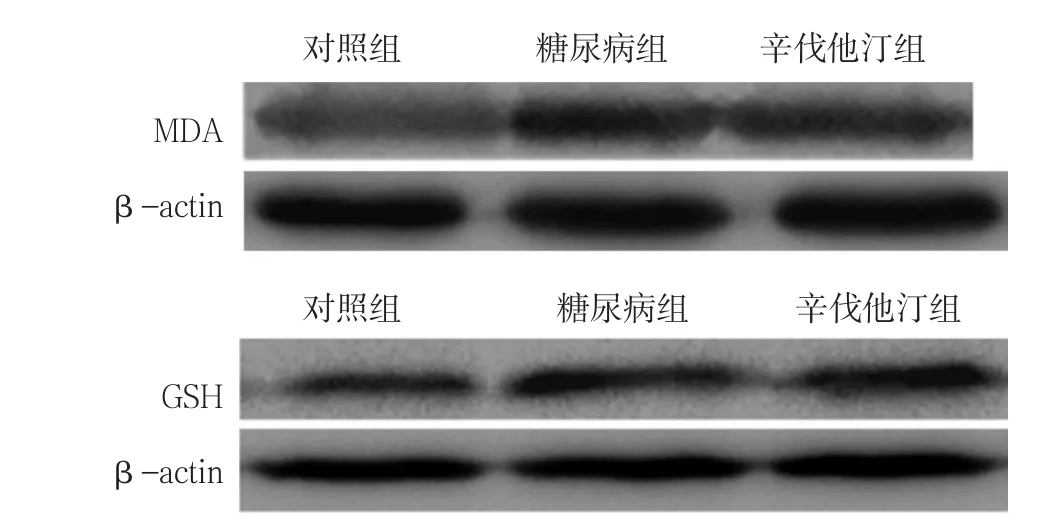
图3 3组大鼠氧化应激相关蛋白表达Figure 3 Expression of oxidative stress-related protein among the three groups of rats
本研究Morris水迷宫实验结果显示,随训练日数增加,糖尿病组大鼠逃避潜伏期显著长于对照组,表明糖尿病大鼠存在空间学习能力的缺陷。显微镜观察显示,糖尿病组大鼠海马组织神经元丢失和结构损害;辛伐他汀干预后显著缩短大鼠逃避潜伏期,海马神经元结构和完整性也有所改善。与对照组相比,糖尿病组大鼠海马组织mTOR、p70S6K和tau磷酸化水平明显增加,说明高糖刺激mTOR/p70S6K信号通路激活后,tau磷酸化水平增加。氧化应激产物MDA和GSH的表达水平随之升高。辛伐他汀干预后mTOR、p70S6K和tau磷酸化水平得到抑制,MDA和GSH的表达水平也随之降低。表明辛伐他汀能够抑制mTOR/p70S6K信号通路,同时发挥抗氧化作用。
mTOR/p70S6K信号通路是近年来分子生物学和细胞生物学的研究热点之一,p70S6K是mTOR下游的主要靶点之一,其磷酸化水平是评估mTOR活性的重要指标[24]。mTOR/p70S6K信号通路参与葡萄糖代谢和记忆形成,过度激活的mTOR / p70S6K信号通路被认为与认知功能障碍有关[25-26]。关于人体SH-SY5Y神经母细胞瘤细胞、小鼠神经母细胞瘤细胞和原代皮质神经元等的多项研究中均发现,mTOR/p70S6K信号通路在tau过度磷酸化中有重要作用,mTOR和p70S6K的异常上调与AD脑组织中过度磷酸化tau的积累有关[27-28]。抑制mTOR与p70S6K表达能够改善学习和记忆,并减少转基因AD小鼠模型的tau磷酸化[29]。GAO等[30]研究证实辛伐他汀具有激活mTOR/p70S6K信号通路改善认知功能的作用。与此同时,研究显示Akt/mTOR/S6K信号通路的激活能够提高GSH表达水平[31]。本研究证明辛伐他汀抑制氧化应激产物的表达,发挥抗氧化作用,但具体是否通过激活mTOR/p70S6K信号通路发挥作用,有待进一步研究。
综上所述,T2MD认知功能障碍大鼠中,存在mTOR/p70S6K信号通路的激活和tau过度磷酸化和氧化应激水平的改变,辛伐他汀能够抑制mTOR/p70S6K信号通路的激活和tau的磷酸化程度,具有抗氧化作用,改善T2DM大鼠认知功能。今后的研究可以进一步在基因和细胞水平研究辛伐他汀通过mTOR/p70S6K信号通路在糖尿病脑病中的作用机制,为寻找治疗靶点提供理论依据。
作者贡献:张禾伟、房辉进行文章的构思与设计,撰写与修订论文,负责文章的质量控制及审校,对文章整体负责,监督管理;孙雪玲进行研究的实施与可行性分析;张禾伟、张雅中进行数据收集;孙雪玲、田金莉进行数据整理;张禾伟、田金莉进行统计学处理,结果的分析与解释。
本文无利益冲突。

