外泌体β-actin mRNA在恶性胸腔积液、结核性胸腔积液鉴别诊断中的应用价值
农雪萍 黄建华 冯雅莉 刘翼军
【摘要】 目的:探索外泌体β-actin mRNA作为恶性胸腔积液和结核性胸腔积液鉴别诊断指标的临床价值。方法:收集70例结核性胸腔积液和57例恶性胸腔积液,采用外泌体沉淀试剂沉淀胸腔积液中的外泌体后用Trizol法提取外泌体总RNA,之后通过微滴式数字定量PCR技术检测外泌体中β-actin mRNA的表达。结果:数字定量PCR结果显示,1 ?g结核性胸腔积液外泌体总RNA中β-actin的拷贝数为75.20(15.15,614.00),1 ?g恶性胸腔积液外泌体总RNA中β-actin的拷贝数为4.65(1.95,22.40),两组相比差异有统计学意义(P=0.02)。受试者工作特征曲线结果显示,曲线下面积为0.79±0.04(P<0.000 1)。结论:外泌体β-actin mRNA可作为恶性胸腔积液和结核性胸腔积液鉴别诊断的潜在的新指标。
【关键词】 恶性胸腔积液 结核性胸腔积液 外泌体 β-actin mRNA
Application Value of Exosome β-actin mRNA in Differential Diagnosis of Malignant Pleural Effusion and Tuberculous Pleural Effusion/NONG Xueping, HUANG Jianhua, FENG Yali, LIU Yijun. //Medical Innovation of China, 2019, 16(29): -172
[Abstract] Objective: To explore if β-actin could be used as a novel method to distinguish malignant pleural effusion from tuberculous pleural effusion using the levels of β-actin mRNA in exosomes. Method: A total of Seventy cases of tuberculous pleural effusion and 57 cases of malignant pleural effusion were collected. After the exosomes in pleural effusion were precipitated by exosomes precipitation reagent, total exosomes RNA was extracted by Trizol method, the expression of beta-actin mRNA in exosomes was detected by microdrop quantitative PCR. Result: The results of quantitative PCR showed that the copy number of actin in the total RNA of 1 μg tuberculous pleural effusion exosomes was 75.20 (15.15, 614.00), and that of 1 μg malignant pleural effusion exosomes was 4.65 (1.95, 22.40), showed statistically significant difference between the two groups (P=0.02).The results of the subject operating characteristic curve show that the area under the curve was (0.79±0.04) (P<0.000 1). Conclusion: Exosome beta-actin mRNA may be a potential new indicator in the differential diagnosis of malignant pleural effusion and tuberculous pleural effusion.
[Key words] Malignant pleural effusion Tuberculous pleural effusion Exosome β-actin mRNA
First-authors address: Jiangxi Chest Hospital, Nanchang 330006, China
doi:10.3969/j.issn.1674-4985.2019.29.044
胸腔积液是一种由多种病因引起的临床常见疾病。对于胸腔积液的诊断有助于原发病因的明确、患者预后的判断以及治疗方案的选择[1]。结核性胸腔积液和恶性胸腔积液是我国最常见的两种胸腔积液类型[2],但是正确的区分两种类型并不容易,因为两者均可出现胸痛、发热、消瘦、乏力等相似的臨床表现,而且均属于渗出性胸腔积液,且均可为血性积液。虽然胸腔积液中查到结核分枝杆菌或肿瘤细胞可明确诊断,但是临床实践中发现单次胸腔积液的阳性检出率较低,需进行3次以上的送检。即使如此,仍然有一部分病例经过多种无创检测仍无法明确诊断,对于这部分病例只有行胸腔镜检查方能提高诊断准确度[3-4]。但是胸腔镜检查为有创检查,对操作者技能和经验要求较高,且有不可忽视的禁忌证和并发症,因此不能常规运用于临床区分结核性胸腔积液和恶性胸腔积液[5]。外泌体是一种由细胞释放出的具有双层脂质的细胞外囊泡,其直径为30~150 nm,包含了其来源细胞丰富且特异的miRNA、mRNA、DNA、蛋白质、脂质和其他生物活性分子等物质,因此可以通过检测外泌体内的特异性物质来明确其来源细胞的类型[6-8]。目前外泌体内包含的来源细胞特异性mRNA已被报道可用于糖尿病肾病、膀胱癌、结直肠癌和前列腺癌等疾病的诊断[9-12]。β-actin是一种常见的内参基因,其在不同类型的组织和细胞稳定表达[13]。本文就外泌体β-actin mRNA在胸腔积液和恶性胸腔积液鉴别诊断中的临床价值进行研究,现将研究结果报道如下。
1 资料与方法
1.1 一般资料 选取2017年12月-2018年6月到本院就诊的123例患者,其中结核性胸腔积液患者70例,结核性胸腔积液组纳入标准:(1)胸腔积液及组织中涂片找到结核分枝杆菌或者培养有结核分枝杆菌生长;(2)组织病理标本PCR检测阳性或符合干酪性肉芽肿病变;(3)胸腔积液PCR检测阳性或影像学表现符合结核病;(4)符合结核病临床过程,同时结核菌素试验阳性(硬结平均直径>20 mm);(5)诊断性抗结核治疗2个月,临床表现和影像学特点都有好转。符合(1)、(2)任一项;或(3)、(4)、(5)中的至少两项均可入组。排除标准:(1)有心、肝、肾等严重疾病和精神病;(2)合并恶性肿瘤、自身免疫性疾病、糖尿病;
(3)妊娠期、哺乳期妇女;(4)人免疫缺陷病毒(HIV)检测抗体阳性者。恶性胸腔积液患者57例,恶性胸腔积液组纳入标准:(1)胸腔积液细胞沉淀中找到恶性细胞;(2)胸膜活检组织中观察到恶性肿瘤的病理改变。符合(1)或(2)任一项均可入组。排除标准:妊娠期、哺乳期、HIV感染、急性病毒感染、自身免疫性疾病及免疫抑制剂应用史、严重肝肾功能损害者。该研究获得医院伦理委员会的批准,所有患者均知情同意。
1.2 实验方法
1.2.1 样本收集及处理 收集经呼吸科科确诊的结核性胸腔积液和恶性胸腔积液各5 mL装入1.5 mL离心管(货号:430791,美国Corning公司),于冷冻离心机(型号:5810R,德国Eppendorf公司)中4 ℃ 3 000×g离心15 min。用0.22 μm一次性针头式滤器(货号:SLGP033RB,德国Merck公司)抽滤上清液,将抽滤后的液体装入5 mL冻存管,-80 ℃储存备用。
1.2.2 外泌体沉淀及总RNA提取
1.2.2.1 外泌体沉淀 将冻存的样本取出后放入37 ℃水浴锅中完全融解后立即取出,吸取500 μL样本于1.5 mL EP管中,加入126 μL ExoQuick外泌体沉淀剂(货号:EXOQ5A-1,加拿大SBI公司)后放入4 ℃冰箱孵育至少12 h以上。孵育完成后冷冻离心机中4 ℃ 1 500×g离心30 min,取出EP管,弃上清,其底部的团块状白色物质即为沉淀的外泌体。
1.2.2.2 总RNA提取 用62.6 μL无酶去离子水重悬外泌体团块,之后采用Trizol法提取外泌体总RNA。具体过程如下:(1)外泌体悬液中加入1 mL Trizol(货号:15596026,美国ThermoFisher公司),室温放置5 min;(2)加入200 μL氯仿,充分振荡混匀后冰浴放置15 min;(3)4 ℃ 12 000×g离心15 min后吸取上层水相于2 mL无酶EP管中;(4)加入500 μL预冷异丙醇后充分混匀,冰浴放置10 min;(5)4℃ 12 000×g离心15 min,弃上清,加入1 mL无酶去离子水配制的75%乙醇,颠倒混匀;(6)4 ℃ 8 000×g离心15 min,尽量弃上清,室温开盖干燥5~10 min;(7)用20 μL无酶去离子水溶解RNA;(8)用NanoPhotometer(型号:N60,德国IMPLEN公司)检测RNA的浓度及纯度。
1.2.3 β-actin mRNA表达的检测
1.2.3.1 总RNA逆转录为cDNA 使用iScript cDNA合成试剂盒(货号:1708891,美国Bio-Rad公司)将1 μg总RNA逆转录为cDNA。逆转录反应体系为20 μL:5×反应混合物4 μL,逆转录酶1 μL,无酶去离子水和RNA模板量根据各样本RNA浓度确定。逆转录反应条件:首先25 ℃ 5 min使引物与模板结合,然后46 ℃ 20 min进行逆转录反應,接着95 ℃ 1 min灭活逆转录酶,最后4 ℃保存。
1.2.3.2 微滴式数字PCR检测 β-actin上游引物序列为5‘-CAGAGCAAGAGAGGCATC-3,下游引物序列为5‘-CTGGGGTGTTGAAGGTCT-3,扩增片段长度为216 bp。PCR扩增体系为20 μL:2×EvaGreen扩增混合物(货号:1864034,美国Bio-Rad公司)10 μL,前引物100 nM,后引物100 nM,cDNA 1 μL,无酶去离子水8.8 μL。扩增条件:95 ℃ 5 min;95 ℃ 30 s高温变性,60 ℃ 1 min退火/延伸,40个循环;4 ℃ 5 min;90 ℃
5 min。具有检测步骤如下:(1)将20 μL PCR扩增体系和70 μL微滴发生油分别加入微滴发生板,微滴发生仪(型号:QX200,美国Bio-Rad公司)将自动生成微滴;(2)将生成的微滴全部加入微滴式数字PCR专用96孔板内进行扩增,并设置阴性对照;(3)扩增结束后将96孔板放入微滴读取仪(型号:QX200,美国Bio-Rad公司)中进行检测,QuantaSoft软件将自动计算每个检测样本所含目的基因的拷贝数。
1.2.4 临床诊断的评价 将结核性胸腔积液组β-actin mRNA表达设为对照组,恶性胸腔积液组β-actin mRNA表达设为疾病组,以灵敏度为纵坐标,1-特异度为横坐标绘制受试者工作特征曲线(ROC曲线),计算曲线下面积,评价其临床诊断价值。
1.3 统计学处理 定量资料使用SPSS 11.0软件,运用k-s方法检验数据是否符合正态分布,若为正态分布则用均数+标准差表示,若为非正态分布则用中位数(四分位间距)表示。两组数据比较根据数据是否符合正态分布采用非配对t检验或Mann-Whitney U检验,统计分析均使用GraphPad Prism 7.0软件,以P<0.05表示差异有统计学意义。
2 结果
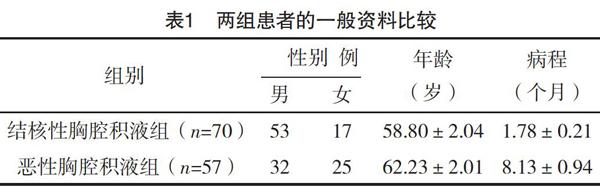
2.1 两组患者的一般资料比较 恶性胸腔积液组,非小細胞肺癌30例,腺癌:男28例,女23例,鳞癌:男2例;小细胞癌2例,其中乳腺癌1例,卵巢癌1例。两组患者的性别、年龄、病程比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
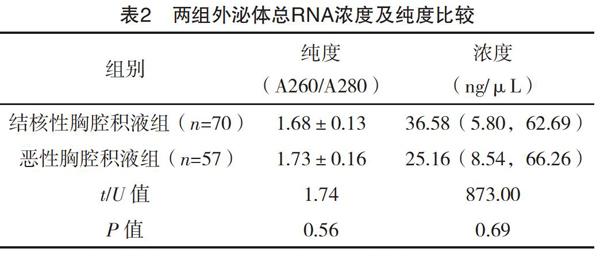
2.2 外泌体总RNA浓度及纯度 500 μL结核性胸腔积液和恶性胸腔积液所获得的外泌体总RNA浓度和纯度比较,差异均无统计学意义(P>0.05),见表2。
2.3 两组样本β-actin微滴式数字PCR检测结果比较
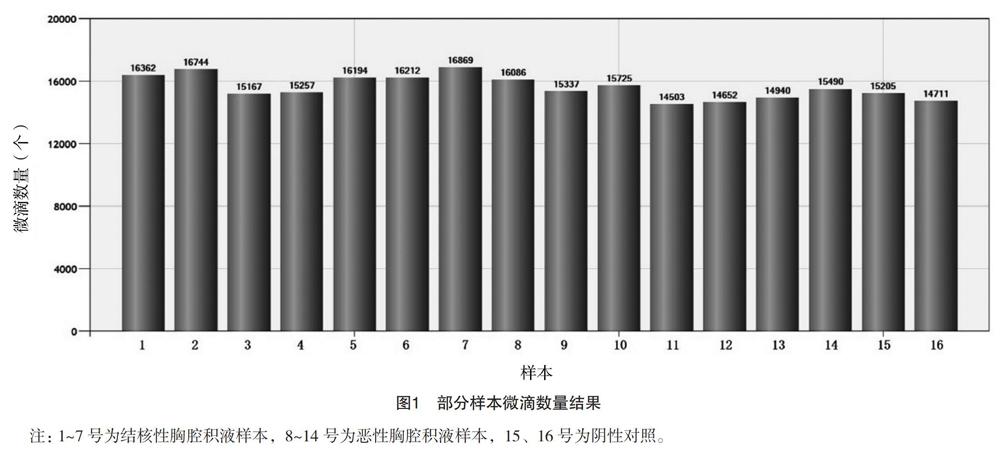
2.3.1 两组样本微滴数量检测结果 123个胸腔积液样本及阴性对照样本微滴数量均达到了10 000个以上,部分样本微滴数量结果见图1。
2.3.2 两组样本β-actin表达结果 微滴式数字PCR结果显示,所有检测样本阴性微滴的荧光信号值均值为2 494.04±65.94。微滴式数字PCR自带分析软件QuantaSoft自动设置检测阈值为8 000,结核性胸腔积液中有阳性微滴的例数为66例,恶性胸腔积液中有阳性微滴的例数为50例,两组阳性微滴检出率比较,差异无统计学意义(P=0.34)。设置检测阈值后QuantaSoft软件自动计算出20 ?L PCR扩增体系中β-actin的拷贝数,根据此结果计算出1 ?g结核性胸腔积液外泌体总RNA和1 ?g恶性胸腔积液外泌体总RNA中β-actin的拷贝数分别为75.20(15.15,614.00)和4.65(1.95,22.40),两组相比差异有统计学意义(P=0.02),见图2。
2.4 β-actin诊断价值的评估 ROC曲线下面积为(0.79±0.04),95%CI为(0.71,0.87),与曲线下面积等于0.5相比,差异有统计学意义(P<0.000 1),见图3。ROC曲线显示当诊断临界值为0.3时,具有最高的诊断灵敏度92.86%,特异度为10.71%;当诊断临界值为2 618时,具有最高的诊断特异度100%,此时灵敏度为11.43%;当诊断临界值为258时,具有最高的似然比,其值为18.4,此时诊断的灵敏度为32.86%,特异度为98.21%。
3 讨论
胸腔积液的诊断步骤首先要按照Light氏标准明确其为漏出液还是渗出液,之后如果是渗出液的话根据相关病史进行对应的实验室检查和特殊检查,例如如果需要对最不容易区分的结核性和恶性胸腔积液进行鉴别的话,则需要进行胸腔积液细胞计数、生化、肿瘤标志物检查、PPD检查、多次涂片查找抗酸杆菌或者肿瘤细胞、微生物培养、多次胸膜活检甚至可能需要开胸肺活检,整个诊断过程非常的繁琐、耗时,因此临床急需无创、准确、快速的新诊断方法辅助医生明确病因以便为患者提供最及时的医疗处理[3,14]。
最近研究表明外泌体是一种新的疾病诊断标志物,它由所有类型的细胞分泌至体液中,每种细胞分泌的外泌体内所包含的生物分子各有不同,同一种细胞所分泌的外泌体也会随着该细胞状态的不同而有所不同,因此可通过检测相关体液中所包含的外泌体的特征来明确其来源细胞或者反映其来源细胞的状态,从而达到疾病诊断的目的[15]。外泌体表面高表达的CD317和表皮生长因子受体被认为是非小细胞肺癌的诊断标志物,外泌体内miR-483-5p、miR-200b-5p等miRNA的高表达也被报道对于肺腺癌的诊断有临床价值[16]。
外泌体mRNA同样是一种具有潜力的疾病诊断生物标志物。尿液外泌体Wilms瘤基因1的mRNA的高表达与糖尿病肾病的不良预后相关[8],尿液外泌体SLC2A1、GPRC5A和KRT17基因mRNA高表达有望成为膀胱癌的潜在生物标志物[10]。因此笔者认为胸腔积液中外泌体mRNA也有成为辅助胸腔积液
诊断的指标之一。目前检测mRNA表达最常用的方法为荧光实时定量PCR技术相对定量法,该方法通过获得同一样本目的基因和内参基因的阈值循环数,用目的基因阈值循环数/内参基因循环数的比值来表示样本中目的基因的表达,因此内参基因的选择极其重要[17]。β-actin和GAPDH是检测mRNA相对表达最常用的内参基因,文献[8]研究中选用的内参基因即为GAPDH,但是目前尚未见将β-actin作为内参基因的报道。本课题组在前期的胸腔积液外泌体相关研究的预实验中发现外泌体中β-actin的mRNA表达在结核性胸腔积液和恶性胸腔积液中的差异较大,结核性胸腔积液外泌体中β-actin的mRNA表达显著高于恶性胸腔积液,因此笔者推测胸腔积液外泌体中的β-actin mRNA也许可以作为一个新的鉴别诊断指标,因此增加了样本量,并对其诊断价值进行了评价。
微滴式数字PCR法是通过用微滴发生油将PCR反应体系处理成上万个油包水微滴,每个油包水微滴即成为一个独立的PCR扩增系统,PCR扩增完成后微滴读取仪读取所有微滴中的荧光信号,软件即可自动计算出样本中目的基因的拷贝数,理论上可以检出含有1个拷贝的目标分子[18]。本研究中通过微滴式数字PCR法检测了1 ?g结核性和恶性胸腔积液外泌体总RNA中β-actin的拷贝数,结果显示少部分样本外泌体中并不能检测到β-actin的表达;结核性胸腔积液外泌体中β-actin的表达显著高于恶性胸腔积液中的表达,其原因可能与结核杆菌抗菌抗原刺激巨噬细胞后,巨噬细胞的分泌改变有关,但是其具体的机制仍不清楚[19-20]。
综上所述,外泌体β-actin mRNA具有作为结核性胸腔积液和恶性胸腔鉴别诊断新指标的潜力,其确切的临床诊断价值需进行多中心大样本量的验证,且在实际应用时其诊断临界值的选择取决于临床的实际需要。
参考文献
[1]张恩花.67例胸腔积液患者病因诊断分析[J].中国医药科学,2019,9(6):252-254.
[2]伍燕兵,杜莹,逯勇,等.胸腔积液病因分析[J].中國呼吸与危重监护杂志,2017,16(5):490-494.
[3]何权瀛.胸腔积液临床诊断流程[J].临床肺科杂志,2017,22(8):1359-1363.
[4]李玲义,姚文静,张琪,等.胸部CT在良恶性胸腔积液诊断中的应用价值[J].华南国防医学杂志,2019,33(2):114-117.
[5]中国医师协会整合医学分会呼吸专业委员会.内科胸腔镜诊疗规范[J/OL].中华肺部疾病杂志(电子版),2018,11(1):6-13.
[6]王璐,孟琳,刘树威,等.外泌体的产生及其生物学作用的研究进展[J].吉林大学学报(医学版),2018,44(5):1109-1114.
[7] Zhuo Wan,Xiaotong Gao,Yan Dong,et al.Exosome-mediated cell-cell communication in tumor progression[J].Am J Cancer Res,2018,8(9):1661-1673.
[8] Iba T,Ogura H.Role of extracellular vesicles in the development of sepsis-induced coagulopathy[J].Journal of Intensive Care,2018,6(1):1-12.
[9] Hideharu A,Akiko S,Hiroyuki O,et al.Urinary Exosomal mRNA of WT1 as Diagnostic and Prognostic Biomarker for Diabetic Nephropathy[J].J Med Invest,2018,65(3.4):208-215.
[10] Hinger S A,Cha D J,Franklin J L,et al.Diverse Long RNAs Are Differentially Sorted into Extracellular Vesicles Secreted by Colorectal Cancer Cells[J].Cell Rep,2018,25(3):715-725.
[11] Murakami T,Yamamoto C M,Akino T,et al.Bladder cancer detection by urinary extracellular vesicle mRNA analysis[J].Oncotarget,2018,9(67):32810-32821.
[12]李波,姜岩,吕道均.外泌体来源的非编码RNA在前列腺癌诊断及治疗中的研究进展[J].解放军医学院学报,2019,40(5):1-3.
[13]杨显英,熊显荣,韩杰,等.小鼠卵巢组织定量PCR分析中内参基因的筛选[J].畜牧医学学报,2019,50(2):446-453.
[14] José M Porcel.Biomarkers in the diagnosis of pleural diseases: a 2018 update[J].Ther Adv Respir Dis,2018,12:1-11.
[15]赵濛,刘志红,李金泉.外泌体组成特征及其作为细胞通讯和分子标记的生物学作用[J].中国生物化学与分子生物学报,2016,32(6):612-619.
[16]杨晓璐,顾岩,付秀华.外泌体在肺癌方面的研究进展[J].医学综述,2018,24(19):3813-3818.
[17]安钢力.实时荧光定量PCR技术的原理及其应用[J].中国现代教育装备,2018(21):19-21.
[18]刘聪,蒋克明,刘聪,等.微滴技术的数字PCR研究现状及发展趋势[J].化学研究与应用,2018,30(7):1041-1047.
[19]徐兆坤,李武,王玉炯.外泌体在机体抗结核分枝杆菌感染中的作用及其应用[J].细胞与分子免疫学杂志,2018,49(9):1803-1809.
[20]路雁惠,郭斌,张锐毅,等.结核性脑膜炎患者脑脊液外泌体中Let-7b的表达水平及临床意义[J].中风与神经疾病杂志,2018,35(12):1107-1110.
(收稿日期:2019-04-15) (本文编辑:张爽)

