miR-127-3p对C2C12细胞成肌分化和转录组的影响
宋天增,李 杰,马金英, 蒋 婧,王高富, 付 琳,周 鹏,马友记,任航行
(1. 西藏自治区农牧科学院 畜牧兽医研究所,拉萨 850009; 2. 重庆市畜牧科学院 草食牲畜研究所 重庆荣昌 402460;3.甘肃农业大学 动物科学技术学院,兰州 730070)
骨骼肌的形成是一个非常复杂的生物学过程,包括成肌决定,成肌细胞增殖,细胞周期的退出,肌肉特异性基因的表达,肌细胞融合形成多核肌管,多核肌管再经过一系列发育变化,最后分化成为具有功能的成熟肌纤维[1-2]。这些复杂过程的顺利进行不仅受许多编码蛋白的因子调节,如成肌调节因子家族(MRFs)、肌细胞增强子因子2家族(MEF2)和对框基因(Pax)家族,而且还受到非编码RNAs的调控,如microRNAs(miRNAs)。由基因组中的非蛋白质编码区或内含子所编码的miRNAs在转录后水平调控基因表达,并在肌细胞的增殖和分化过程中发挥重要作用[3-5]。调控成肌分化的miRNAs可以分为两类:一类是促进分化,包括miR-1[6]、miR-133[7]、miR-206[8]、miR-486[8]、miR-181[9]、miR-148a[10]、miR-214[11]、miR-26a[12]、miR-27b[13]、miR-378[14]和miR-322/424/503[15]等。另一类是抑制分化,包括miR-125b[16]、miR-155[17]、miR-199a-3p[18]、miR-186[19]、miR-221/222[20]和miR-669a/669q[21]等。但这些仅仅是非编码RNA的冰山之一角,大量未知功能的miRNAs亟需鉴定。笔者前期用高通量测序(RNA-Seq)法对Texel羊(MSTN突变型)与乌珠穆沁羊(MSTN野生型)胎儿骨骼肌中的miRNA进行转录组测序,分析发现miR-127-3p与miR-1/206/133均属骨骼肌高表达miRNAs,且miR-127-3p在 2 个品种羊骨骼肌中差异表达[22],暗示miR-127-3p可能参与羊骨骼肌的生长发育调控。Yang 等[23]和Li等[24]的研究结果表明,miR-127-3p参与骨骼肌细胞的分化调控,但miR-127-3p调节成肌分化的作用机制还不清楚。本研究以表达miR-127-3p的慢病毒载体转染分化期的C2C12成肌细胞,旨在探究miR-127-3p表达变化对C2C12细胞生肌分化的作用,及其在转录组水平上对基因表达的影响效应,为进一步阐明miRNA的功能奠定基础。
1 材料与方法
1.1 材料及试剂
DMEM培养基、胎牛血清(FBS)、马血清(HS)、青链霉素双抗、25 g/L胰酶、D-PBS均购自Gibco;6孔板、培养皿、15 mL离心管购自Corning;Lipofectamine 2000:美国Invitrogen公司;DAPI:瑞士Roche公司; SuperScript First-Strand Synthesis System for RT-qPCR 和SuperScript Ⅲ Platinum SYBR Green One-Step qRT-PCR Kit:美国Invitrogen公司;TaqMan MicroRNA Reverse Transcription,TaqMan MicroRNA Assays和TaqMan Universal qPCR Master Mix Ⅱ:美国ABI公司;miR-127-3p 慢病毒表达载体:美国ABI公司;Trizol试剂:美国Invitrogen公司;倒置荧光相差显微镜:日本Olympus公司;Countess Ⅱ FL全自动细胞计数仪(Life Technologies)。C2C12 细胞购买于中国中科院上海细胞库。
1.2 C2C12细胞培养及转染miR-127-3p 慢病毒载体
小鼠 C2C12 细胞培养在生长培养基 GM(DMEM+10%FBS+1% 双抗),待细胞汇合度至 80%左右时,加入配制的分化培养基 DM(DMEM+2%HS+1% 双抗),隔天更换新鲜培养基。在 37 ℃,φ=5% CO2的条件下连续培养 5 d。首先用适量 opti-MEM 溶解 miR-127-3p 慢病毒表达载体或阴性对照(miR-NC),保持其浓度为 100 nmol/L,按照 Lipofectamine 2000 的说明书稀释脂质体。选择生长状态良好的分化细胞,显微镜下观察其状态并统计细胞数目,确保初始阶段处理组与对照组的细胞数一致。转染具体步骤:首先将转染试剂 Lipofectamine 2000 与 Opti-MEM 2 种溶液轻轻吹打至混匀,室温孵育 5 min 后,将慢病毒表达载体与对照载体分别加入脂质体混合液,轻轻吹打,使脂质体充分接触载体并将其完全包裹,均匀分布。待室温静置 20 min 后,逐滴加入培养皿中,轻微摇晃,使混合物分布均匀。为减少转染试剂的毒性,转染 12 h 后更换新鲜培养基。转染 48 h 后即可进行后续相关试验。转染过程及试剂用量按照 Lipofectmaine 2000 转染试剂说明书进行。
1.3 RNA-Seq测序及数据处理
收集分化第5天处理组(OE)与阴性对照组(NC)的C2C12细胞,每个处理取3份细胞RNA样品。TRIzol 法提取细胞总RNA,10 g/L琼脂糖电泳和分光光度计(Implen, Los Angeles, CA, USA)检测RNA质量,质量合格后委托北京诺禾致源科技有限公司在Illumina Hiseq 2000 平台进行RNA-Seq测序分析。6 个样品构建的测序文库所得的原始数据经过滤(包括去掉接头序列、含10% 以上未知碱基的Reads,及低质量的Reads),计算过滤后每个测序文库的Phred值(Q20,Q30) 和GC含量,得到有效数据(Clean reads)用于后续分析。对所得的Clean reads在小鼠参考基因组上应用TopHat v2.0.9[25-26]和Scripture(Beta2)[27]进行比对和定位,应用Cuffdiff(v2.1.1)软件计算每个基因的表达量(FPKM,Fragments per kb for a million reads)[28]。用DESeq软件鉴定处理组与对照组细胞的差异表达基因,筛选标准为校正后的P值(padj )< 0.05。
1.4 Real-time qPCR
用Trizol法从C2C12细胞中提取总RNA,mRNA和miRNA分别用SuperScript First-Strand Synthesis System for RT-qPCR和TaqMan MicroRNA Reverse Transcription试剂盒反转录成cDNA,再分别进行qRT-PCR分析。miR-127-3p按探针法miRNA定量试剂盒说明操作,U6为内参基因,体系如下:50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 60 s,40个循环。每个样品做3次重复。成肌分化标志基因MyoD(F:GGC- TCTCTCTGCTCCTTTGA,R:GTAGGGAAG- TGTGCGTGCTC)、MyoG(F:GCAGGCTCAAGAAAGTGAATG,R:AGGCGCTCAATGTACTGGAT)和Myosin(F:AGGCACCTGCTGAAGAAGAC,R:CCTCGAAGGTCTGTGACTCC)的定量以GAPDH(F:TCAAGAAGGTGGTGAAGCAG,R:AGGTGGAA-GAGTGGGAGTTG)为内参基因。mRNA与miRNA的相对定量表达均采用2-ΔΔCt法计算。
1.5 统计方法
应用SAS 8.0软件中的t-test方法检验qPCR分析结果。
2 结果与分析
2.1 miRNA表达载体的转染效率及其对C2C12细胞分化的效应
研究结果表明,miRNA载体的转染效率达到95%(P<0.01) (图1-A),说明miR-127-3p 载体转染细胞效率较高,可以用于后续试验;基因表达与细胞形态学分析表明,过表达miR-127-3p可显著提高细胞成肌分化标志基因MyoG和Myosin的表达(P<0.01)(图1-B),促进细胞的成肌分化(图1-C)。

qRT-PCR法检测miR-127-3p(A)与成肌标志基因MyoD,MyoG和Myosin(B)的表达。数据表示为“平均值±标准差”(n=3),*P<0.05, **P<0.01。在分化第5天分别观察C2C12细胞的形态学情况,比例尺= 100 μm(C) MiR-127-3p(A), myogenic marker genesMyoD,MyoGandMyosin(B) expression were measured by qRT-PCR.The data are the “mean+SD”(n=3). *P<0.05, **P<0.01 .Morphological features of myotubes at 5th day of differentiating C2C12 cells. Scale bar = 100 μm(C)
图1miRNA载体转染效率及其对C2C12细胞的分化效应
Fig.1TheefficiencyandeffectofmiRNAexpressionvectoronmyogenicdifferentiationinC2C12cells
2.2 过表达miR-127-3p对C2C12细胞转录组的影响
在分化介质中,C2C12成肌细胞分别转染miR-127-3p 表达载体和对照组(NC)慢病毒载体后第 5 天,对两组细胞总RNA在Illumina平台进行RNA-seq深度测序。6 个文库(每组 3 份细胞样本)的测序原始数据(Raw reads)经过滤后共获得 21 Gb的有效数据(Clean reads),数据质控检验合格(平均Q20>96%,Q30>92%),说明本次测序数据质量较高,可用于后续差异基因分析。基因表达分析发现,11 761 个基因在过表达组(OE)与对照组(NC)细胞共同表达,189 个基因在过表达组特异表达,223 个基因在对照组特异表达。
应用DEseq软件共鉴定到 30 个差异基因,全部为下调基因(图2,表1)。Gene Ontology功能聚类分析发现,免疫反应与能量代谢类基因显著富集(图3),暗示此阶段过表达 miR-127-3p 可能会影响成肌分化进程。此外,鉴定得到 20 个显著富集的经典KEGG信号通路(图4),其大部分信号通路的功能主要与病毒感染与免疫疾病相关。但信号通路Viral myocarditis、Cell adhesion molecules(CAMs)值得关注,这些差异基因同样是成肌分化过程中的重要功能基因。

图中红色点表示有显著性差异表达的上调基因,绿色点表示有显著性差异表达的下调基因, 蓝色为差异基因筛选阈值padj<0.05以下的基因 Red dot indicates the differential gene was expressed increasingly, whereas blue one refers to the down-regulated differential gene in OE group, compared with that in the NC group. The significance of threshold is padj<0.05
图2不同处理组细胞的差异基因火山图
Fig.2VolcanoplotofdifferentialgenesidentifiedbetweenOEandNCgroup
2.3 miR-127-3p靶基因预测
为了进一步鉴定受miR-127-3p调控的转录因子,将差异表达基因(表1)与TFCat数据库进行匹配,结果发现2个转录因子,即Irf7和Ddit3。这暗示转录因子Irf7和Ddit3表达的变化可引起下游多个受其调控的靶基因表达变化,进而导致处理组与对照组的细胞表型变化。为了进一步确定miRNA与潜在的靶基因之间是否存在直接碱基配对关系,对miR-127-3p与Ddit3基因序列进行比对分析,发现 miR-127-3p 与Ddit3基因的蛋白编码区(CDS)存在碱基互补配对关系(图5),暗示miR-127-3p可能通过碱基配对的方式影响Ddit3基因的表达。同时,该结果有助于完善miR-127-3p的成肌分化调控轴(图6),miR-127-3p与Ddit3基因的关系还需进一步试验验证。

表1 miR-127-3p过表达与对照组细胞间的差异表达基因Table 1 Deferentially expressed genes between miR-127-3p overexpression and negative control group

图3 不同处理组间的差异基因GO富集分析Fig.3 Enrichment analysis of differential genes between OE and NC group
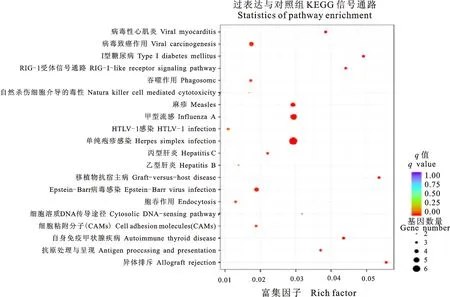
圆圈的颜色表示每个信号通路相应的显著性P值,圆圈大小则表示每个信号通路上出现的差异基因个数 Circle color indicates the significance of enriched KEGG pathway, while circle size refers to count of gene in the pathway
图4不同处理组间的差异基因KEGG信号通路富集分析
Fig.4KEGGenrichmentofdifferentialgenesbetweenOEandNCgroup

红色部分为本文研究结果,黑色部分为Alter等[36]已有研究 The red parts indicate findings in present study, and the black parts refer to the known findings of Alteretal[36]
图5miR-127-3p成熟序列与转录因子Ddit3基因编码区(CDS)序列比对
Fig.5AlignmentofmiR-127-3pwiththecodingsequence(CDS)ofDdit3inmouse
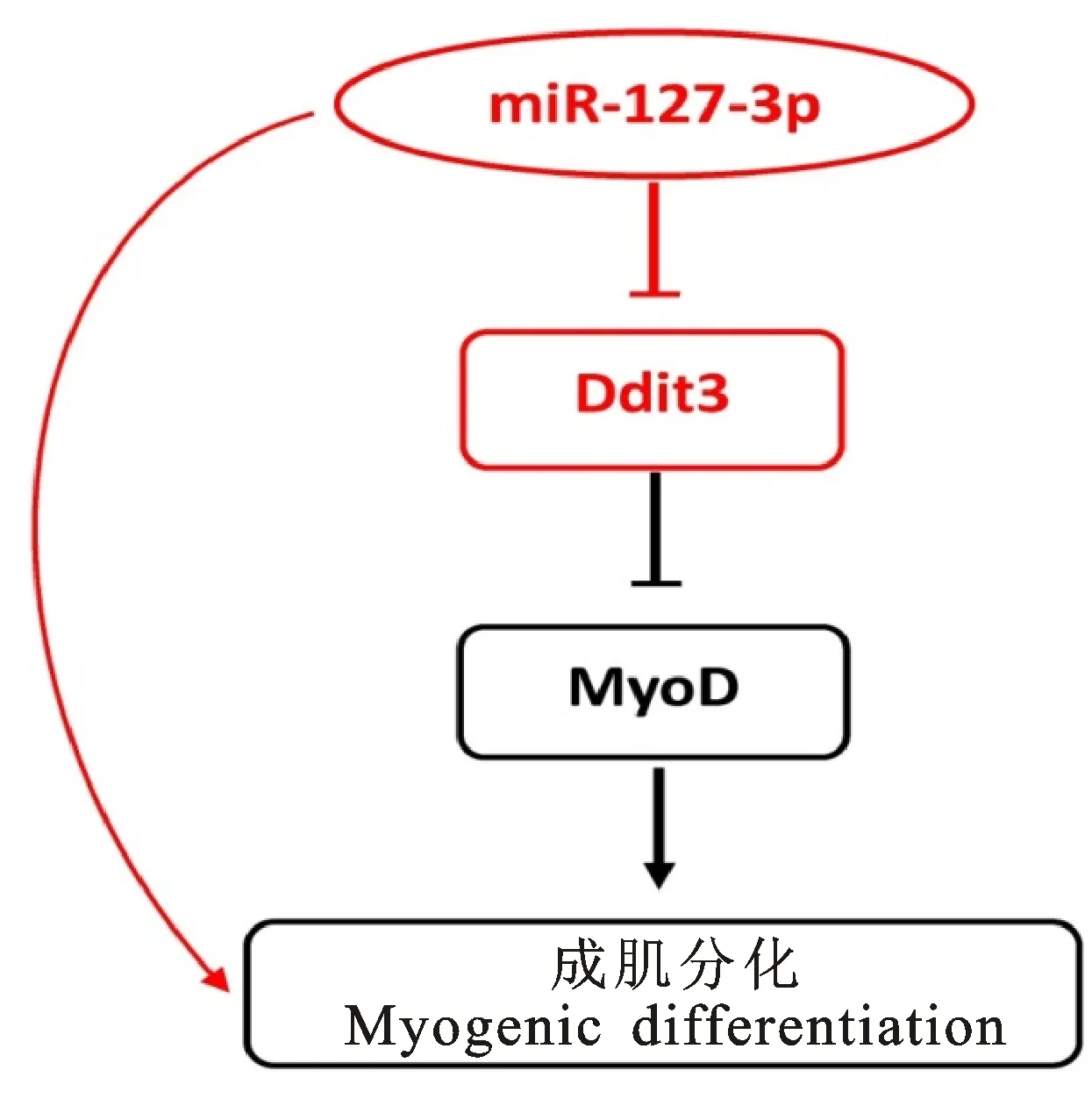
图6 miR-127-3p的成肌分化调控轴Fig.6 Sketch of miR-127-3p regulating myogenic differentiation
3 讨 论
骨骼肌的生长发育主要表现为肌细胞数量的增加和体积的增大,这两方面的顺利进行依赖于成肌细胞的增殖和分化[29]。MiRNAs在转录后水平调控基因表达,在肌细胞的增殖和分化过程中发挥重要作用[30]。miR-1/miR-206/miR-133仅在肌肉组织中特异表达,而miR-127在动物的多个组织广泛表达,且在肌肉、皮肤和脾脏中表达较高[23-24]。笔者近期研究发现 miR-127-3p 表达量随 C2C12 肌细胞分化逐渐增高[24],暗示 miR-127-3p 参与骨骼肌细胞分化的调控。此外,研究还发现 miR-127 能够抑制小鼠肝脏癌细胞的增殖[31],且其在胎儿肺发育过程中发挥重要调控作用[32]。以上研究说明,miR-127 在动物早期发育及器官形成方面有重要调控作用。本研究结果表明,过表达 miR-127-3p 导致 C2C12 细胞 30 个蛋白编码基因显著下调,这些基因主要富集于免疫反应和能量代谢相关的生物学过程与信号通路(图3,图4),说明 miR-127-3p 通过改变免疫反应和能量代谢相关的生物学过程来影响 C2C12 细胞的成肌分化。Karpati 等[33]和Honda等[34]早期研究表明,包括主要组织相容性复合体Ⅰ(MHCⅠ)等在内的大量与免疫相关的基因在成肌分化过程中发挥重要作用,这些免疫类分子可能参与肌细胞融合为多核肌管阶段的肌细胞间识别与互作过程。此外,O’Connor等[35]研究发现成肌细胞融合是一个高耗能(ATP)的生物学事件,小鼠初级成肌细胞培养物中补充磷酸肌醇可增加细胞能量的供给,进而促进肌管生成,这种促成肌效应是通过肌酸激酶依赖的途径发挥作用。以上分析表明,miR-127-3p 可能通过调节免疫类与能量代谢类基因的表达来调控肌细胞识别、融合及能量供给环节,进而影响肌管生成。
Ddit3(DNA-damage inducible transcript 3)为一个重要的转录因子,参与多个生物学过程的调控。Alter等[36]研究发现Ddit3可直接抑制MyoD基因转录进而负调控成肌细胞分化。本研究发现,miR-127-3p可能直接靶向转录因子Ddit3基因CDS区域(图5)以调控其表达,并显著促进C2C12细胞的成肌分化(图1),这与前期对Ddit3成肌功能的研究结果一致。此外,侯金星等[37]认为chi-miR-4110 对奶山羊Smad2基因有靶向调控作用。穆松等[38]确定出miRNA上的功能性SNP位点对miRNA的靶基因选择和结构稳定有很大影响,并最终通过miRNA来影响动物表型的改变。因此,该结果有助于完善miR-127-3p的成肌分化调控轴(图6),但miR-127-3p与Ddit3基因的调控关系还需要进一步试验验证。尽管miRNA靶向mRNA的蛋白编码区(CDS)为miRNA的非主流调控方式,近年来也相继出现不少研究报道,如 miR-148与DNMT3b[39]、miR-183与betaTrCP1[40]、miR-143与PTN[41]、 miR-375与 CIP2A[42]、miR-20a与PRKG1[43]、miR-128与MSTN[44]、miR-15/107与BRCA1[45]、miR-932与DNLG2[46]、MiR-193a-5p 与AP-2alpha[47]、miR-342-5p/miR-10aCVB3[48-49]、Cgi-miR-92d与CgLITAF3[50]。这些研究充分说明miRNA与其靶基因的CDS区形成碱基互补配对,也是 miRNA 发挥转录后调控的一种重要方式。本研究有助于阐明 miR-127-3p 调节肌肉发育分化的分子机理,同时,也为人的肌类疾病的靶向治疗提供理论依据。但还需进一步通过荧光素酶报告载体鉴定 miR-127-3p 的靶基因及其对细胞成肌分化的影响效应。
4 结 论
过表达 miR-127-3p 显著促进C2C12细胞的成肌分化;在转录组水平上,miR-127-3p可能通过调控免疫与能量代谢类基因的表达来调节成肌细胞的分化;miR-127-3p可能直接靶向Ddit3基因CDS区域以调控其表达。

