超声波辅助提取石榴根皮多酚工艺优化及其抗氧化活性
李卓瓦,袁晓芸,赵鑫磊,王晓真,张 倩,尹志成
(1.枣庄学院食品科学与制药工程学院,山东枣庄277160;2.山东大学药学院,山东济南250012)
石榴(Punica granatum L.)为石榴科石榴属木本植物,原产于地中海至亚洲西部,现在我国南北各省均有栽培,是一种常见的果树[1]。商业化的石榴盆景是鲁南地区石榴资源开发的特色产业和支撑产业,自然淘汰的老根外皮只有极少部分作为中药材“石榴根皮”被利用,绝大多数石榴根皮资源被浪费。石榴根皮具有收敛止泻、杀虫之功效,用于治疗肠炎、痢疾、绦虫等疾病[2]。近年来,大量研究证明植物多酚类成分广泛存在于石榴植物体的多个部位,而且普遍具有较好的生物活性。例如,邓娜等[3]研究发现,石榴皮、石榴籽和石榴瓤中都含有多酚类成分,且均具有较好的抗氧化活性。刘振平等[4]研究证实,石榴叶和石榴汁中没食子酸、石榴皮鞣素及鞣花酸等多酚类成分含量较高,具有良好的开发价值。国外已经有文献报道石榴根皮中存在多酚类成分[5],但是,对其提取工艺及其抗氧化领域的研究,还未见文献报道。
超声波辅助提取原料组成成分,是一种物理破碎过程,主要利用超声波空化效应增大物质分子运动频率和速率,增加溶剂穿透力,促进功效成分的溶出。有研究证实[6-7],超声波辅助提取植物材料中多酚类成分,具有条件温和、环境友好、可操作性强等诸多优点,同时,有效避免了活性成分被氧化而使功效丧失,提取效率高。
本研究采用响应面法优化石榴根皮中多酚类成分的提取工艺,并通过测定石榴根皮多酚清除DPPH自由基及ABTS能力,分析其抗氧化活性。为石榴根皮多酚的工业化生产,促进石榴资源的充分开发利用提供参考。
1 材料与方法
1.1 材料与仪器
石榴 采自山东峄城“万亩石榴园”核心产区,经枣庄学院闫志佩教授鉴定为正品石榴,手工剥取石榴根皮,洗净、干燥后粉碎到规定粒度,备用;没食子酸对照品(纯度>99%,批号:110831-201204) 由中国食品药品检定研究院提供;DPPH、ABTS 美国Sigma公司;AB-8大孔吸附树脂 天津波鸿树脂科技有限公司;福林酚、无水乙醇、碳酸钠、过硫酸钠、抗坏血酸 天津大茂化学试剂厂;蒸馏水 枣庄学院生物学省级实验教学示范中心提供。
HN-CQY型低温超声波萃取仪 上海汗诺仪器有限公司;759型紫外-可见分光光度计 上海奥普勒仪器有限公司;AL204型电子分析天平 瑞士梅特勒公司;FW135型多功能粉碎机 天津泰斯特仪器有限公司;RE-2000A型旋转蒸发器 上海亚荣生化仪器厂;HH-6型数显恒温水浴锅 国华电器有限公司;RV5型真空泵 英国Edwards公司;标准检验筛 浙江上虞华美仪器纱筛厂。
1.2 实验方法
1.2.1 多酚提取及纯化工艺 准确称取粉碎至一定粒度的石榴根皮粉末5.0 g,置于250 mL干燥锥形瓶中,加入一定体积分数的乙醇至一定的料液比例,用保鲜膜封住瓶口。在一定温度下,按照一定的超声功率超声提取一定的时间。反应结束后,抽滤,将滤液浓缩至30 mL,定容至100 mL。取定容后滤液20 mL,用AB-8大孔吸附树脂80 g(湿重)静态吸附,50%乙醇250 mL洗脱,用0.45μm微孔滤膜过滤,减压蒸干后得到石榴根皮多酚固形物,称重,备用[8]。
1.2.2 标准曲线的制定 参照文献[9-10]方法,略有改动。精密称取干燥至恒重的没食子酸对照品25 mg,用无水乙醇定容至25 mL,即得浓度为1 mg/mL的没食子酸对照品溶液。精密量取没食子酸对照品溶液0、0.2、0.4、0.6、0.8、1.0、1.2 mL,依次加入福林酚试剂、Na2CO3试剂后,摇匀并定容至25 mL,于25℃下避光反应2 h,在760 nm波长下测定吸光度(A值),得回归方程A=0.015C-0.0012(r=0.9996),浓度在0~48μg/mL范围内线性关系良好。
1.2.3 样品中多酚的含量测定 准确称取精制后的石榴根皮多酚1.0 mg,用蒸馏水定容至100 mL,作为样品溶液,用于含量测定。准确量取1 mL于25 mL具塞比色管中,按照“1.2.2”项下试验方法测定A值,计算样品中多酚得率及纯度。

1.2.4 单因素试验设计 超声波辅助提取石榴根皮多酚工艺中,主要影响因素有6个,分别为药材粒度、乙醇体积分数、料液比、超声功率、超声温度和超声时间。通过单因素试验,考察药材粒度(10、20、30、40、50、60、70 目)、乙醇体积分数(0、15%、30%、45%、60%、75%、90%)、料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL))、超声功率(100、200、300、400、500、600、700 W)、超声温度(25、35、45、55、65、75、85 ℃)和超声时间(5、15、25、35、45、55、65 min)对石榴根皮多酚得率的影响,每个水平重复3次取平均值计算分析。试验过程中的不变水平值为:药材粒度40目、乙醇体积分数60%、料液比1∶20 g/mL、超声功率400 W、超声温度55℃和超声时间35 min。
1.2.5 筛选试验设计-PB设计 药材粒度、乙醇体积分数、料液比、超声功率、超声温度和超声时间,依次编码为 X1、X2、X3、X4、X5和 X6。对于每个因素,在前期大量试验基础上,均设定高(1)、低(-1)两个水平,以石榴根皮多酚得率(Y)为响应值,6个影响因素为自变量,每个试验号平行试验3次,取平均值作为试验结果,共进行12次试验。PB试验设计因素水平见表1。
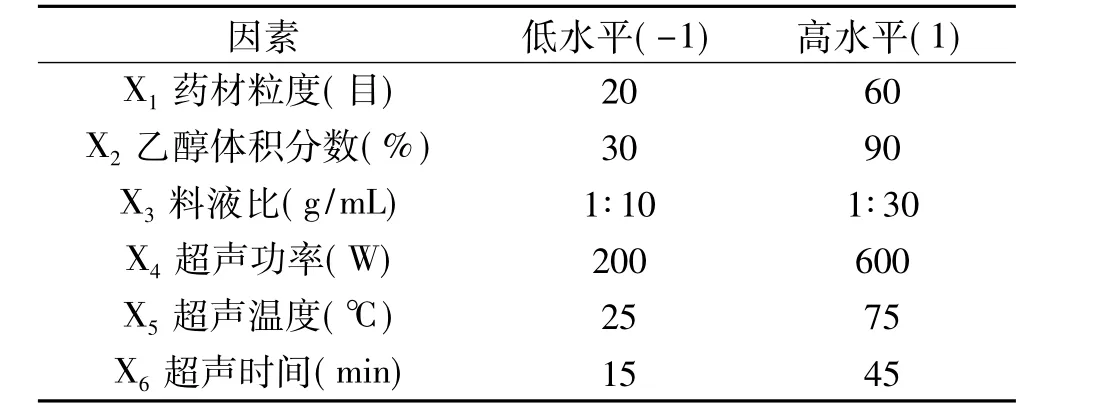
表1 PB设计因素水平表Table 1 Factors and levels used in the PB design
1.2.6 优化试验设计-CCD设计 根据PB试验分析结果,选取乙醇体积分数(X2)、超声温度(X5)和超声时间(X6)作为CCD试验设计的3个自变量,以石榴根皮多酚得率(Y)为响应值,选用n=20试验设计模块,每个试验号平行试验3次,取平均值作为试验结果,建立其与自变量之间的函数关系,进而寻求石榴根皮多酚提取工艺的最优组合。CCD试验设计因素水平见表2。
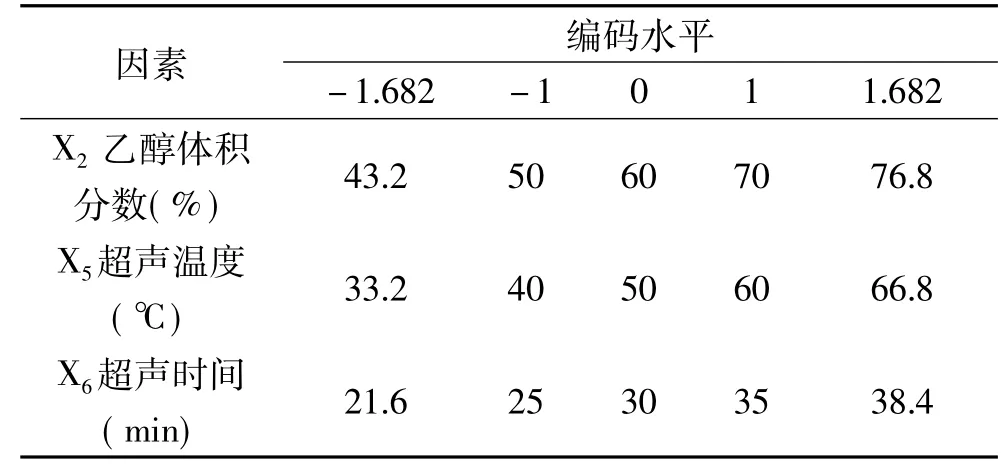
表2 CCD设计因素水平表Table 2 Factors and levels used in the CCD design
1.2.7 石榴根皮多酚清除自由基能力评价
1.2.7.1 石榴根皮多酚对DPPH自由基的清除作用 参考文献[11-14]的方法并加以改进,操作方法:准确吸取100μL稀释至适当浓度的样品溶液,用重蒸馏水补充至1 mL,加入0.1 mmol/L的DPPH溶液2 mL,避光放置30 min,以无水乙醇作参比在517 nm波长处测定吸光度Ai;以等体积的无水乙醇代替样品溶液,同法操作,测定吸光度A0;以等体积的无水乙醇溶液代替DPPH溶液,同法操作,测定吸光度Ai0。将纯化后的石榴根皮提取物依次配制成2.5、5、10、15、20、40、60、80、100、120、140、160 μg/mL的样品溶液,用于对DPPH自由基的清除作用测定,求出IC50,并以VC为参照。DPPH自由基清除率按式(3)计算:
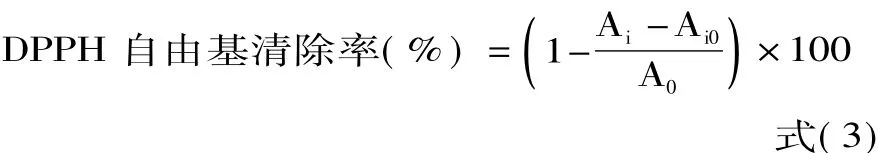
1.2.7.2 石榴根皮多酚对ABTS+·的清除作用 参照文献[15-17]的方法并加以改进,操作方法:将7 mmol/L的ABTS溶液5 mL与140 mmol/L的过硫酸钾88μL混合,置于暗处反应24 h,使用前用无水乙醇稀释至734 nm波长下吸光度0.70±0.02,即得ABTS+·稀释液。分别吸取200μL稀释至适当浓度的样品溶液,加入4.8 mL ABTS+·稀释液,避光反应15 min,以无水乙醇作参比在734 nm波长处测定吸光度Ai;以等体积的无水乙醇代替样品溶液,同法操作,测定吸光度A0;以等体积的无水乙醇溶液代替ABTS+·溶液,同法操作,测定吸光度Ai0。将纯化后的石榴根皮提取物依次配制成 5、10、15、20、40、80、120、160、200、240、280、320 μg/mL 的样品溶液,用于对ABTS的清除作用测定,求出 IC50,并以 VC为参照。ABTS+·清除率按式(4)计算:
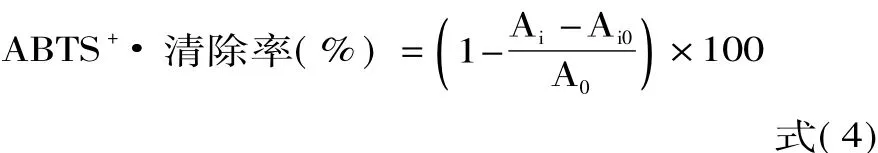
1.3 数据处理
PB试验设计和 CCD试验设计采用 Design-Expert 8.0.5统计分析软件,图形制作采用Excel数据处理软件。
2 结果与分析
2.1 单因素实验
由图1可知,药材粒度小于40目时,药材粉碎越细,石榴根皮多酚得率越高,当药材粒度为40目时,多酚得率达到最大值,此后药材粉碎越细,多酚得率反而降低,因此确定药材粒度为40目左右。乙醇体积分数在0~60%范围内,随着乙醇体积分数的增加,石榴根皮多酚得率呈上升趋势,在60%达到最大值,此后随着乙醇体积分数的提高,多酚得率反而下降,因此确定乙醇体积分数为60%左右。料液比在1∶5~1∶20 g/mL范围内,随着提取溶剂的增加,石榴根皮多酚得率呈上升趋势,在1∶20 g/mL时达到最大值,此后随着提取溶剂的增加,多酚得率反而下降,因此确定料液比为1∶20 g/mL左右。超声功率小于400 W时越大,石榴根皮多酚得率越高,当超声功率为400 W时,多酚得率达到最大值,此后随着超声功率的增大,多酚得率反而降低,因此确定超声功率为400 W左右。超声温度在25~45℃范围内,随着超声温度的提高,石榴根皮多酚得率呈上升趋势,在45~55℃时达到最大值,此后随着超声温度的提高,多酚得率反而下降,因此确定超声温度为45~55℃。超声时间在25~35 min内,超声时间越长,石榴根皮多酚得率越高,当超声时间为25~35 min时,多酚得率达到最大值,此后随着超声时间的延长,多酚得率反而降低,因此确定超声时间为25~35 min。
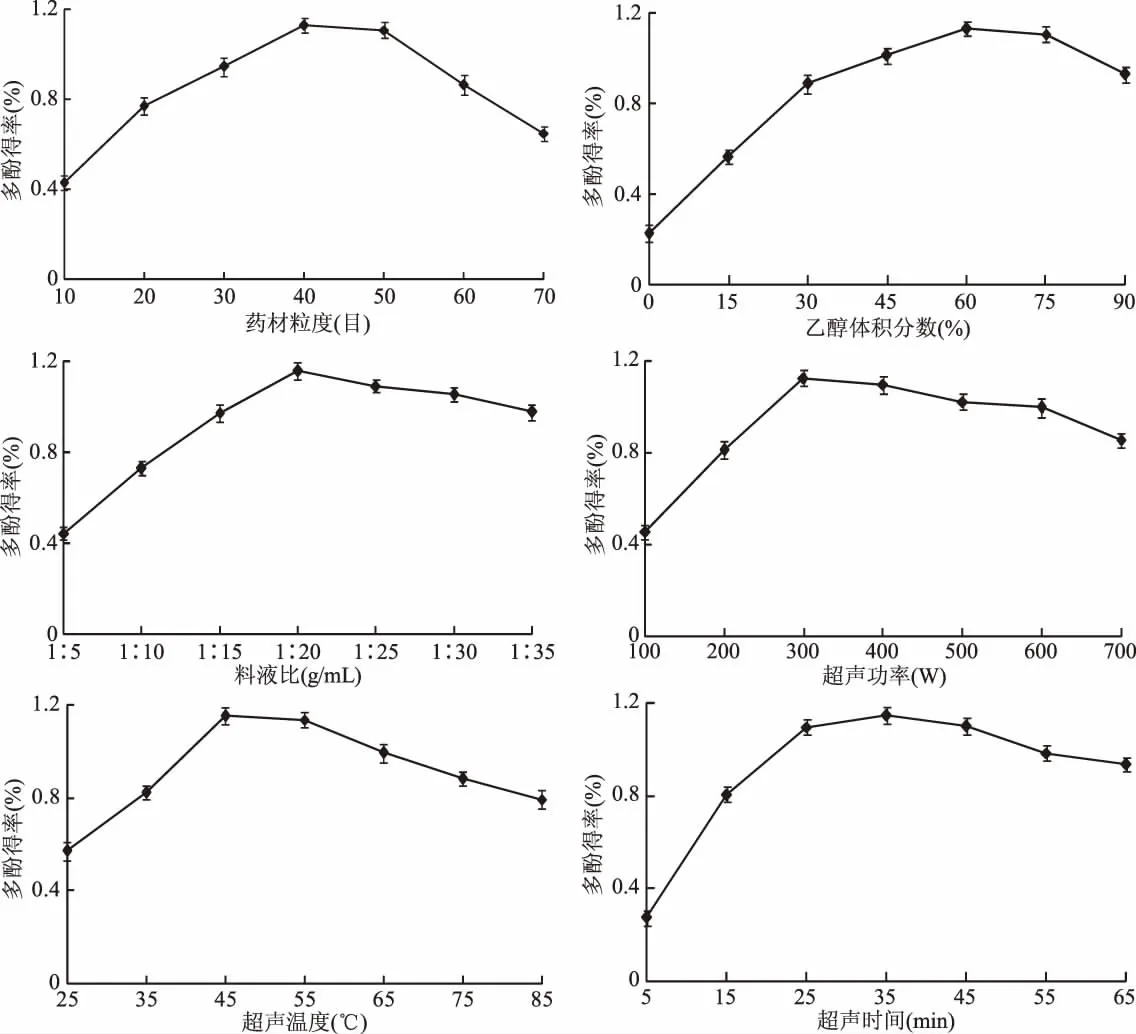
图1 各因素对石榴根皮多酚得率的影响Fig.1 Effects of factors on the extraction yield of polyphenols from pomegranate root bark
2.2 PB试验设计
根据Design-Expert 8.0.5统计分析软件所提供的方案安排试验,结果见表3。将表3中数据进行多元回归拟合及显著性检验,方差分析结果见表4。
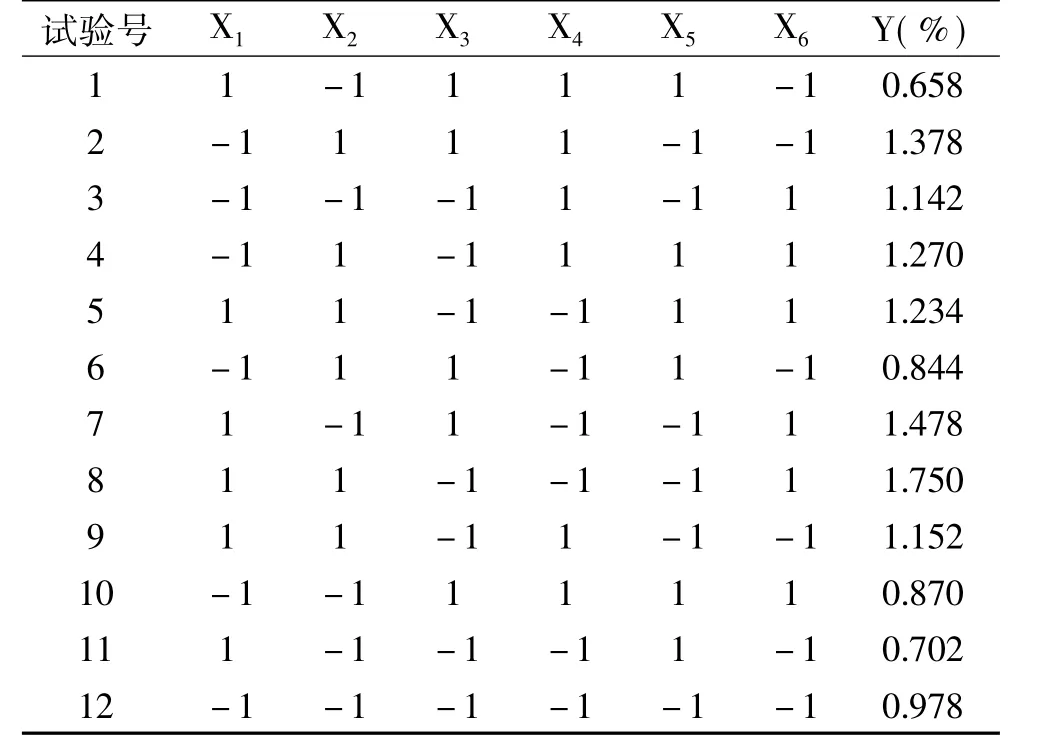
表3 PB设计方案及试验结果Table 3 Arrangement and corresponding results of PB design
由表4可知,模型的p=0.0029<0.01,达到极显著水平,相关系数 R2=0.9567,决定系数=0.9048,说明模型可信度高,可以应用该模型对试验结果进行分析和预测[18-19]。乙醇体积分数(X2,p=0.0036<0.01)、超声温度(X5,p=0.0012 <0.01)、超声时间(X6,p=0.0021<0.01)3个因素均达到极显著水平,其余因素不显著(p>0.05)。因此,在试验中重点优化乙醇体积分数、超声温度和超声时间3个因素。
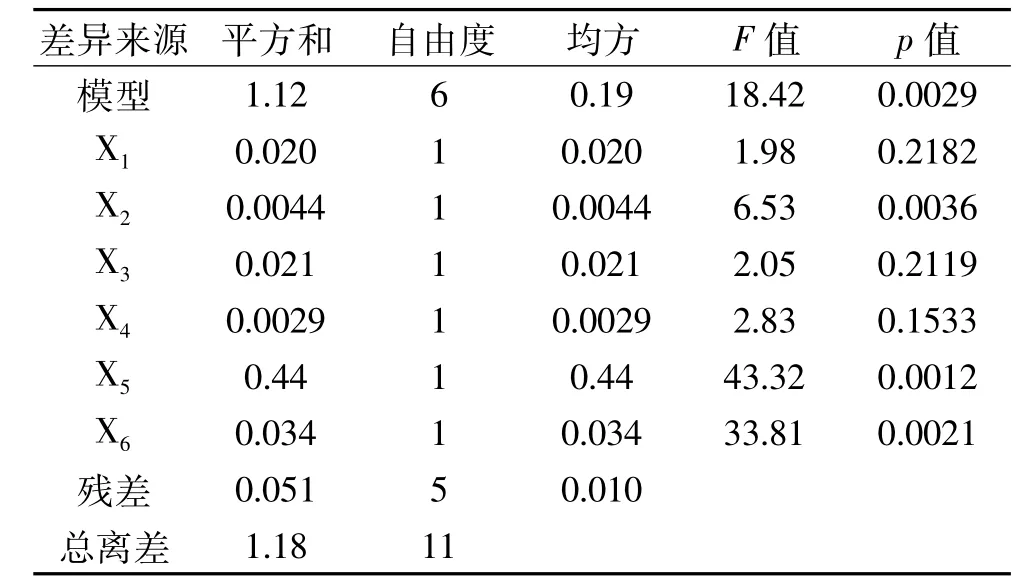
表4 PB试验方差分析结果Table 4 Results of variance analysis for PB design
注:p<0.05为差异显著,p<0.0001为差异极显著,p>0.05为差异不显著,表6同。从产物得率及节能环保等角度考虑,固定药材粒度为40目、料液比为1∶20 g/mL、超声功率为300 W。
2.3 CCD试验设计结果与分析
根据软件所提供的方案安排试验,对X2、X5和X6这3个影响显著的因素进行优化分析,结果见表5。将表5中数据进行多元回归拟合及显著性检验,方差分析结果见表6。
利用软件对表5的数据进行非线性回归得到二次多项式拟合,预测模型如下:
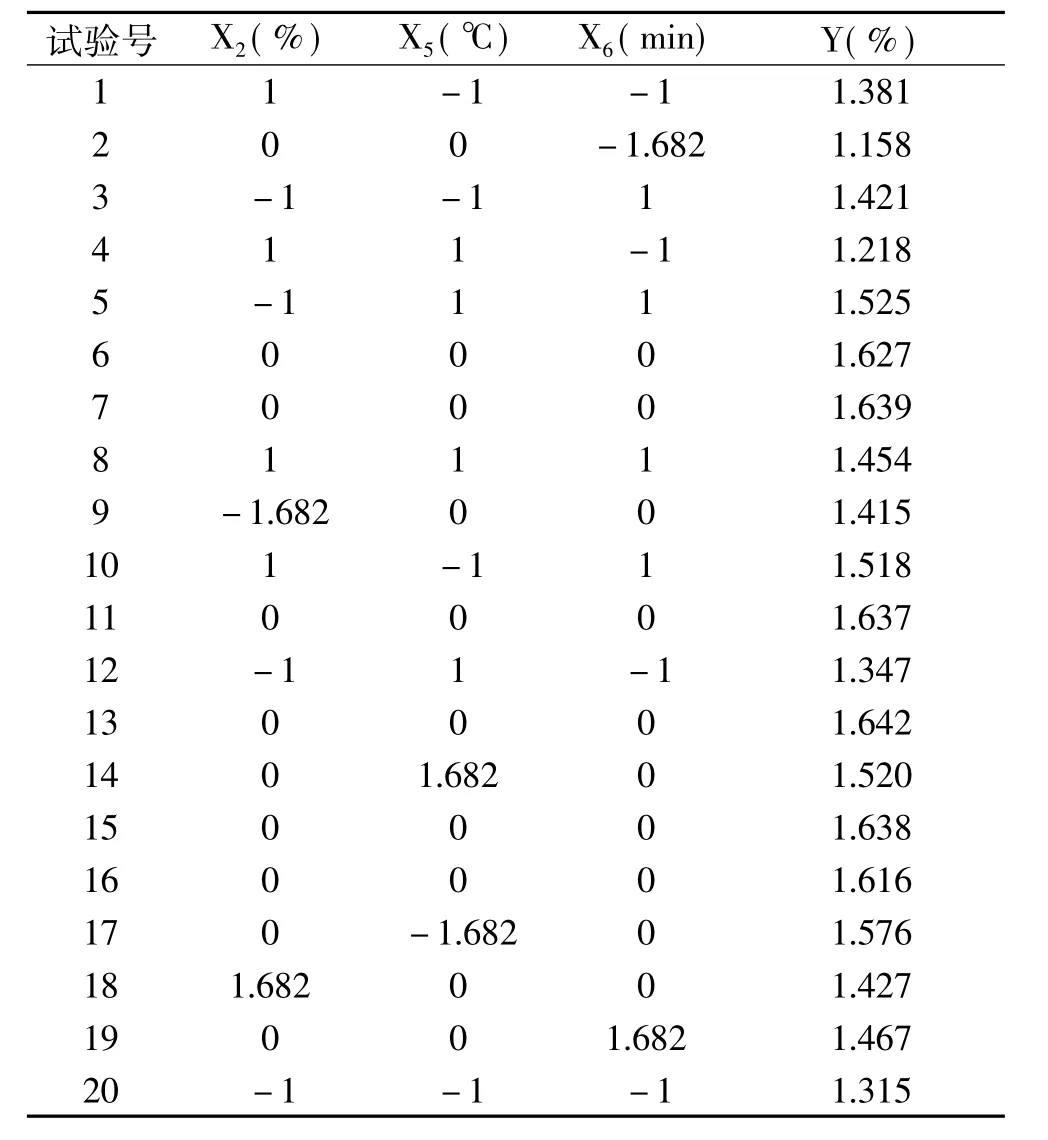
表5 CCD设计方案与试验结果Table 5 Arrangement and corresponding results of CCD design
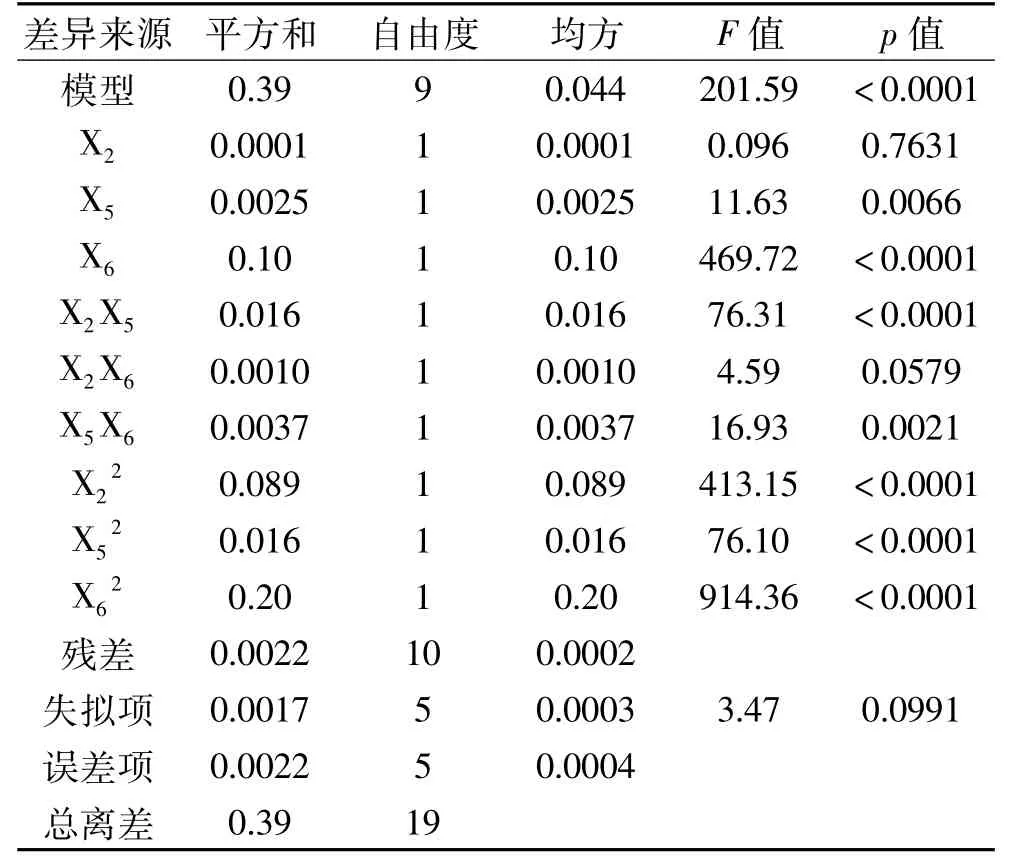
表6 CCD设计方差分析结果Table 6 Results of variance analysis for CCD design
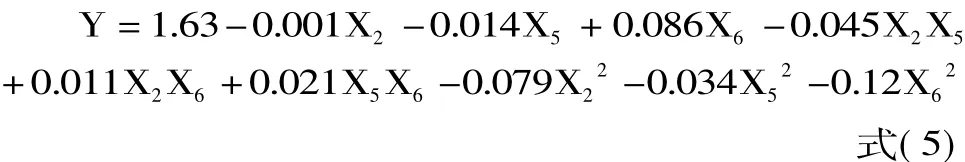
由表6可以看出,模型p<0.0001,达到极显著水平,失拟项(p=0.0991>0.05)不显著,相关系数R2=0.9945,决定系数 R2Adj=0.9896,变异系数0.99%,说明该方程拟合度良好,误差较小,可以应用该模型对试验结果进行分析和预测[19]。一次项 X5、X6,二次项及交互项X2X5、X5X6均达到极显著水平(p<0.01)。
响应面的坡度变化情况和等高线的稀疏程度均能直观反映各因素之间的交互影响情况,等高线呈圆形时表示两因素交互作用不显著,而呈椭圆形或马鞍形时则表示两因素交互作用显著[20-21]。由图2a可知,超声温度的曲面变化比乙醇体积分数陡峭,同时,等高线图中等温曲线变化密集程度高,说明超声温度比乙醇体积分数对多酚得率的影响大。同理,由图2b和2c可知,超声时间比乙醇体积分数对多酚得率的影响大,而超声时间比超声温度对多酚得率的影响大。
超声波辅助提取石榴根皮多酚的最佳工艺条件为:乙醇体积分数60.5%、超声温度49.4℃、超声时间31.8 min时,石榴根皮多酚得率模型预测值为1.650%,实际操作中稍作调整,确定的最佳工艺条件为:乙醇体积分数60%、超声温度49℃、超声时间32 min。测得石榴根皮多酚平均得率为1.643%,接近预测值,说明优化结果可信。
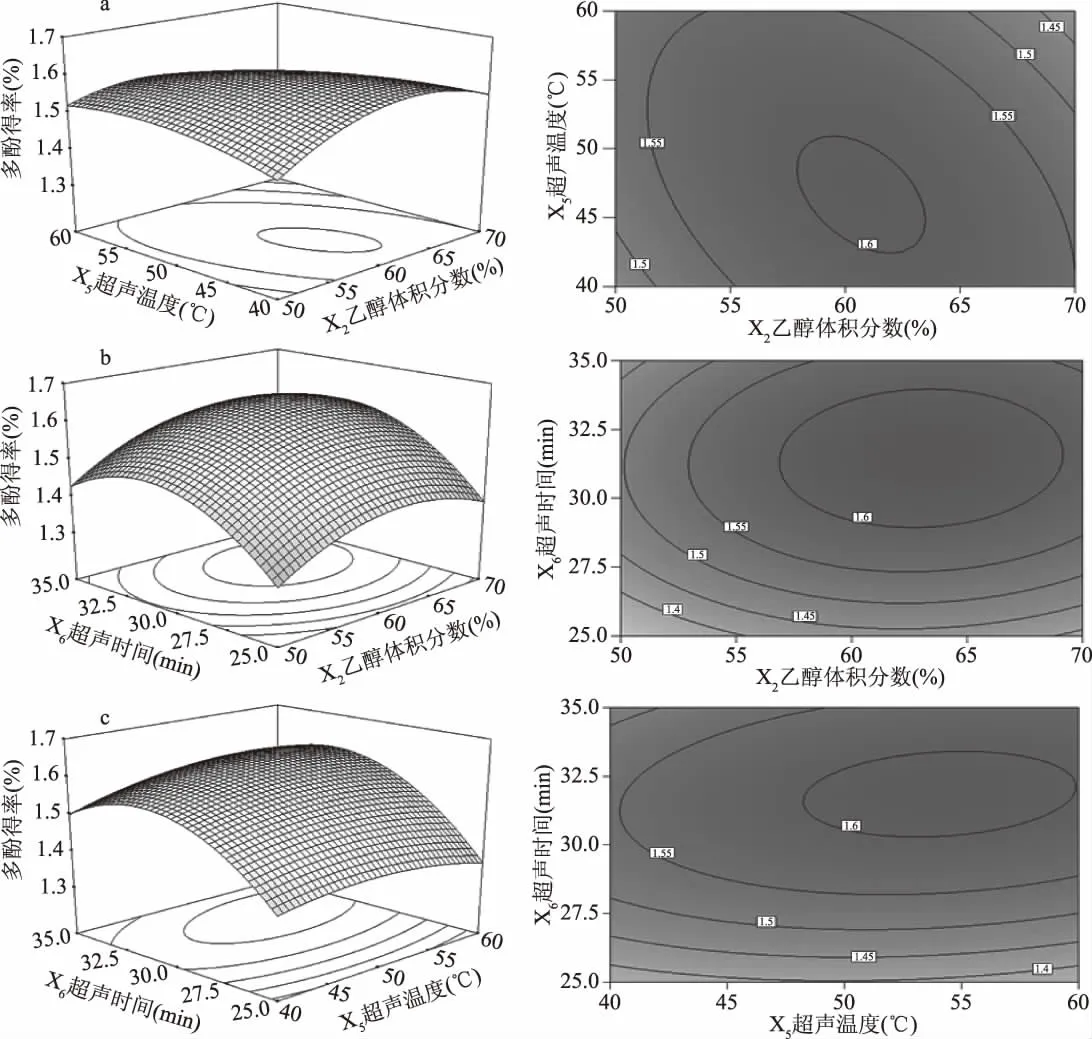
图2 各因素交互作用对多酚得率影响的响应面与等高线图Fig.2 Response surface and contour plot showing the interactive effects of the yield of polyphenols
2.4 石榴根皮多酚抗氧化活性分析
2.4.1 石榴根皮多酚对DPPH自由基清除作用 石榴根皮纯化物纯度约为78%。由图3可知,在2.5~120μg/mL范围内,石榴根皮对DPPH自由基的清除率,随着自身浓度的增加而逐渐升高,当浓度为120μg/mL时,清除率达到70.3%。多酚浓度与对DPPH自由基清除率之间的拟合的线性方程为y=0.463x+17.05,R2=0.989。通过拟合方程算出清除作用的 IC50=71.166 μg/mL[22]。邓娜等[3]研究了石榴其它部位中多酚类成分对DPPH自由基清除作用,结果表明石榴皮、石榴籽和石榴瓤中多酚类成分对DPPH自由基清除作用的 IC50分别为82.161、110.356和171.987μg/mL,均高于本实验中石榴根皮多酚的71.166μg/mL。可见,石榴根皮和石榴其它部位相比,其多酚类成分具有较强的DPPH自由基清除能力。
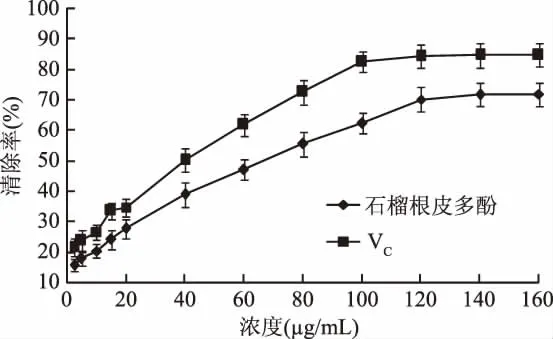
图3 石榴根皮多酚及VC对DPPH自由基的清除作用Fig.3 Scavenging effects of polyphenols from pomegranate root bark and VC on DPPH free radical
2.4.2 石榴根皮多酚对ABTS+·清除作用 由图4可知,在5~240μg/mL范围内,随着多酚浓度的增加,其对 ABTS+·的清除率逐渐升高,当浓度为240μg/mL时,清除率达到65.7%。多酚浓度与对ABTS清除率之间的拟合的线性方程为y=0.226x+13.09,R2=0.994。通过拟合方程算出清除作用的IC50=163.319 μg/mL,范金波等[23]研究了白藜芦醇、芦丁和根皮素等多酚类成分对ABTS+·的清除作用,结果表明3种多酚类成分对ABTS+·清除作用的IC50依次为56.0、138.0和160.0μg/mL,而本实验中石榴根皮多酚的IC50为163.319μg/mL。可见,石榴根皮多酚类成分对ABTS+·的清除作用的IC50接近于常见的根皮素类成分,具有一定的ABTS+·清除能力。
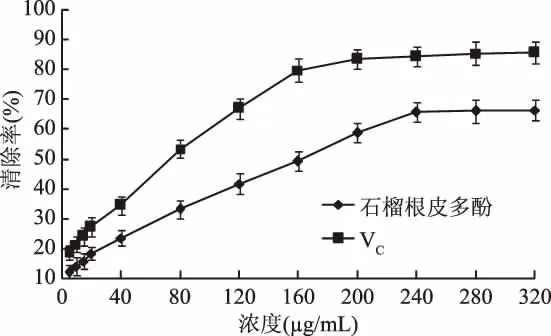
图4 石榴根皮多酚及VC对ABTS的清除作用Fig.4 Scavenging effects of polyphenols from pomegranate root bark and VC on ABTS
3 结论
本课题以石榴根皮为材料,采用 Plackett-Burman试验设计结合Central Composite Design试验设计,优选出超声波辅助提取石榴根皮多酚最佳工艺条件为:乙醇体积分数60%、超声温度49℃、超声时间32 min,按照此工艺进行试验操作,得到多酚平均得率为1.643%,这与理论值1.650%相符,表明所选用的回归模型对试验结果拟合较好。石榴根皮多酚抗氧化活性试验结果表明,石榴根皮中多酚类成分具有较好的清除DPPH自由基和ABTS+·能力,其IC50相应为71.166μg/mL和163.319μg/mL。其在一定的浓度范围内,石榴根皮多酚与抗氧化活性之间呈现正相关关系,石榴根皮多酚具有一定的抗氧化活性。本研究为石榴根皮的充分开发利用,助力于石榴资源的产业化发展提供了理论支撑。

