响应面法优化野菊花多糖的水解工艺
牛 放,高俊明,段雪薇,郑 放,田 薇
(浙江农林大学林业与生物技术学院,浙江杭州311300)
野菊花(Chrysanthemum indicum flowers)为多年生草本植物野菊的干燥头状花序[1],具有清热解毒、清肝明目的功效,用于缓解破血疏肝、解疗散毒、头痛眩晕等症状[2-4]。近些年来,植物多糖由于具有广泛的生物学活性和相对低的毒性,已经引起了许多专家学者的关注[5]。然而,多糖化学结构复杂且有较大的相对分子质量,多糖质量控制一直难以把控。野菊花中的活性成分较多[6],其活性与其相对分子质量、化学组成、苷键构型、连接方式和空间构型有关[7],为了解野菊花多糖的特性,可以采用水解反应,分析单糖组成及含量的变化,为进一步为野菊花多糖的质量控制提供依据。
已有报道中涉及多糖水解的研究局限于部分酸水解,水解产物的基本结构常具有代表性,有利于进行各种分析。徐春梅等[8]在魔芋葡甘露聚糖的水解条件的研究以及杜秉健等[9]人在南瓜多糖水解过程的研究中,皆采用平均聚合度来评价水解程度,但低聚糖的聚合度不能说明多糖完全水解成单糖,而只能说明多糖被降解;缪月秋等[10]研究了葫芦巴中性多糖酸水解和胡尧超等[11]关于油茶籽油优化糖化的研究是以寡糖或还原糖的产量判断其水解程度,也没有明确提出多糖被完全降解。为了确保良好的单糖回收并对单糖结构进行测定,多糖水解的最佳优化条件应该完全水解成单糖,而不是部分酸水解[12]产生寡糖。鲜有研究通过单糖产率来评估水解程度,也没有关于使用响应面试验优化野菊花多糖水解条件的报道。前人研究表明,控制水解时间、水解温度和酸的浓度[13]等条件可以达到不同程度的水解目的。随着实验步骤的简化,更多实验选用三氟乙酸(TFA)来水解植物多糖[14],一方面三氟乙酸可以有效地水解糖苷键,且不会过多地损害多糖的结构,另一方面三氟乙酸经减压蒸发可除去,避免了传统的中和步骤。
本文以野菊花为实验对象,通过单因素实验,确定水解时间、温度和三氟乙酸用量对野菊花多糖水解的影响。在单因素实验的基础上,以气相色谱图中单糖总峰面积为指标,利用响应面试验,优化野菊花多糖的水解工艺,为确定野菊花多糖的结构奠定理论基础。
1 材料与方法
1.1 材料与仪器
野菊花 采自浙江省遂昌县野菊种植基地,经浙江农林大学田薇教授鉴定为菊科菊属植物野菊(Chrysanthemum indicum L.)的花序;三氯乙酸(TCA)、三氟乙酸(TFA)、正丁醇、过氧化氢、氯化钠、氢氧化钠、无水乙醇、盐酸、氨水、磷酸二氢钾、三氯甲烷(氯仿) 均为国产分析纯化学试剂;DEAE-52纤维素、Sephadex G-100 北京索莱宝生物科技有限公司;1-苯基-3-甲基-5-吡唑啉酮(PMP) 阿拉丁试剂(上海)有限公司;葡萄糖(Glu)、木糖(Xyl)、半乳糖 (Gal)、阿拉伯糖(Ara)、鼠李糖(Rha)、果糖(Fru)、甘露糖(Man)标准品 纯度≥99%,上海源叶生物科技有限公司;蒸馏水 实验室自制。
DZG-6050型真空干燥箱 上海森信实验仪器有限公司;HH-4数显恒温水浴锅 国华电器有限公司;Spectrumlab 22PC可见分光光度计 上海沪粤明科学仪器有限公司;TU1800紫外可见分光光度计 北京普析通用仪器有限公司;VirTis Benchtop SLC型冻干机 美国VirTis公司;Agilent GC-7890B气相色谱仪、氢火焰离子化检测器(FID) 美国Agilent公司;粉碎机 北京田园机械技术有限公司;SHB-D(Ⅲ)循环水式真空泵 杭州明远仪器有限公司;R-201旋转蒸发仪 上海申顺生物科技有限公司;AR1140分析天平梅特勒-托利多仪器制造有限公司;透析袋(3500) 上海源叶生物科技有限公司。
1.2 实验方法
1.2.1 野菊花多糖的提取与纯化 根据房海灵等[15]的方法改进后提取野菊花多糖,前期房海灵等研究野菊花多糖含量只以葡萄糖为研究对象,忽略了其他单糖组成,经完善后具体方法如下:将收集到的野菊花用粉碎机打粉后,放入烘箱70℃烘干12 h,取干燥后的野菊花粉末200 g于烧杯中,加入25倍体积的蒸馏水,于90℃水浴锅提取约3 h,过滤,重复3次,合并滤液浓缩至约200 mL;加入5倍体积的95%乙醇沉淀,在4℃下温育12 h,离心(4000 r/min,5 min)后,再次加入95%乙醇洗涤两次,最后收集沉淀物。
为了提高多糖的纯度,用Sevag法[16]除去游离蛋白,将除蛋白后的多糖溶液加入1/6体积的30%过氧化氢搅拌均匀,滴加氨水使pH=7.8,置于50℃水浴孵育3 h,冷却过滤并浓缩,收集滤液;再加入4~5倍95%的乙醇过夜,过滤收集沉淀,将沉淀物完全溶解于蒸馏水中配成10 mg/mL的粗多糖溶液,装入透析袋(3500)中在蒸馏水中透析72 h;收集透析袋内的多糖溶液(截留Mw>3500)再次用95%乙醇沉淀滞留物部分,经浓缩后冷冻干燥[17],最终得到多糖样品。
1.2.2 野菊花多糖的水解 鉴定多糖中的单糖组成,需先将多糖水解再进行测定。野菊花多糖的水解采用三氟乙酸法[18]:准确称取纯化后的野菊花多糖样品100 mg于10 mL的安培瓶中,加入一定量的2 mol/mL的三氟乙酸,用酒精灯加热封口,烘箱调至一定温度后,水解一定时间,冷却后用滤膜过滤除去不溶物,将所得滤液经减压旋蒸除去三氟乙酸,加入少量甲醇,再次蒸干,如此重复三次,以彻底除去残留的三氟乙酸,最后定容至5 mL。
1.2.2.1 单因素实验 本实验以水解出来的单糖峰面积为指标,考察水解温度、水解时间和三氟乙酸用量对单糖峰面积的影响。固定三氟乙酸用量为3 mL,水解时间为8 h,分别设置水解温度为80、90、100、110、120℃;固定三氟乙酸用量为3 mL,水解温度为100 ℃,分别设置水解时间为4、6、8、10、12 h;固定水解温度为100℃,水解时间为8 h,分别设置三氟乙酸用量为1、2、3、4、5 mL。每个实验平行三次,结果取平均值。
1.2.2.2 响应面优化试验 在单因素实验基础上,依据 Design-Expert 8.0.6 Trial软件,运用 Box-Behnken中心组合实验设计原理[19-20],以水解时间(A)、水解温度(B)、三氟乙酸用量(C)三个因子为自变量,以野菊花多糖水解出来的单糖总峰面积(Y)为响应值,对野菊花多糖的水解条件进行优化,响应面试验的因素及水平见表2。
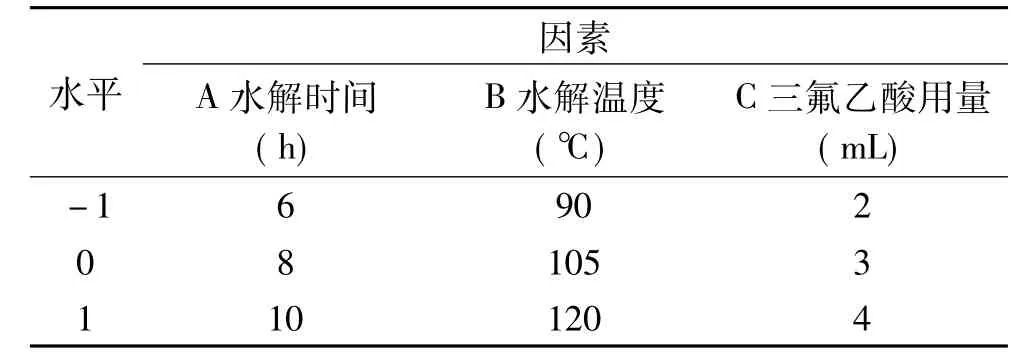
表2 响应面试验因素水平表Table 2 Factors and levels table of response surface experiment
1.2.3 野菊花多糖的衍生化 水解条件是影响单糖测定的主要因素,通过不同水解条件进行衍生化来测定纯化后野菊花多糖的单糖组成[21]。衍生化方法如下:水解后的野菊花多糖样品加蒸馏水定容至10 mL,单糖标品 (Glu、Xyl、Gal、Ara、Rha、Fru 和Man)各10 mg加入蒸馏水定容至10 mL,随即取0.5 mL于10 mL容量瓶中,向其加入0.5 mL 0.5 mol/L的PMP甲醇溶液和0.5 mL 3 mol/L的NaOH溶液,充分振荡,于70℃水浴反应60 min,取出冷却至室温,加入0.5 mL 0.3 mol/L的盐酸溶液;再加1 mL氯仿萃取,静置30 min,移去下层液体重复三次;蒸馏水定容至10 mL过滤,所得滤液供气相分析。
1.2.4 气相色谱条件 采用HP-5(30 m×320μm×0.25μm)弹性石英毛细管柱;检测器温度260℃,分流比25∶1,进样量 1 μL,氢气流速 30 mL,空气流速400 mL;程序升温:起始温度125 ℃,以1 ℃·min-1上升到128℃,保持5 min,之后先以0.1℃·min-1上升至129℃,再以1℃·min-1上升到140℃,最后以5 ℃·min-1上升到280 ℃。
1.3 数据处理
实验数据通过ANOVA程序进行方差分析,使用统计软件(Design-Expert 8.0.6)设计响应面试验分析。
2 结果与分析
2.1 单因素实验
2.1.1 时间对野菊花多糖水解作用的影响 在多糖水解过程中选择合适的反应时间尤为重要。结果如图1所示,随着水解时间的增加,野菊花多糖的水解速率加快,在8 h单糖峰面积均达到最大,随后单糖峰面积保持不变,说明水解已经达到完全;可见时间对野菊花多糖水解有一定影响,最佳水解时间为8 h。
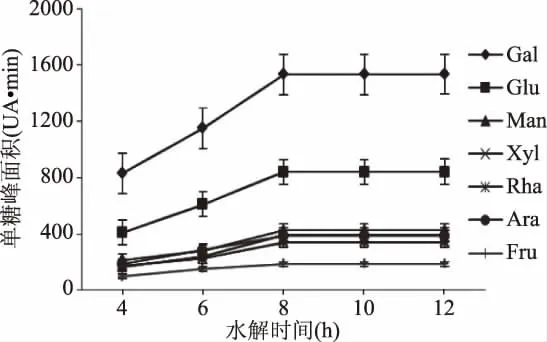
图1 水解时间对野菊花多糖水解作用的影响Fig.1 Effect of hydrolysis time on the hydrolysis of Chrysanthemum polysaccharides
2.1.2 温度对野菊花多糖水解作用的影响 多糖的单糖组成是表征其结构的重要参数,单糖的组成及含量不同影响多糖的药理活性,升温可以使多糖的糖苷键断裂水解成单糖。由图2可知,温度越高,多糖水解的速率加快,各个单糖的峰面积迅速增加,从100℃开始趋于稳定,到120℃单糖峰面积不变,说明多糖水解趋于完全;温度过高导致能量的浪费。因此最适宜的水解温度为100℃。
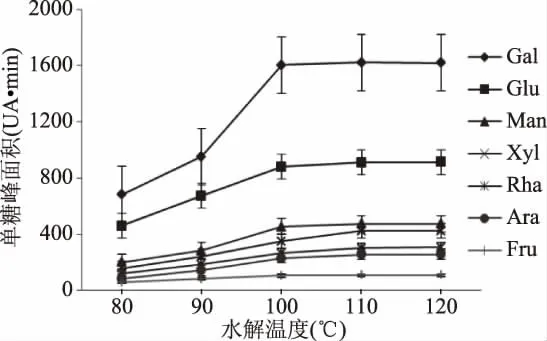
图2 温度对野菊花多糖水解作用的影响Fig.2 Effect of temperature on hydrolysis of Chrysanthemum polysaccharides
2.1.3 三氟乙酸用量对野菊花多糖水解作用的影响 酸的浓度是影响多糖水解速率的重要因素。如图3所示,各个单糖的峰面积随着三氟乙酸用量的增加而增大,三氟乙酸用量为3 mL时达到最大,随后降低,但变化程度不大;随着三氟乙酸浓度的增加,大部分单糖含量增加,但野菊花多糖随着三氟乙酸浓度的增加会使单糖的含量降低,这个可能与多糖的类型和性质有关;故选择3 mL的三氟乙酸用量为最佳。
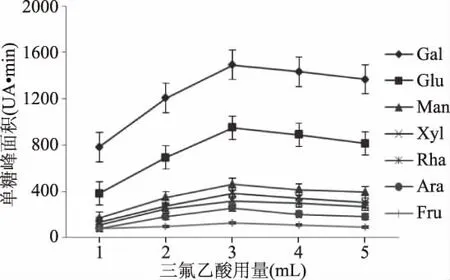
图3 三氟乙酸用量对野菊花多糖水解作用的影响Fig.3 Effect of the amount of trifluoroacetic acid on the hydrolysis of Chrysanthemum polysaccharides
2.2 响应面试验结果
2.2.1 响应值的选取 通过单因素实验的结果发现,野菊花多糖水解后产生的单糖包括鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖、果糖,说明野菊花多糖完全水解可生成7种单糖,因此选取这7种单糖的峰面积和作为响应面设计中的响应值,以七种单糖的总峰面积达到最大为目标,通过响应面设计,优化野菊花多糖水解的最佳条件。
2.2.2 响应面试验设计及结果 在单因素实验结果基础上进行响应面分析,结果见表3。在本实验中,第1~9组为析因实验,第10~12组为中心实验。析因点和零点构成12个实验点,以析因点为自变量,在A、B、C构成的三维空间中取值,区域的中心作为零点,重复3次零点实验来估计实验误差。
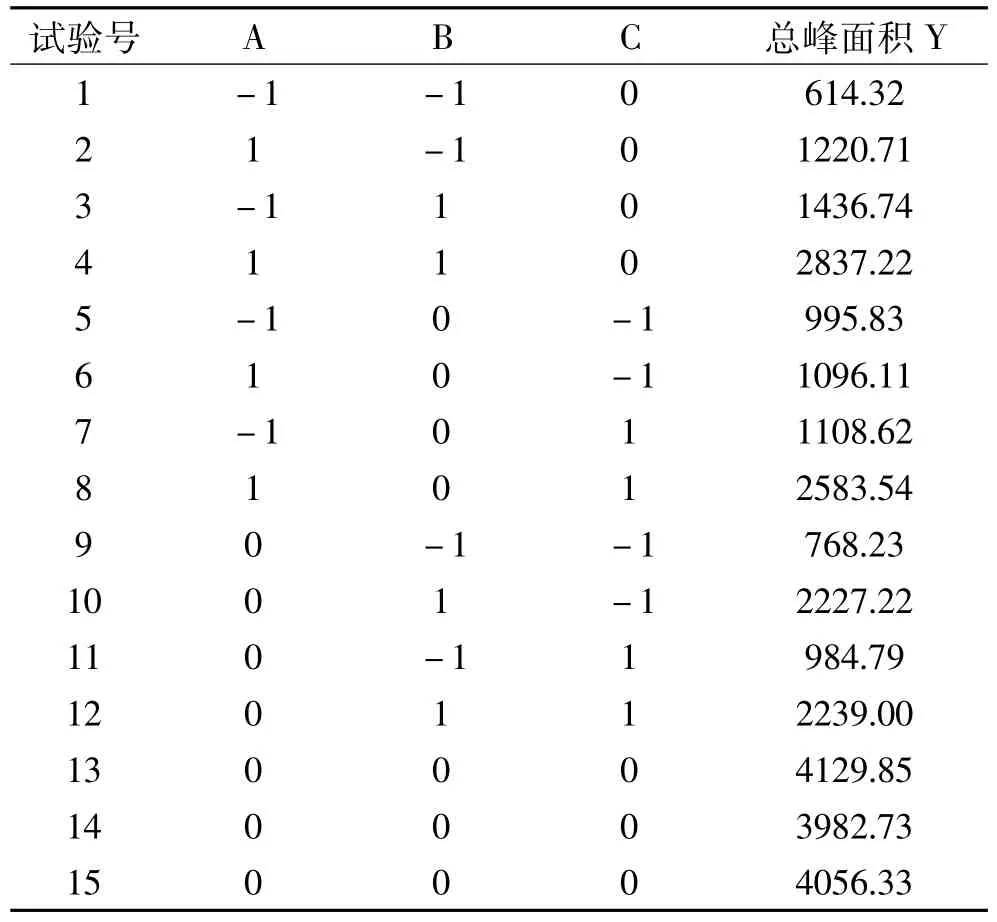
表3 响应面试验设计及结果Table 3 Design and results of response surface experiment
利用Design-Expert 8.0.6软件对表2中所得的实验数据进行分析,以总峰面积Y对自变量进行模型拟合,通过决定系数(R2)和方差分析对拟合模型进行评价,通过比较各拟合方程的拟合度,得到二次多项回归拟合方程:Y=4056.27+447.76A+644.03B+228.56C+198.52AB+343.65AC-51.17BC-1318.91A2-1210.13B2-1291.36C2
对模型进行二项式模型的ANOVA方差分析[22]见表4。从方差分析和决定系数来考察模型的可靠性。由表4中可知,模型p<0.001,表明回归方程呈极显著,在统计学上有意义;失拟项p=0.0577(>0.05)不显著;该模型R2=0.9428,表明这种方法可靠,该方程模拟真实分析有现实意义;因子B和模拟项的二次项 A2、B2、C2值达到了极显著水平(p<0.001),因子A和因子C以及因子AC也达到了显著水平(p<0.05);结合F值可以看出,3个因素对总峰面积的影响顺序分别为:B>A>C;该模型=0.9643,说明该模型实验拟合度好。

表4 回归模型的方差分析Table 4 Analysis of variance of regression model
2.2.3 响应面曲面分析 采用Design-expert 8.6.0软件对实验结果进行分析,作出响应面的3D和等高线分析图,可以形象地反应出各自变量对总峰面积的影响。由图4~图6可知,在所选范围内存在极值即响应面最高点,也是等值线最小椭圆的中心点,曲面坡度大,说明变化明显;响应面图能较直观反映出各因素与响应值的关系及各个因素间的交互作用,由图4~图6中可知,水解时间与三氟乙酸用量这两者之间存在显著的交互作用。而水解时间和水解温度之间无显著交互作用,水解温度和三氟乙酸用量之间也无显著交互作用,与方差分析结果一致。

图4 水解温度和水解时间对总峰面积影响的响应面及等高线图Fig.4 Response surface and contour map of the effect of hydrolysis temperature and hydrolysis time on total peak area
2.3 验证试验
响应面试验预测的最佳水解条件为:水解时间8.75 h,水解温度109.19℃,三氟乙酸用量3.20 mL,模型预测值为4162.26。为了检验模型的可行性,考察预测结果的可靠性,在优化的工艺参数下进行验证实验,考虑到实际操作条件,实际校正后将最佳工艺参数修正为:水解时间9 h,水解温度110℃,三氟乙酸用量3 mL。在优化条件下,每个单糖的峰面积为:半乳糖1630.03,葡萄糖921.28,甘露糖482.27,木糖425.03,鼠李糖312.87,阿拉伯糖263.03,果糖116.84,所得总峰面积为4151.35,与模型预测值相对误差为0.26%,接近且略低于预测值(所得数值均为三次实验数据所选取的平均值);由此证明实验模型合理,在优化条件下实验结果理想。图7为优化条件下进行的样品及标准单糖气相色谱图。因此,采用响应面试验对野菊花多糖水解条件进行优化是可行的。

图5 三氟乙酸用量和水解时间对总峰面积影响的响应面及等高线图Fig.5 Response surface and contour map of the effect of the amount of trifluoroacetic acid and the hydrolysis time on the total peak area
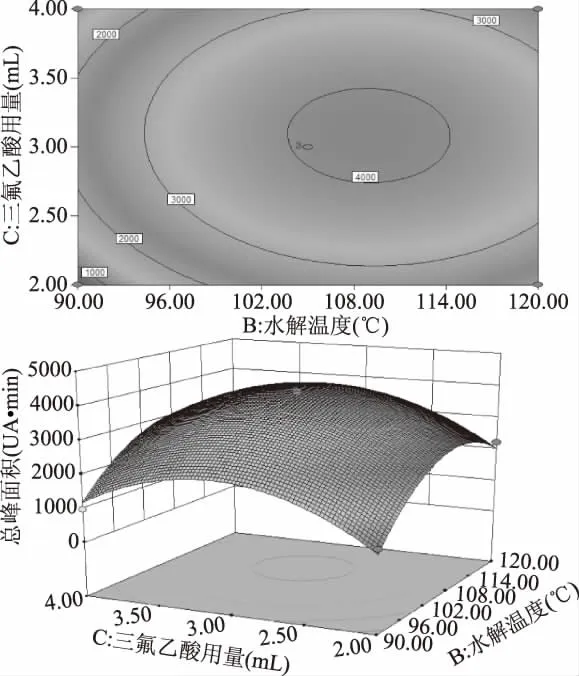
图6 三氟乙酸用量和水解温度对总峰面积影响的响应面及等高线图Fig.6 Response surface and contour map of the effect of the amount of trifluoroacetic acid and the hydrolysis temperature on the total peak area
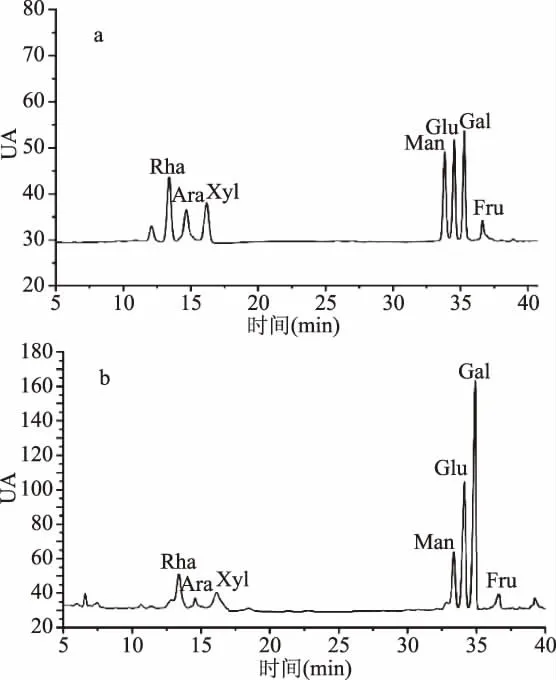
图7 标准单糖和样品气相色谱图Fig.7 Standard monosaccharide and sample GCchromatogram注:a:标准单糖衍生物;b:样品衍生物。
3 讨论与结论
本实验考虑到野菊花多糖的完全水解条件,采取将多糖水解后的产物进行PMP柱前衍生化,后经气相分析进行单糖测定来评测多糖是否水解完全,选取单糖总峰面积作为响应值也能准确反映出野菊花多糖水解的完全程度。陆颖等[23]在野菊花多糖和金红英等[24]人在野菊花中性多糖的研究中均发现了6种单糖,未发现果糖,与本实验结果有差异;可能与其未完全水解野菊花多糖和用糖腈乙酸酯衍生化法衍生有关,其他原因有待进一步研究。本文最终确定的最佳水解工艺为:水解时间9 h,水解温度110℃,三氟乙酸用量3 mL,且在该水解条件下经过气相色谱测得的总峰面积最大,为4151.35,与模型预测值相对误差为0.26%。本实验将水解程度与气相色谱峰面积相结合,简便、快捷、稳定地评价水解程度;研究结果为基础结构和单糖组分的研究奠定了良好的基础。

