西瓜叶片防御酶活性与枯萎病抗性的关系
,年来
(1.甘肃省农业工程技术研究院,甘肃 武威 733006; 2.甘肃农业大学 园艺学院,甘肃 兰州 730070)
西瓜[Citrulluslanatus(Thunb) Manf.]是葫芦科西瓜属1年生蔓性草本植物,原产非洲[1]。我国是世界上西瓜生产与消费量最大的国家,2010年西瓜种植面积和产量分别达181.25万hm2和6818.1万t[2],西瓜产业在我国农业生产中占据着重要地位,在农业结构调整与农民增收中发挥着重要作用[3]。西瓜枯萎病是由半知菌亚门镰刀菌属(FusariumLink ex Fr.)尖孢镰刀菌西瓜专化型(Fusariumoxysporumf.sp.niveum,FON)侵染引起的真菌土传病害,随着西瓜种植面积的扩大,轮作倒茬日益困难,西瓜枯萎病大面积发生和流行[4],严重制约了我国西瓜产业的可持续发展[5]。因此,开展西瓜枯萎病抗性研究对于西瓜高产高效生产具有重要意义。
邹芳斌等[6]、赵秀娟等[7]、刘守伟等[8]、GIROUSSE等[9]对病原菌侵染后寄主植株的各种生理生化代谢反应与抗病性的关系进行了研究,发现植物体在受病原菌侵染后,作为苯丙烷类代谢定速酶的苯丙氨酸解氨酶( PAL),参与酚类氧化或缩合的过氧化物酶(POD)[10]、多酚氧化酶(PPO)[11]和具有保护作用的超氧化物歧化酶(SOD) 等的活性会发生显著变化。丁九敏等[12]在霜霉病菌侵染黄瓜试验中发现,抗病品种黄瓜叶片SOD活性极显著高于感病品种,叶片的SOD活性与霜霉病抗性呈正相关。吴岳轩等[13]对水稻白叶枯病、周晓慧等[14]对甜瓜蔓枯病的研究发现,POD[13]、过氧化氢酶(CAT)[14]活性均与抗性呈正相关。徐敬华等[15]研究发现,PAL活性表达呈周期性变化,叶片是PAL活性高效表达的部位,其酶活性与西瓜枯萎病抗性呈正相关。可见,植物的抗(耐)病性与其体内的防御酶活性密切相关,但采用国际上公认的西瓜枯萎病鉴别寄主来研究植株受侵染后抗性相关酶活性与抗病性的关系鲜见报道。
本试验以西瓜枯萎病鉴别寄主(高抗品种PI296341-FR、轻抗品种Crimson Sweet和高感品种Sugar Baby)为材料,采用西瓜枯萎病菌孢子悬浮液进行人工接种,比较分析了抗感性不同西瓜品种接种枯萎病菌前后叶片SOD、POD、PPO、PAL、CAT活性的变化,以期为进一步阐释西瓜枯萎病生化抗性机制提供理论依据。
1 材料和方法
1.1 试验材料
选用对尖孢镰刀菌西瓜专化型1号生理小种具有不同抗性的3个西瓜品种[5]:高抗品种PI296341-FR(C.lanatusvar.citroides)、轻抗品种Crimson Sweet(C.lanatusvar.lanatus)和高感品种Sugar Baby(C.lanatusvar.lanatus),种子由国家蔬菜工程技术研究中心提供。
供试菌种:西瓜枯萎病菌选用国际公认的尖孢镰刀菌西瓜专化型1号生理小种,由甘肃省农业科学院植物保护研究所何苏琴研究员提供。供试菌种于试验前进行复壮,单孢纯化。
1.2 西瓜枯萎病菌孢子悬浮液的制备
病原菌于马铃薯葡萄糖琼脂(PDA)培养基上培养7 d,然后用手持打孔器将西瓜枯萎病菌菌片转接到马铃薯蔗糖(PS)液体培养基中,每个50 mL三角瓶接3片,放入摇床在28 ℃、120 r/min条件下恒温振荡培养7 d。再用双层消毒纱布过滤,菌液经5 000 r/min离心20 min,弃去上清液得到白色孢子沉淀,加无菌蒸馏水适当稀释,经Neubauer血球计数板(0.1 mm,1/400 mm2)计算,配成浓度为1×106个/mL的孢子悬浮液,作侵染菌液备用。
1.3 育苗及接种处理
供试西瓜种子用0.1%的高锰酸钾溶液浸泡30 min,温汤(50~55 ℃)浸种6 h 后,用湿毛巾包裹置于28 ℃恒温培养箱内催芽,待种子露白后选择芽长基本一致的种子播种于穴盘灭菌基质(按V蛭石∶V珍珠岩=3∶1混合)中,在25~28 ℃温室内进行育苗。子叶生长期每穴每隔7 d浇灌一次5 mL 1/2 Hoagland营养液,真叶展出后每穴每隔4~5 d浇灌一次5 mL Hoagland完全营养液。待幼苗长至三叶一心时,采用灌根法[16]进行接种处理,在距幼苗根部0.5~1 cm处用注射器注入5 mL孢子悬浮液。接种处理每品种接菌24株,不接种处理以灌蒸馏水作为对照(CK),每品种灌蒸馏水24株,3次重复。
1.4 取样方法
分别于接种前0 d,接种处理后1、2、3、4、5 d取自上而下第2片充分展开的叶片,每个处理随机取10株,3次重复,将每个处理的样品称质量后(约2.5 g)放入-80 ℃超低温冰箱保存作为待测样本。
1.5 酶活性测定
SOD活性测定参照裴斌等[17]的方法,采用氮蓝四唑(NBT)法测定,以抑制NBT光化学还原50%为1个酶活性单位(U);POD活性测定参照李合生[18]的方法,采用愈创木酚法测定,以愈创木酚为底物,以1 min内OD470变化0.2为1个酶活性单位(U);PPO活性测定参照李合生[18]的方法,采用邻苯二酚法测定,以0.02 mol/L邻苯二酚为底物,以1 min内OD398变化0.001为1个酶活性单位(U);PAL活性测定参照李合生[18]的方法,采用苯丙氨酸法测定,以0.02 mol/L L-苯丙氨酸为底物,以OD290变化0.01为1个酶活性单位(U);CAT活性测定参照裴斌[17]的方法,采用紫外吸收法测定,以1 min内OD240降低0.1为1个酶活性单位(U)。每个酶活性指标重复测定3次,取其平均值。
1.6 数据处理
采用Microsoft Excel(2007版) 计算试验数据并作图,用SPSS 19.0软件对数据进行单因素方差分析,并运用Duncan’s检验法进行多重比较。
2 结果与分析
2.1 不同抗性西瓜品种叶片的SOD活性变化
随着接种后时间的延长,3个对照西瓜品种叶片SOD活性变化不大,接菌处理后,抗病品种叶片SOD活性显著升高,3个西瓜品种叶片SOD活性变化均呈现先升高后下降的趋势(图1)。接种后,高抗品种PI296341-FR和轻抗品种Crimson Sweet叶片SOD活性迅速增加,均在第2天达到峰值,分别较各自未接种对照增加了58.98%、73.01%(P≤0.05),较感病品种Sugar Baby分别增加了47.62%、34.56%(P≤0.05),之后开始下降。而感病品种Sugar Baby在接种后第3天叶片SOD活性才达到峰值,较接种处理前0 d增加了36.60%(P≤0.05),之后活性开始下降。从3个品种的SOD活性变化来看,接种西瓜枯萎病菌可显著提高西瓜叶片SOD活性,抗病品种酶活性峰值出现时间早于感病品种,抗病品种叶片SOD活性变化幅度显著高于感病品种。
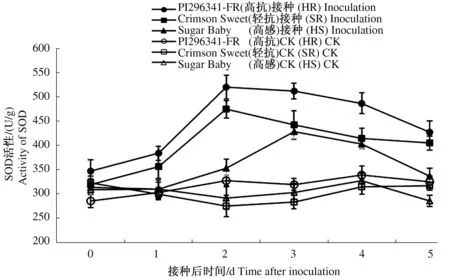
图1 接种西瓜枯萎病菌后叶片SOD活性变化Fig.1 The change of SOD activity of leaves after inoculation with Fusarium oxysporum f. sp. niveum
2.2 不同抗性西瓜品种叶片的POD活性变化
随着接种后时间的延长,3个对照西瓜品种叶片POD活性变化不大,接菌处理后3个品种叶片POD活性有所升高,均呈现先升高后降低的变化趋势(图2)。接种后,高抗品种PI296341-FR和轻抗品种Crimson Sweet叶片POD活性迅速增加,均在第2天达到峰值,分别较各自未接种对照增加了26.08%、22.33%(P≤0.05),较感病品种Sugar Baby分别增加了22.75%、10.10%(P≤0.05),之后开始下降。而感病品种Sugar Baby在接种后1 d叶片POD活性虽略有升高但增速缓慢,至第3天时才达到活性峰值,较接种处理前0 d增加了8.52%,之后活性开始下降。从3个品种叶片POD活性变化来看,接种西瓜枯萎病菌可显著提高西瓜叶片POD活性,抗病品种酶活性峰值出现时间早于感病品种,抗病品种叶片POD活性变化幅度显著高于感病品种。
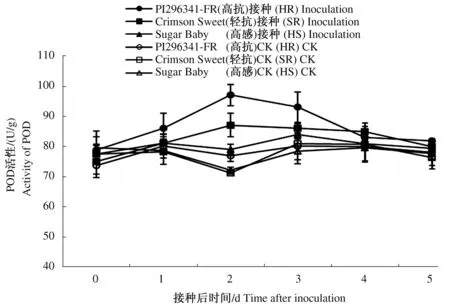
图2 接种西瓜枯萎病菌后叶片POD活性变化Fig.2 The change of POD activity of leaves after inoculation with Fusarium oxysporum f. sp. niveum
2.3 不同抗性西瓜品种叶片的PPO活性变化
接种处理的3个西瓜品种PPO活性均显著高于对照(P≤0.05),说明西瓜枯萎病菌接种处理可显著提高叶片PPO活性(图3)。随着时间的延长,接种后3个品种叶片的PPO活性变化趋势基本一致,均表现为先升高后下降。高抗品种PI296341-FR和轻抗品种Crimson Sweet在接种后第2天叶片PPO活性均达到峰值,高抗品种较未接种对照和感病品种Sugar Baby提高了69.87%、19.91%(P≤0.05),轻抗品种Crimson Sweet较未接种对照提高了62.59%(P≤0.05),而感病品种Sugar Baby叶片PPO活性增速缓慢,活性峰值在第3天出现。接种处理后3个西瓜品种在达到酶活性峰值时,高抗品种PI296341-FR和轻抗品种Crimson Sweet叶片PPO活性较接种前分别提高了57.74%、53.21%(P≤0.05),而感病品种Sugar Baby叶片PPO活性较接种前提高了25.93%;抗病品种在接种第2天后,叶片PPO活性缓慢下降,而感病品种则在接种第3天后,叶片PPO活性迅速下降。可见,西瓜枯萎病菌接种处理可显著提高西瓜叶片PPO活性,抗病品种酶活性峰值出现时间早于感病品种,抗病品种PPO活性变化幅度显著高于感病品种。
2.4 不同抗性西瓜品种叶片的PAL活性变化
接种处理前3个西瓜品种的PAL活性无显著差异,接种处理后,随着时间的延长,3个品种的PAL活性变化均呈现先升高后下降的趋势(图4),说明枯萎病菌接种处理可以显著提高西瓜叶片PAL活性。高抗品种PI296341-FR在接种后2 d叶片PAL活性达到峰值,分别较未接种对照和感病品种Sugar Baby提高了70.70%、20.65%(P≤0.05),然后PAL活性呈现缓慢下降趋势,轻抗品种Crimson Sweet叶片PAL活性在接种后1 d达到峰值,较未接种对照提高了33.34%(P≤0.05),之后缓慢下降趋于稳定。而感病品种Sugar Baby在接种后3 d叶片PAL活性才达到峰值,之后逐渐降低,抗病品种的酶活性峰值出现时间均早于感病品种。接种处理后3个西瓜品种在达到酶活性峰值时,高抗品种PI296341-FR和轻抗品种Crimson Sweet叶片PAL活性分别较接种前提高了73.17%、65.91%(P≤0.05),而感病品种Sugar Baby叶片PAL活性较接种前提高了34.08%(P≤0.05)。从3个西瓜品种叶片PAL活性变化来看,西瓜枯萎病菌接种处理可显著提高西瓜叶片PAL活性,抗病品种酶活性峰值出现时间早于感病品种,抗病品种PAL活性变化幅度显著高于感病品种。
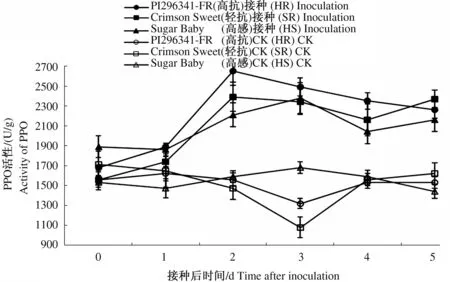
图3 接种西瓜枯萎病菌后叶片PPO活性变化Fig.3 The change of PPO activity of leaves after inoculation with Fusarium oxysporum f. sp. niveum
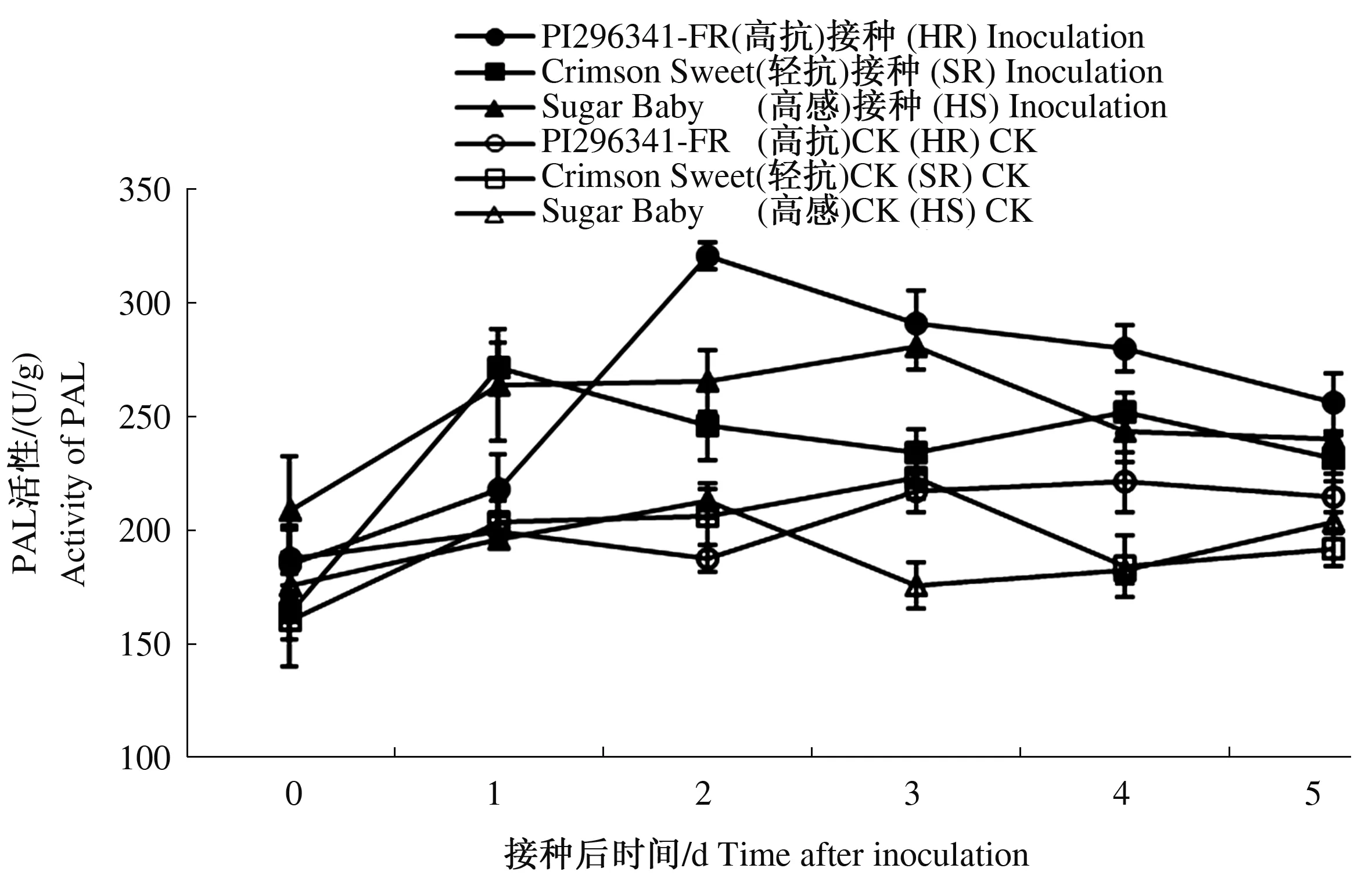
图4 接种西瓜枯萎病菌后叶片PAL活性变化Fig.4 The change of PAL activity of leaves after inoculation with Fusarium oxysporum f. sp. niveum
2.5 不同抗性西瓜品种叶片的CAT活性变化
随着接种后时间的延长,3个对照西瓜品种叶片的CAT活性变化不大,接菌处理后3个西瓜品种叶片的CAT活性均显著升高(P≤0.05),且呈现先升高后降低的趋势(图5)。高抗品种PI296341-FR和轻抗品种Crimson Sweet在接种后2 d叶片CAT活性均达到峰值,且高于感病品种,高抗品种PI296341-FR和轻抗品种Crimson Sweet叶片CAT活性分别较各自未接种对照提高78.00%、63.46%(P≤0.05),较感病品种提高了41.79%、28.40%(P≤0.05)。在第2天达到峰值时,高抗品种和轻抗品种叶片CAT活性分别较接种前0 d提高了86.99%、79.58%(P≤0.05),而感病品种Sugar Baby叶片CAT活性在接种后第3天才达到峰值,较接种前0 d提高了54.37%(P≤0.05)。说明西瓜枯萎病菌接种处理可显著提高西瓜叶片CAT活性,抗病品种酶活性峰值出现时间早于感病品种,抗病品种叶片CAT活性变化幅度显著高于感病品种。
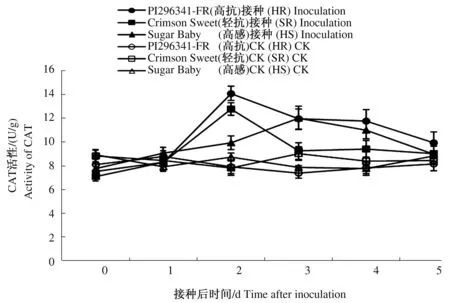
图5 接种西瓜枯萎病菌后叶片CAT活性变化Fig.5 The change of CAT activity of leaves after inoculation with Fusarium oxysporum f. sp. niveum
3 结论与讨论
本试验结果表明,西瓜枯萎病菌接种处理后,3个西瓜品种叶片SOD、POD、PPO、PAL、CAT活性较对照均有显著提高,抗病品种PI296341-FR和Crimson Sweet叶片的SOD、POD、PPO、PAL、CAT活性峰值出现时间早于感病品种Sugar Baby,酶活性增幅显著高于感病品种。SOD、POD、PPO、PAL、CAT 5种防御酶活性变化与西瓜抗病性密切相关,在西瓜枯萎病抗性生化机制中起重要作用,SOD、POD、PPO、PAL、CAT活性峰值大小及出现时间的早晚可作为西瓜枯萎病抗性筛选的重要生化指标。
3.1 SOD、POD、CAT与西瓜枯萎病抗性的关系
植物的防卫反应是在酶催化下一系列复杂生理生化代谢的结果[19],与植物的抗病性密切相关,SOD、POD、CAT等抗氧化酶类通常用作衡量植物体内防卫反应的重要指标[20-21]。植物感染病原菌后,体内活性氧产生和消除的代谢平衡受到破坏,过剩的活性氧能引发和加剧膜脂过氧化作用,细胞结构被破坏,代谢系统紊乱,严重时会导致植物细胞死亡,而SOD、POD、CAT是植物体内担负清除活性氧的保护酶系统中的关键酶[6],这几种酶活性的增加表明清除自由基的能力增强,降低了膜脂过氧化作用,从而维护细胞的正常代谢[22]。一般植物感染病原菌后,抗感品种的抗氧化酶活性均会升高。李新等[22]通过黄瓜枯萎病的研究发现,POD、SOD活性的变化与黄瓜的抗病性呈正相关关系。侯茜等[23]、孙正祥等[24]对西瓜枯萎病的研究均表明,POD 和 CAT活性与植物的抗病性呈正相关。但也有不同观点,云兴福[25]对黄瓜感染霜霉病的研究认为,SOD活性与抗病性呈负相关,POD活性与抗病性呈正相关。房保海等[26]研究发现,对烟草接种低头黑病菌后,感病品种POD活性增加快,始终高于抗病品种。
本试验对不同抗性的西瓜品种接种枯萎病菌后,SOD、POD、CAT活性的动态分析表明,无论是西瓜抗病品种还是感病品种,在受枯萎病菌侵染后,其植株体内的细胞都会做出抗性反应,表现为SOD、POD、CAT活性的提高,但抗病、感病品种之间的反应快慢存在差异,抗病品种对接种处理较为敏感,接种后3种酶活性迅速增加,较早达到活性峰值,而感病品种则对接种处理反应较为迟钝,接种后酶活性缓慢增加,活性峰值出现较晚,达活性峰值后迅速下降,这与赵秀娟等[7]对苦瓜枯萎病的抗性研究结果相一致,齐绍武等[27]在研究甘蓝型油菜接种菌核病菌后也得到相同的结论。针对抗感西瓜品种叶片的POD活性变化,本试验研究发现,接种枯萎病菌后,抗感品种叶片POD活性都呈现先升高后下降的变化趋势,但抗病品种POD活性始终高于感病品种,且抗病品种在接种处理后酶反应变化幅度更显著,酶活性增幅更大,这与李新等[22]的研究结果相同,但与刘守伟等[8]在黄瓜枯萎病抗性试验中得出的结果不完全相同,可能的原因是所选择的试验材料或取样部位不同,有待进一步深入研究。本试验所用抗病西瓜品种对接种处理更为敏感,枯萎病菌侵染细胞后膜系统受损,透性增加,酶促反应加速,酶活性提高,表现为抗病品种的POD活性变化幅度显著大于感病品种,这也再次反映出接种处理后植物细胞的膜系统受损是抗氧化酶类发生显著变化的根本原因。
3.2 PPO、PAL与西瓜枯萎病抗性的关系
PPO[28]、PAL[29-30]活性与植物抗病性密切相关。PAL是植物抗病性物质生成途径——苯丙烷类代谢途径的关键酶和限速酶,PAL活性的提高有利于抗性物质木质素含量的增加[31];PPO可催化酚类物质氧化成醌,造成木质素大量合成并积累于细胞壁间,增加细胞壁抗病原物的穿透压力,阻止病原菌的侵入繁殖或钝化毒素[32]。陈年来等[30]研究认为,植物的抗病性强弱决定于体内抗性基因表达后发生抗病反应的速度和积累抗病物质的速度与数量。本试验通过研究抗感西瓜品种叶片PPO和PAL活性的变化发现,接种后3个品种西瓜叶片的PPO和PAL活性均显著升高,可能是由于枯萎病菌的侵染激活了PPO和PAL基因的表达,而由PPO催化形成的醌类物质以及PAL诱导合成的大量木质素在一定程度上限制了病菌的扩散;接种后抗病品种叶片的PPO和PAL活性及增幅均显著高于对照和感病品种,原因之一是接种枯萎病菌后抗病品种叶片PPO和PAL 2种防御酶活性表达水平较高,酶活性的高水平表达也是植物应对病菌侵染的抗性反应,以适应逆境;抗病品种叶片PPO和PAL活性峰值的出现时间均早于感病品种,可能是由于抗病品种的一些早期防卫反应出现较早,酶促反应速度快,催化诱导形成的酚类物质积累早,而感病品种虽有防御能力,但酶诱导速度和强度均较抗病品种差,来不及或不足以抑制病原菌生长,所以感病品种出现酶活性峰值的时间比抗病品种晚,这也是感病品种易感染西瓜枯萎病的真正原因。这与马艳玲等[32]在黄瓜枯萎病,刘亚光等[33]在大豆灰斑病,赵秀娟等[7]在苦瓜枯萎病以及侯茜等[23]在西瓜枯萎病抗性研究中得出的结论相同。

