人工锌指蛋白介导调控的里氏木霉纤维素酶生产
孟庆山,李嘉祥,张飞,赵心清,3,白凤武,3
1 大连理工大学 生命科学与技术学院,辽宁 大连 116024
2上海交通大学 生命科学技术学院,微生物代谢国家重点实验室,上海 200240
3 上海交通大学 教育部代谢与发育国际合作联合实验室,上海 200240
木质纤维素资源是分布广泛、含量丰富的可再生生物资源。利用微生物生产的纤维素酶降解木质纤维素生成可发酵糖,再进一步转化成生物液体燃料和生物基化学品,不仅能缓解化石能源逐渐枯竭的危机,还可以保护环境,促进经济可持续发展。但存在的挑战是目前木质纤维素原料生物炼制成本过高,尤其是纤维素降解酶生产成本过高[1-2]。
里氏木霉Trichoderma reesei,又称为瑞氏木霉,由于其较高的纤维素酶和半纤维素酶合成水平和胞外分泌能力而被广泛研究,其中里氏木霉Rut-C30菌株广泛应用于纤维素酶工业生产中[3]。进一步提高该菌株的产酶水平,有利于提高木质纤维素生物转化的经济性。
里氏木霉纤维素酶诱导和合成的调控机制非常复杂[4-5]。随着丝状真菌遗传操作技术的进步,代谢工程改造技术不断发展。利用转录因子或酶基因的过表达或敲除,成功选育了高产纤维素酶的菌株。例如,我国学者在里氏木霉中通过将纤维素酶基因转录抑制因子基因cre1敲除,使突变株总纤维素酶滤纸酶活较出发株提高72.6%[6]。但目前里氏木霉功能基因组研究还处于起步阶段,其纤维素酶合成的调控机制仍需要深入研究。
锌指蛋白可与DNA、RNA和蛋白相互作用,很多锌指蛋白在基因表达调控过程中发挥着重要作用[7]。已经报道里氏木霉中至少存在3个纤维素酶基因正向转录因子 (XYR1、ACE2、ACE3)和3个负调控转录因子 (CRE1、ACE1、RCE1),而这些转录因子均属于锌指蛋白家族[7-8]。基于锌指蛋白能特定识别DNA序列,研究者设计了C2H2型人工锌指蛋白转录因子文库。该文库中每个转录因子由3或者4个C2H2型锌指蛋白串联的结合域及一个效应域构成[9]。在原核生物大肠杆菌以及真核酿酒酵母中导入该人工锌指文库,分别筛选到对高渗透压和乙酸耐性增强的突变菌株[10-11]。本课题组前期利用人工锌指转录因子文库转化里氏木霉Rut-C30,获得了里氏木霉人工锌指突变体文库,并从中筛选获得一株纤维素酶高产菌U3,发现其β-糖苷酶酶活显著升高,证明了人工锌指转录因子可用于里氏木霉纤维素酶生产菌株的选育[12]。由于人工锌指蛋白含有多样的锌指结构域,可识别不同的靶点序列,我们推测不同人工锌指蛋白过表达突变体可能存在多样的产酶调控机制,因此对更多突变体进行分析,有助于获得里氏木霉纤维素酶合成调控更多信息,但目前相关研究还没有报道。
本研究对转化人工锌指蛋白文库获得的里氏木霉突变体进行筛选,获得了两株高产纤维素酶突变株M1和M2。通过对突变株的产纤维素酶能力和关键纤维素降解酶基因及其调控因子转录分析,证明了人工转录因子调控纤维素酶生产的多样性,为进一步深入研究纤维素酶合成调控机理、挖掘关键基因进行里氏木霉代谢工程改造,提高木质纤维素资源生物炼制效率提供了参考。
1 材料与方法
1.1 菌种与培养基
里氏木霉Trichoderma reeseiRut-C30 (ATCC 56765),本实验室保存。
PDA固体培养基、生孢培养基、MM培养基、分别参考文献[12]和[13]。葡萄糖基础培养基(g/L):MM培养基,葡萄糖 20,pH 4.8。纤维素酶活筛选培养基 (g/L):MM培养基,碳源采用2%珠磨纤维素,1‰ TritonX-100,琼脂粉 20。液体摇瓶发酵培养基:2%纤维素,2%麸皮,MM培养基,pH 4.8。
1.2 主要生化试剂
染色体步移试剂盒 (Genome walking kit)、rTaqDNA聚合酶、实时定量RT-qPCR染料试剂盒及其DNA 分子量标准为宝生物TaKaRa公司产品;可溶性木聚糖4-O-Me-D-glucurono-D-xylan为Sigma公司产品;BCA试剂盒为生工生物工程 (上海) 股份有限公司产品。
1.3 锌指转化子遗传稳定性测试
转化子接种在无抗生素的PDA培养基28 ℃恒温培养5–7 d,将得到的菌丝体挑出并接种在无抗生素的生孢培养基内,28 ℃培养传代4–5次,蒸馏水洗下孢子并稀释104–107倍后,取少量涂布于葡萄糖基础培养基固体平板中,28 ℃培养3 d后,挑单孢子接种至含有300 μg/mL的潮霉素PDA平板,观察菌丝生长。
1.4 液体摇瓶发酵
转化子分别以108个孢子/L接种到葡萄糖基础培养基上及液体摇瓶发酵培养基中,用于突变体产酶性能评价。
1.5 里氏木霉染色体DNA提取
真菌染色体DNA的提取采用液氮研磨法[14]。将浓度为1×108个/mL的新鲜分生孢子接种于葡萄糖基础培养基中,30 ℃、200 r/min 培养48 h,将菌体过滤收集,放入研钵中加入液氮进行研磨破碎,收集破碎后的少量菌体于1.5 mL离心管中加入适量抽提缓冲液,65 ℃水浴30 min,然后加入苯酚/氯仿振荡充分混合均匀后,离心收集上清液,加入0.1倍体积的3 mol/L醋酸钠(pH 4.8)和500 μL异丙醇,-20 ℃放置20 min后离心收集沉淀物,用70%乙醇洗涤1次,待乙醇完全挥发后加入双蒸水溶解。
1.6 人工锌指转录因子DNA片段扩增
以M1和M2突变株基因组为模板,用验证引物进行PCR扩增。反应体系参考宝生物rTaqDNA聚合酶使用说明书。验证引物:VE1-F 5ʹ-TG TGAGACCATGAGCTATTATTGC-3ʹ;VE1-R 5ʹ-CG ACACCAACGATCTTATATCCAG-3ʹ。
1.7 蛋白质含量测定
参考生工生物工程 (上海) 股份有限公司改良型BCA (Bicinchoninic acid) 法蛋白质浓度测定试剂盒说明,以牛血清蛋白BSA作为标准。实验重复3次,所列出的结果为3次实验的平均值。
1.8 滤纸酶活、内切葡聚糖酶活、木聚糖酶活测定
酶活测定参考文献[14]。具体描述如下。
滤纸酶活 (FPase):取1 cm×6 cm 定量滤纸条,加入1 mL醋酸缓冲液 (pH 4.8) 和0.5 mL稀释后的粗酶液,50 ℃酶解1 h。
内切葡聚糖酶活 (CMCase):1 mL 1%的CMC-Na溶液中加入0.5 mL稀释后的酶液,50 ℃酶解30 min。
木聚糖酶活 (Xylanase):1 mL 1%的燕麦木聚糖悬浮液加入0.5 mL稀释后的酶液,50 ℃酶解30 min。
以上3种酶活测定中,均以DNS法测定还原糖量。
1.9 人工锌指蛋白在基因组中插入位点分析
利用宝生物 (TaKaRa) 公司染色体步移试剂盒中随机引物,通过交错式热不对称PCR(Thermal asymmetric interlaced PCR,TAIL-PCR)方法[15]将突变株基因组中人工锌指蛋白基因插入位点侧翼序列扩增,扩增条带测序后与C30基因组序列比对,确定人工锌指蛋白基因在染色体中插入位点。
1.10 人工锌指蛋白基因组结合位点预测
每个锌指α螺旋的–1、+2、+3、+6位氨基酸可与基因组DNA大沟上的特异碱基三联体结合[16]。对突变体的人工锌指蛋白序列进行测序,根据文献提供的人工锌指蛋白DNA结合域中每个锌指可能的结合序列[9],分析突变体的人工锌指蛋白DNA结合域相应的可能结合序列,然后与里氏木霉Rut-C30基因组核苷酸序列进行比对 (https://genome.jgi.doe.gov/TrireRUTC30_1/TrireRUTC30_1.home.html),找出可能的靶基因。
1.11 实时定量PCR分析 (RT-qPCR)
等量出发株和突变株新鲜孢子 (108/L) 接种于液体摇瓶发酵培养基中,30 ℃培养,分别在24 h和48 h取1 mL发酵菌丝液,10 000 r/min离心2 min收集菌体,ddH2O洗2遍后,用生工生物工程 (上海) 股份有限公司植物RNA提取试剂盒 (B518661) 提取里氏木霉RNA,经NanoDrop检测质量和纯度后,利用PrimeScript™ RT Reagent Kit with gDNA Eraser (TaKaRa) 将RNA反转为cDNA用于后续RT-qPCR分析。RT-qPCR反应过程中使用tef1基因作为内参基因,表达变化分析采用相对定量2–ΔΔCt方法[17]。RT-qPCR结果用3次独立实验的平均值±标准差表示。使用的RT-qPCR基因检测主要引物见表1。其中主要纤维素酶基因及其调控因子基因引物见参考文献[12]。
所有实验独立重复2次,每次3个平行。统计分析采用t检验法,P<0.05认为有统计学意义。

表1 本文使用的实时定量引物Table 1 Primers for the RT-qPCR analysis used in this study
2 结果与分析
2.1 高产纤维素酶突变体筛选
本课题组前期构建适用于里氏木霉表达的人工锌指转录因子文库pCB303-Lib-Zfps双元载体(图1A),并导入到里氏木霉Rut-C30中,获得约600个转化子[12]。摇瓶培养发现多株突变体纤维素酶 (FPase) 滤纸酶活与出发菌株Rut-C30有差异,图1B为有代表性的几株不同转化子的产酶水平比较,可见不同转化子产酶性能的多样性,其中酶活提高明显的两株分别命名为M1和M2。
2.2 纤维素酶高产株M1和M2摇瓶发酵验证
将所筛选到的M1和M2突变株分别进行遗传稳定性测试,结果表明,两株突变株传代后在抗性平板中生长良好,遗传性能稳定。摇瓶复筛结果见图2。由图2A可以看出,发酵第6天M1和M2突变株纤维素酶滤纸酶活分别为2.5 FPU/mL和1.9 FPU/mL,较出发株Rut-C30的1.24 FPU/mL分别提高了100% 和53%。发酵第8天Rut-C30产酶增加,与M1和M2差距缩小。内切酶活性测定结果如图2B所示,在发酵第6天,突变株M2胞外内切酶活性在3株菌中最高,比出发菌株Rut-C30的内切酶活性提高64%。同时发现M1突变株木聚糖酶活及其胞外蛋白含量较出发株Rut-C30分别提高了35%和69%,在M2突变株中分别提高12%和18% (图2C和2D)。

图1 双元载体pCB303-Lib-Zfps图谱 (A) 及里氏木霉Rut-C30突变体纤维素酶发酵产酶 (B)Fig.1 Map of the binary vector pCB303-Lib-Zfps (A) and cellulase production by the T.reesei Rut-C30 mutants (B).

图2 里氏木霉Rut-C30和突变体纤维素酶活、胞外蛋白和生物量比较Fig.2 Comparison of cellulase activities, secreted protein and biomass for T.reesei Rut-C30 and the mutants.(A–C)FPase, CMCase and xylanase activities, respectively.(D) Total extracellular protein content.(E) Biomass determination represented by OD260 value of genomic DNA of the strains (*P<0.05; **P<0.01).(F) Transparent zone observations of T.reesei strains grown on cellulose plates for 5d.
利用DNA浓度表征菌株的生物量,3株菌株DNA量对比可见,M1突变株较出发株有明显提高,而M2与出发株差别不大 (图2E)。结合以上相应酶活和胞外蛋白结果,初步推测M1突变株生长更迅速,因此胞外分泌蛋白能力强;M2则是由于改变了酶系中不同酶的比例,导致滤纸酶活提高。另外,通过突变株在以微晶纤维素为碳源的双层平板产生的透明圈大小证明M1和M2突变株较出发株Rut-C30产纤维素酶能力提高。此外,还发现M2突变株菌落形态发生改变 (图2F)。
2.3 高产菌株M1和M2锌指序列分析
将PCR扩增获得的突变株M1和M2中人工锌指蛋白序列片段测序,所对应的氨基酸序列分别命名为AZFP-M1和AZFP-M2,均为四锌指蛋白。将其与本课题组前期筛选到的纤维素酶高产菌U3中锌指转录因子AZFP-U3氨基酸序列进行对比,结果发现AZFP-M1、AZFP-M2与AZFP-U3中锌指结合域氨基酸序列明显不同 (图3)。由AZFP-M1和AZFP-M2的锌指氨基酸序列分析推测 AZFP-M1在基因组中潜在结合位点为5′-GTCNGGGAWGTC-3′ (N代表A,C,G或者T;W代表A或者T),而AZFP-M2潜在结合位点为5′-GTTGYAHGAGGG-3′ (Y代表C或者T;H代表A,C或者T)。分别将上述人工锌指转录因子12 bp核苷酸序列与里氏木霉Rut-C30基因组核苷酸序列进行比对,结果发现AZFP-M1可能结合在8个基因启动子区 (距离ATG<1 600 bp)、35个基因ORF区域。AZFP-M2可能结合在15个基因的启动子区域 (距离ATG<1 600 bp)、6个基因的ORF区。推测不同锌指转录因子识别不同靶基因,以不同方式调控纤维素酶生产。
2.4 人工锌指转录因子在菌株M1和M2基因组中插入位点分析
经过3轮PCR确定Azfp-M1和Azfp-M2基因片段在基因组中整合位点均位于里氏木霉Rut-C30染色体 Scaffold 1: TrireC30_4597和TrireC30_67627两个基因间隔区,这两个基因方向相反,且该区域不存在基因启动子或终止子(图4B)。整合位点分析表明,人工锌指转录因子的引入未影响里氏木霉Rut-C30内源基因的表达。因此,M1和M2突变株产酶能力不同由不同人工锌指转录因子的表达引起,而非整合位点差异所致。
2.5 人工锌指转录因子对突变株纤维素降解酶合成主要基因转录影响

图3 纤维素酶高产菌株M1和M2人工锌指转录因子氨基酸序列分析Fig.3 Alignment of the amino acid sequences of the AZFP-binding domains from the T.reesei U3, M1 and M2 mutants.

图4 人工锌指转录因子序列在里氏木霉突变体基因组中的整合位点分析Fig.4 Tail-PCR analysis of the Azfp insertion site in the two mutants.(A) Gel electrophoresis analysis for products of three TAIL-PCR reactions from the genomes of the M1 and M2 mutants.(B) Sequence analysis of the T-DNA integration site in the two mutants.Lane 1–3 represented the products of three TAIL-PCR reactions, respectively.
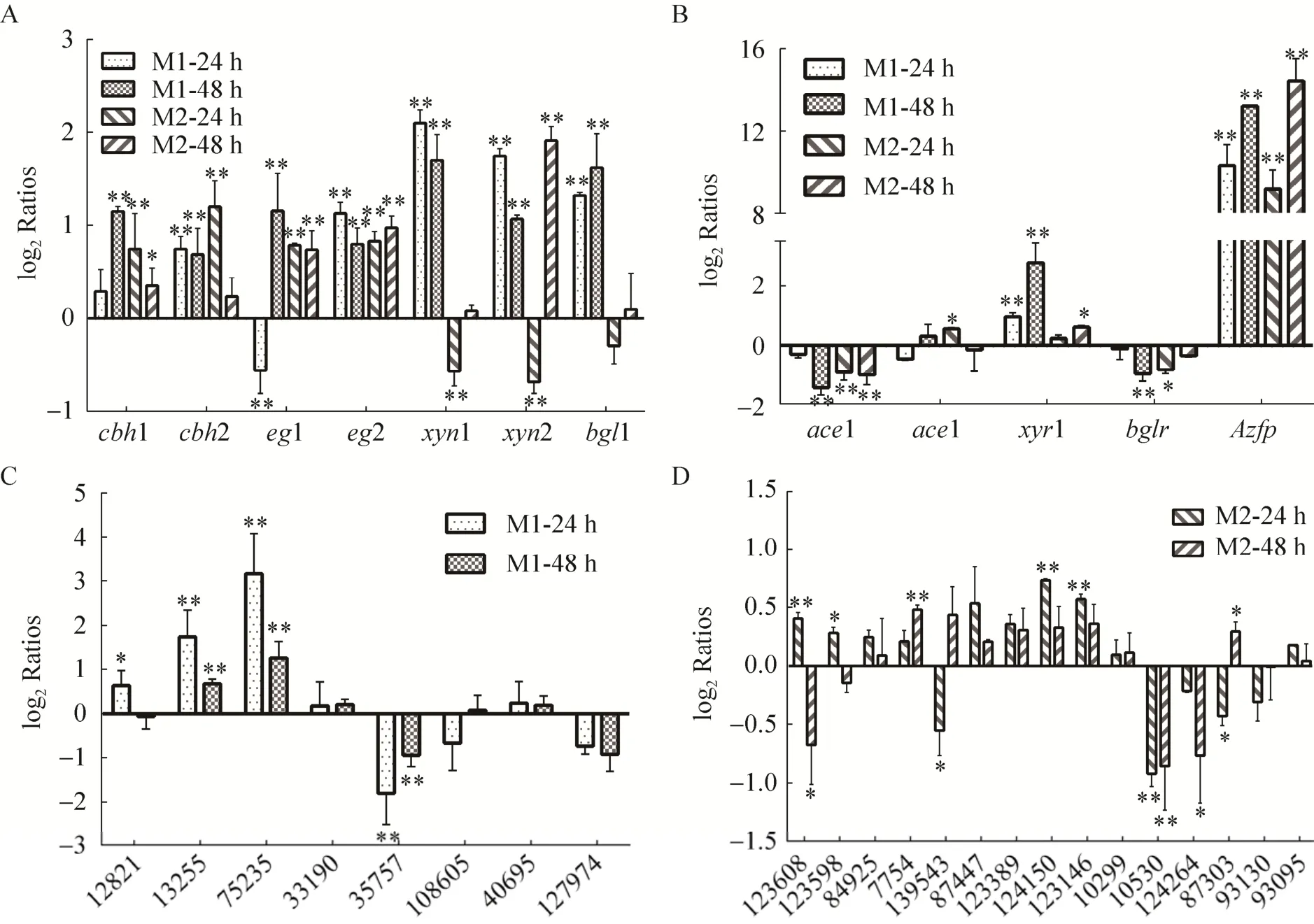
图5 突变体中主要纤维素降解酶、转录因子及预测靶基因转录水平与对照菌株的比较Fig.5 Comparison of transcription levels of the key genes encoding cellulolytic enzymes (A), transcription factors (B), as well as the predictive target genes (C–D) in the M1 and M2 mutants comparing with that of the control strain.* P<0.05; ** P<0.01.
从突变株摇瓶发酵中的纤维素酶、半纤维素的酶活水平看出,人工锌指转录因子直接或间接参与调控纤维素降解酶合成。进一步分析了人工锌指转录因子对纤维素降解酶基因及其转录因子的影响。结果如图5A所示,产酶培养48 h,突变株M1和M2纤维二糖水解酶 (cbh1和cbh2)、内切葡聚糖酶 (egl1和egl2) 基因转录较出发株上调1.6倍以上。培养24 h,M1突变株中β-葡萄糖苷酶 (bgl1)、木聚糖酶 (xyn1和xyn2) 基因较出发株C30分别提高了2.5、4.3和3.2倍,而M2突变株却与之相反,这与摇瓶发酵酶活测量水平一致。同时,相比出发株Rut-C30,锌指转录因子突变株M1和M2中已知的纤维素酶抑制调控因子ace1转录水平在48 h分别下调2.6和2.0倍。主要的纤维素酶激活因子xyr1在M1突变体培养48 h明显上调,达到7.0倍,但在M2中未发现明显变化 (图5A和5B)。
对预测的人工锌指转录因子可能结合的靶基因转录水平进行分析。通过与Rut-C30对比,M1突变株预测的8个基因中,Tr_75235转录水平有明显上调,而Tr_35757则有明显下调 (图5C)。M2突变株Tr_10530和Tr_124264转录水平有明显下调 (图5D)。未来对这些潜在的靶基因进行分析,研究其表达水平的差异与纤维素降解酶合成的关系,有希望发现新的产酶调控机理,鉴定代谢工程改造的新靶点基因。综上所述,人工锌指转录蛋白 (AZFP) 参与纤维素酶和半纤维素酶基因合成调控,并且不同人工锌指转录因子调控机制存在差异,提示了人工锌指蛋白调控机理的多样性。
3 讨论
高产纤维素酶工业菌株的育种对纤维素酶的生产成本节约至关重要。人工转录因子是人为构建的,有可能以新的机制调控纤维素酶合成。目前国内外研究普遍关注利用内源转录因子的遗传操作提高产酶,如国内学者利用里氏木霉Rut-C30内源多个纤维素酶转录因子结合域和激活域进行重新组装后导入菌株,获得了一株纤维素酶和半纤维素酶高产转化子菌株4C4[18]。本课题组将人工锌指转录因子技术应用于里氏木霉育种领域,通过构建外源人工锌指转录因子突变体文库,成功筛选到一系列纤维素酶产量提高的里氏木霉工程菌。我们使用的人工锌指蛋白具有多种来源的锌指结构域,有可能识别不同的靶基因,产生多样的调节效果[9]。
本研究从前期课题组构建的里氏木霉人工锌指转录因子 (AZFP-TFs) 突变体文库中筛选到两株纤维素酶高产突变株M1和M2。液体摇瓶发酵结果显示,突变株M1由于生长旺盛进而外泌蛋白量增加导致总体纤维素酶产量提高,M2则内切酶增加从而提高纤维素酶活。而之前筛选的U3突变体则是由于β-葡萄糖苷酶活力的提高从而影响整体纤维素酶活力[12],体现了人工锌指蛋白调控产酶的多样性。AZFP-M1预测结合的靶基因共有43个,其中结合在启动子区域的有8个基因,结合在ORF区域的有35个基因。而AZFP-M2预测结合靶基因共有21个,其中结合在启动子区域的有15个基因。对所鉴定的人工锌指蛋白可能结合的靶基因进行分析,在AZFP-M1结合在启动子区域的8个基因中,仅有Tr_33190编码蛋白被预测具有转运功能,其余均为未知蛋白。但Tr_33190在M1菌株中转录量较出发株并没有明显差异,推测可能不参与AZFP-M1对纤维素酶合成调节。而在AZFP-M2所结合在启动子区域的15个靶基因中,共有10个基因被注释。Tr_84925和Tr_10530被预测可编码转录因子功能蛋白,但在里氏木霉中其功能未知。M2突变株中基因Tr_10530转录量有明显下调,推测其可能与纤维素酶合成有关。并且发现人工锌指转录因子AZFP-M2可能结合在bgl1基因ORF区域,因此有可能阻碍bgl1基因转录,这可能与M2突变株中β-葡萄糖苷酶活力降低有关,有待进一步实验验证。转录因子BglR在两个突变体均下调,该蛋白可以特异调控除胞外β-葡萄糖苷酶bgl1基因以外的其他β-葡萄糖苷酶类基因转录,有报道在纤维二糖培养基中,BglR的缺失会提高纤维素酶产量[19],但突变体酶活上升是否与BglR下调有关有待实验验证。我们还发现突变体M2中内切酶转录改变,但目前还不清楚里氏木霉中是否存在特异调控内切酶表达的调控因子,人工锌指蛋白AZFP-M2可能对该调控因子进行直接或者间接调控,进而提高CMC酶活,也有可能直接结合在内切酶启动子上游调控CMC酶活。对人工锌指蛋白靶基因的研究,有助于进一步揭示丝状真菌纤维素酶合成调控的分子机制,从而开发更有效的代谢工程改造技术。
丝状真菌纤维素酶的合成调控网络很复杂,仍有非常多纤维素酶调控因子的功能不明晰,有待发掘[20]。随着里氏木霉纤维素酶合成调控的深入研究,新的转录因子不断被发现。例如,国内学者通过与构巢曲霉中钙响应转录因子CrzA序列对比,在里氏木霉中找到了其同源蛋白Crz1,并证明钙响应锌指转录因子Crz1可直接调控纤维素酶合成[21]。本课题组对人工锌指蛋白突变体进行分析,发现T.reesei转录因子Vib-1过表达可促进纤维素酶生产[22]。本文对M1和M2突变株中人工锌指转录因子可能结合的靶基因进行转录水平分析,发现个别靶基因的转录量发生了明显上调或者下调 (图5C和5D),后续我们将对突变体中人工锌指蛋白的直接作用靶点进行实验验证,并在此基础上深入研究里氏木霉纤维素酶的合成调控。另外,由于本实验中所采用Ppki启动子在已报道的启动子中属于弱启动子[23],可能导致人工锌指蛋白表达水平较低。改变启动子强度,进而改变人工锌指转录因子的表达水平,有可能影响关键调控基因和酶基因的表达水平,从而得到产酶性能不同的菌株。文献报道我国学者在草酸青霉中通过理性设计同时过表达XlnR和ClrB纤维素酶转录激活因子和敲除主要抑制转录因子CreA,获得较出发株滤纸酶活提高8.9倍的纤维素酶高产菌[24],因此,多基因协同控制有可能进一步提高产酶效率。后续工作中我们将尝试不同人工转录因子在同一个菌株中进行组合优化,希望达到更优良的调控效果。本文工作结果为进一步研究里氏木霉纤维素酶合成调控网络,进而进行代谢工程改造提高产酶提供了参考。

