不同喀斯特小生境中小蓬竹的遗传多样性
刘济明 管睿婷 王 敏 陈敬忠 童炳丽 武梦瑶
(贵州大学林学院,贵阳 550025)
小蓬竹(AmpelocalamusluodianensisT.P.Yi & R.S.Wang)属禾本科(Gramineae)竹亚科(Bambusoideae)悬竹属(Ampelocalamus);竹竿低部位较直且中心空隙很小,高部位藤状垂挂,合轴丛生,主干粗壮而侧枝极细,箨鞘较晚掉落,箨片披针形,没有箨耳[1];为中国特有、贵州省特有物种,现悉仅分布于贵州省罗甸县、平塘县、长顺县、紫云县、贞丰县、册亨县、望谟县、安龙县、惠水县等喀斯特区域600~1 000 m海拔高度的石灰岩出露山地,在《中国物种红色名录》、《IUCN红色名录》里均属极危种[2]。在观赏、经济与生态等方面的利用价值极高。
小生境(microhabitats):又称小栖息地,为特定环境条件生物的某种生境,小生境越专一,物种就越容易受到栖息地环境变化的影响。本研究选取生长在土面、石沟、石缝、石槽及石洞等5种不同喀斯特小生境中的小蓬竹随机采样。
随机扩增多态性DNA标记(Random amplification polymorphic DNA,RAPD):是Williams和Welsh几乎在同一时期研究得出的通过随机引物扩增来找多态DNA片断为标记的遗传多样性研究法[3]。该研究法中,基因组DNA作模板,引物为随机寡聚核苷酸单链,PCR克隆DNA片段经电泳检测分离之后,再用放射性自显影技术或EB染色法检测研究对象的多态性谱带。RAPD标记所需DNA用量少、操作简单、检测方便、敏感性高,引物随机合成,无需参照基因组序列便能设定引物,一个引物几乎可扩增出整个基因组片段。其缺点是用于RAPD标记的引物都很短,使得退火温度较低,会引起引物和模板DNA配对出错[4~5]。
遗传多样性(Genetic diversity):生物四大多样性(遗传、物种、生态系统和景观多样性)之一,是生物多样性的根本和最关键的成分,很大程度上决定了物种和群落的多样性,它与环境多样性共同决定生物的形态多样性[6]。遗传多样性由基因组控制,它的丰富与否直接关系到相应种群能否适应生境、能否顺利发展进化。生物遗传多样性研究为揭示其分子级微观进化和区域差异及物种的形成机制等提供了很好的方法证据,同时也是现代生物学上遗传改良的基础。
喀斯特(Karst),通常被定义为地下水、地表水对可溶性岩石的溶蚀和改造及由此产生的地形地貌,贵州省内喀斯特地貌发育强烈突出,分布极广且面积非常之大,占到整个贵州省国土面积的73%[7],喀斯特环境异质性高,植物所处生境恶劣而且极其脆弱,喀斯特区域生态系统的物质迁移能力极强,所以在受到外界人为干扰或自然干扰之后,生态系统很难实现自然恢复。
大量研究证明,植物遗传多样性的丰富度同其所处生存环境的复杂性程度以及降雨、温度、人为干扰、坡向、土壤等生态因子极为相关,不同生境中同种植物的种群遗传多样性高低不等[8,15]。
1 材料与方法
1.1 试验材料
该研究用材小蓬竹采样于贵州省罗甸县董架乡董架村,106°53′53″~106°54′39″E,25°35′38″~25°37′17″N,海拔900~950 m的喀斯特石坡[17]。随机选取生长在土面、石沟、石缝、石槽和石洞等不同喀斯特小生境的小蓬竹进行采样,各类喀斯特小生境的选取标准如表1。
每类小生境中各取3个样方,采其植株长势良好、健康的新鲜嫩叶10 g,放进塑封袋里,加100 g变色硅胶并轻晃封袋让嫩叶与之充分接触。随时观注硅胶呈色,当其由蓝变为粉红时须立即换掉。

表1 5类喀斯特小生境的选取标准
1.2 试验方法
1.2.1 小蓬竹基因组DNA的提取
竹子叶片所含蛋白质和多糖较高,对DNA提取影响极大,因此本研究选择在Doyle J J和Doyle J L的经典CTAB法[18]基础之上改良,得到合适于小蓬竹基因组DNA提取的方法,然后提取经硅胶干燥的小蓬竹嫩叶中的基因组DNA。具体操作步骤如下:
(1)取0.05 g干燥叶片置于灭菌预冷的研钵中,加适量的液氮快速研磨至粉末,研磨过程中注意添加液氮,在完成研磨前不能让研钵中的液氮完全挥发,以防止DNA褐化和降解。将研磨好的组织粉末迅速分装至2.0 mL灭菌冷冻的离心管中。
(2)加入800 μL 65℃预热的2×CTAB提取液,10 μL的β-巯基乙醇,剧烈震荡以充分混匀,置于65℃水浴约1 h,每10 min颠倒摇匀1次。
(3)加800 μL的氯仿∶异戊醇(24∶1),缓慢颠倒摇晃10 min。
(4)12 000 r·min-1,低温离心10 min。
(5)取上清液到一支新的离心管,加入0.7体积预冷的异丙醇,150 μL醋酸钠(pH5.2),充分混匀,-20℃放置30 min。
(6)12 000 r·min-1,低温离心10 min。
(7)弃上清,用70%酒精清洗沉淀1次。
(8)弃去酒精,在空气中晾干沉淀,加入50 μL 65℃预热的TE buffer溶解沉淀,-20℃放置备用。
1.2.2 RAPD-PCR克隆扩增及产物检测
使用小蓬竹RAPD-PCR优化体系[7]和筛选出的扩增条带清晰、多态性高,稳定性好的随机引物,对来自不同小生境小蓬竹的基因组DNA进行RAPD-PCR扩增。
RAPD-PCR优化体系如下:总体积20 μL,dNTPs为100 μmol·L-1;模板DNA量30 ng;Taq DNA聚合酶1.0 U;引物浓度0.2 μmol·L-1;Mg2+浓度1.5 mmol·L-1。PCR循环条件:94℃预变性5 min之后转入35个循环,即94℃变性1 min,35℃退火30 s,72℃延伸90 s,结束循环之后在72℃温度条件延伸7 min,最后于4℃条件下保存。
RAPD-PCR扩增产物于2%琼脂糖凝胶上电泳,电泳液1×TBE,电压100 V,根据条带长度,待溴酚蓝移到距点样孔2/3之处便不再电泳,然后于凝胶成像系统下察看结果,拍像记录。
1.2.3 数据统计与分析
根据RAPD-PCR扩增带的有无构建1-0矩阵,使用POPGENE 32和NTSYSPC V2.10E软件进行统计分析。
RAPD是显性标记,同一引物的扩增产物中电泳迁移率相同的条带被认为具有同源性,属于同一位点的产物,按照有带为1,无带为0来记录电泳谱带。将每个位点视为等位基因M和m,数据“1”代表基因型MM或Mm,数据“0”代表基因型mm,并且假定小蓬竹居群内基因频率处于Hardy-Weinberg平衡状态,用POPGENE32软件计算下列遗传参数:
(1)多态位点比例(percentage of polymorphic loci,PPL)
PPL=(具有多态的位点/检测到的位点数)×100%
(1)
(2)观测等位基因数(observed number of alleles,Na)
(3)有效等位基因数(effective number of alleles,Ne)
Ne=∑ne/n,ne=1/∑Pi2
(2)
式中:ne为单个位点上的有效单位基因数;Pi为单个位点上第i个等位基因频率;n为测定位点总数;Ne与基因的频率大小联系起来,更能反应群体的真实情况。
(4)Shannon’s多样性指数(Shannon’s Information index,I)
I=-∑Pilog2Pi
(3)
式中:Pi是一条扩增产物存在的频率;I为表型多样性指数。
I可以计算两种水平的多样性:Hpop和Hsp。Hpop是群体内遗传多样度,Hsp是种内遗传多样性,Hpop/Hsp则是群体内多样性所占的比例,群体间多样性所占比例则为:
(Hpop-Hsp)/Hsp
(4)
(5)Nei’s基因多样性(Nei’s gene diversity,H);
(6)群体总基因多样性(Ht)和群体内基因多样性(Hs);
(7)基因分化系数(coefficient of gene differentiation,Gst)
Gst=(Ht-Hs)/Ht
(5)
(8)基因流(gene flow,Nm)
Nm=(1-Gst)/2Gst
(6)
(9)遗传相似性系数(genetic identity)
I=JXY/JXJY1/2,又表示两群体间的遗传相似程度,其中JX、JY和JXY分别是所有位点上JX、JY和JXY算术平均数。这里JX=∑Xi,JY=∑Yi,JXY=∑XiYi,Xi、Yi分别是X、Y群体中第i个等位基因。
(10)Nei’s遗传距离(D)(genetic distance)
D=-lnI
(7)
通过NTSYSpc Version 2.10e软件利用UPGMA(非加权算术平均法,unweighted pair group with arithmetic average)进行聚类分析,作出聚类图[19]。
2 结果与分析
2.1 RAPD-PCR扩增结果分析
本试验从80个引物中筛选出8个RAPD随机引物,对采自5种不同小生境中小蓬竹的15个DNA样本进行了PCR克隆扩增。共克隆出87个条带,分子量分布于200~3 000 bp,清晰度高且重复性好,包含68条多态带,多态位所占比例PPL=78.16%。平均水平每个引物可以扩增得多态带8.5条,其中的引物S5扩增的条带数最多(16条)且其多态条带占比(PPL)非常之高,达到100%。可见RAPD-PCR扩增效果好,产生的条带较多且多态条带所占比率高,证明不同小生境中小蓬竹在分子水平上遗传多样性丰富度高(表2,图1)。
表2不同小生境小蓬竹RAPD-PCR扩增结果
Table2RAPD-PCRamplificationresultsofA.luodianensisindifferentmicrohabitats
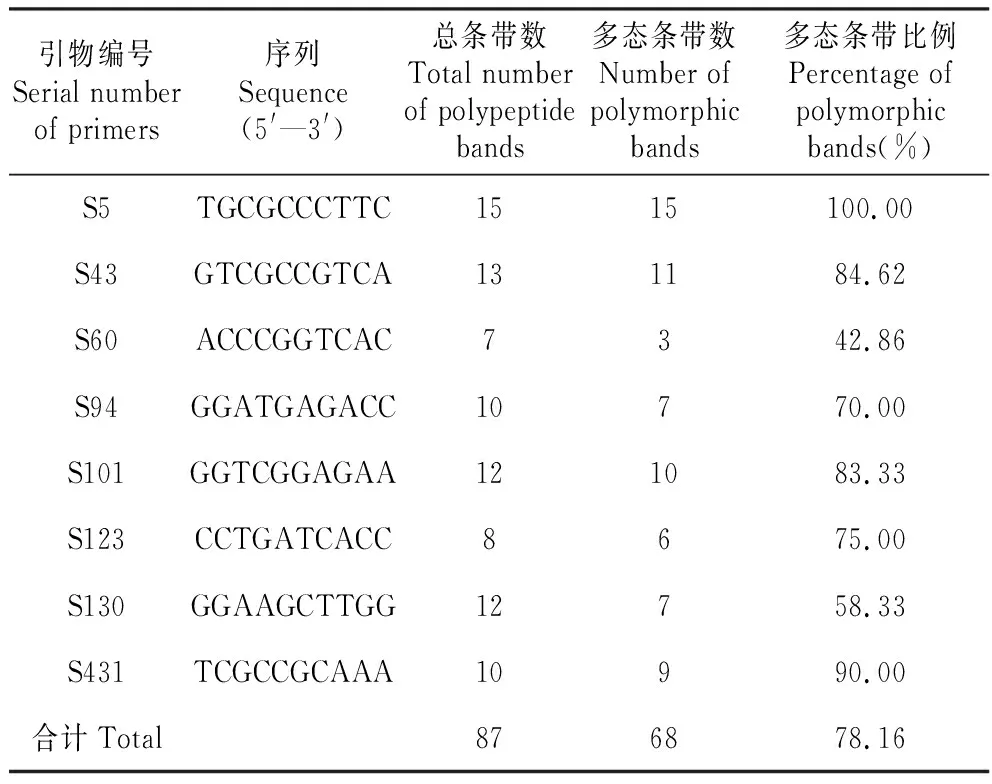
引物编号Serial number of primers序列Sequence(5'—3')总条带数Total number of polypeptide bands多态条带数Number of polymorphic bands多态条带比例Percentage of polymorphic bands(%)S5TGCGCCCTTC1515100.00S43GTCGCCGTCA131184.62S60ACCCGGTCAC7342.86S94GGATGAGACC10770.00S101GGTCGGAGAA121083.33S123CCTGATCACC8675.00S130GGAAGCTTGG12758.33S431TCGCCGCAAA10990.00合计Total876878.16
2.2 不同小生境小蓬竹的遗传变异分析
5类小生境小蓬竹遗传多样性分析表(表3)显示,在各类不同的小生境中:
土面(TM)小生境小蓬竹的多态位点百分率最高,PPL=47.13%,而石缝(SF)多态位点所占比例最小,PPL=39.08%,多态百分率均值PPL=44.37%。按多态位点比率(PPL)排序,5类小生境遗传多样性由高到低的排序为:土面(TM)>石洞(SD)>石槽(SC)>石沟(SG)>石缝(SF)。
Shannon’s指数最大的是土面(TM)I=0.283 4,最低的是石缝(SF)I=0.219 2,平均值为0.255 2。5类小生境按Shannon’s指数排序为:土面(TM)>石洞(SD)>石沟(SG)>石槽(SC)>石缝(SF)。
土面(TM)的Nei’s遗传多样性(H)最高,为0.195 3,最低的是石缝(SF)为0.147 4,平均值0.173 2。以Nei’s多样性指数(H)为指标,5类小生境遗传多样性排序为:土面(TM)>石洞(SD)>石沟(SG)>石槽(SC)>石缝(SF)。
另外,在物种水平上小蓬竹的Shannon’s指数I=0.432 0,说明小蓬竹居群内部的遗传多样性较高。
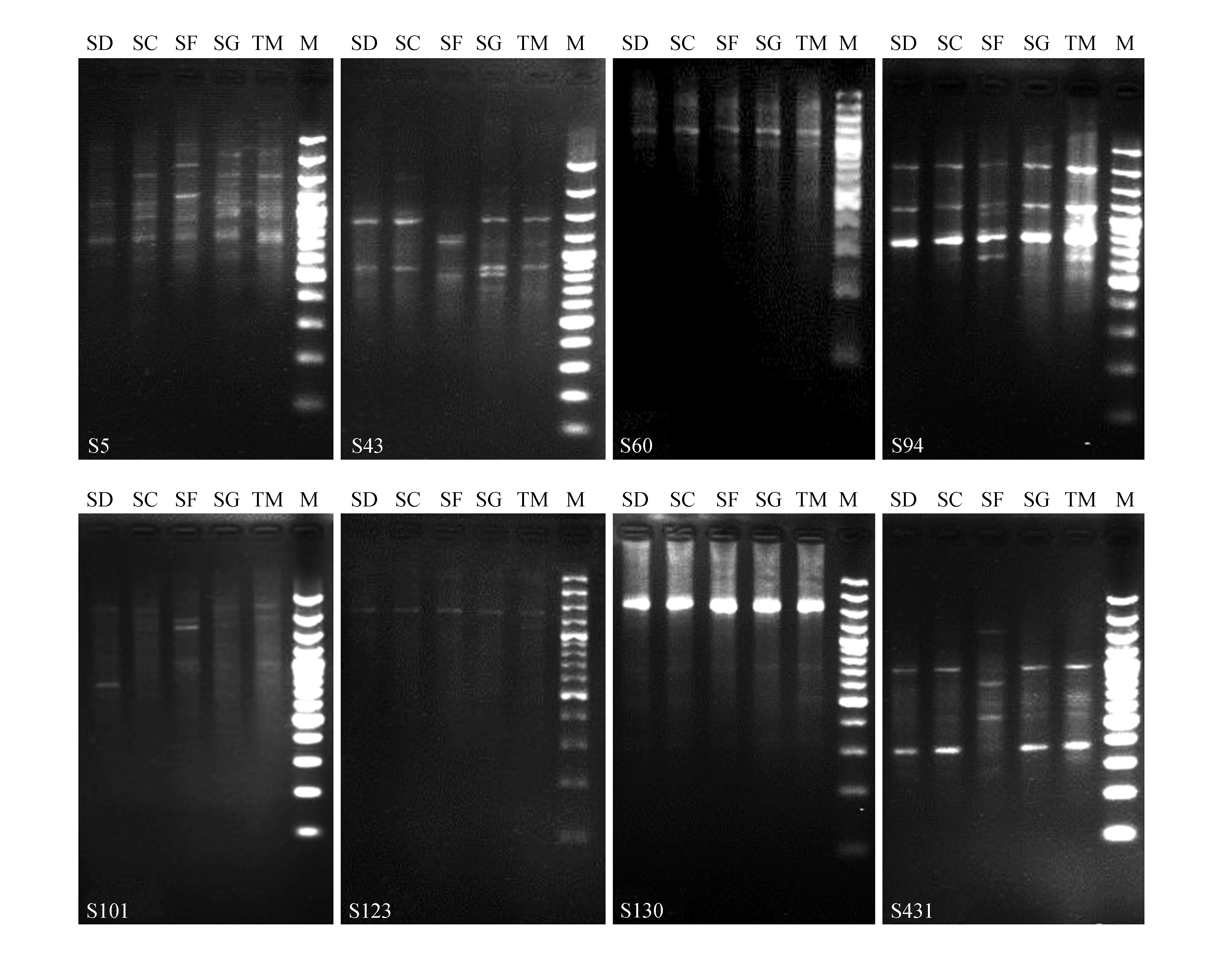
图1 不同小生境小蓬竹的RAPD指纹图谱Fig.1 The RAPD fingerprintings of A.luodianensisin five different microhabitats
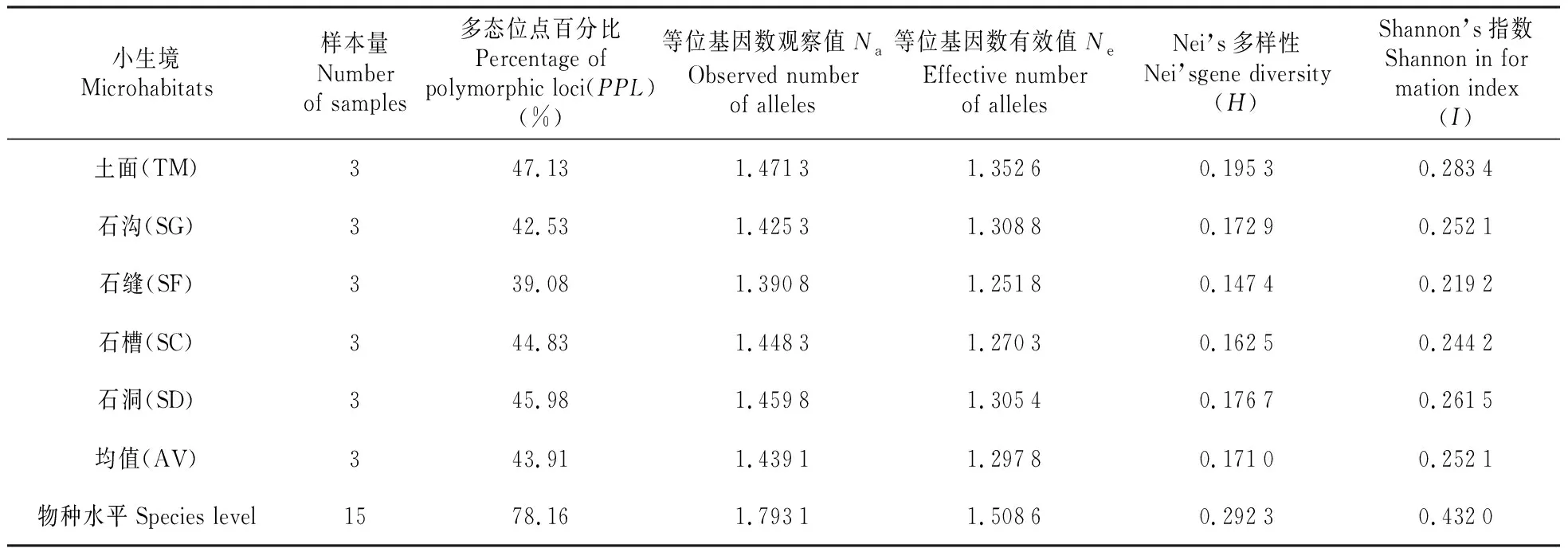
小生境Microhabitats样本量Number of samples多态位点百分比Percentage of polymorphic loci(PPL)(%)等位基因数观察值NaObserved number of alleles等位基因数有效值NeEffective number of allelesNei’s多样性Nei’sgene diversity(H)Shannon’s指数Shannon in for mation index(I)土面(TM)347.131.47131.35260.19530.2834石沟(SG)342.531.42531.30880.17290.2521石缝(SF)339.081.39081.25180.14740.2192石槽(SC)344.831.44831.27030.16250.2442石洞(SD)345.981.45981.30540.17670.2615均值(AV)343.911.43911.29780.17100.2521物种水平Species level1578.161.79311.50860.29230.4320
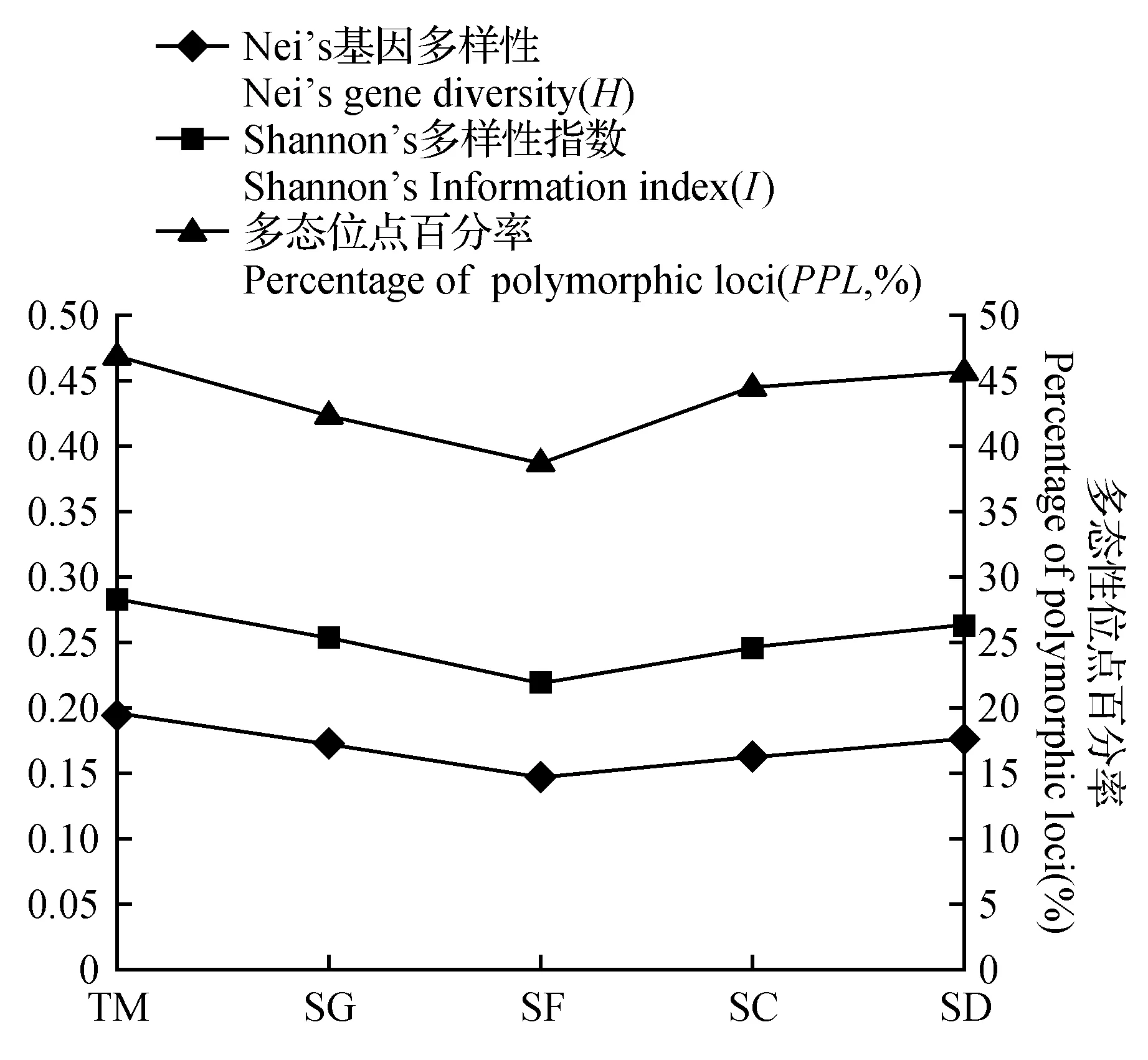
图2 5类小生境小蓬竹的遗传变异指数统计Fig.2 The genetic variation indices of A.luodianensis in five microhabitats
5类小生境中小蓬竹的遗传变异指数统计图(图2)表明,Shannon’s指数(I)与Nei’s基因的多样性指数(H)显示的各种小生境的遗传多样性变异一致,与多态百分比(PPL)表示略有差别,但趋势相似。
根据Nei’s基因多样性指数估算得5类不同小生境中小蓬竹的基因分化系数(Gst)为0.405 4(表4),即各种小生境间的遗传变异是总变异的40.54%,居群内变异占比为59.46%。Gst显示的遗传分化状况表明,小蓬竹遗传变异仍然是以居群内的变异为主。但不同小生境之间的遗传变异比例(40.54%)较大,说明不同小生境差异在较大程度上促进了小蓬竹的遗传变异,增加了小蓬竹的遗传多样性,从而提高小蓬竹对特殊喀斯特生境的适应能力。
由Gst计算得基因流Nm=0.704 5<1,表明各个小生境之间并无基因流动。
表4不同小生境小蓬竹的遗传分化
Table4GeneticdifferentiationofA.luodianensisindifferentmicrohabitats

指数Indexes居群内基因多样性Gene diversity of species(Ht)居群总的基因多样性Gene diversity within populations(Hs)遗传分化系数Coefficientof gene differentiation(Gst)基因流Estimate of gene flow(Nm)平均数Mean number0.29230.17100.41510.7045标准差Standarddeviation0.03590.0206
GmorGcs,Nm=0.5(1-Gst)/Gst
2.3 遗传相似性与聚类分析
根据5类小生境间的Nei’s遗传相似性系数和Nei’s遗传距离,对各小生境间小蓬竹的遗传相似性程度定量地进行分析,结果表明:
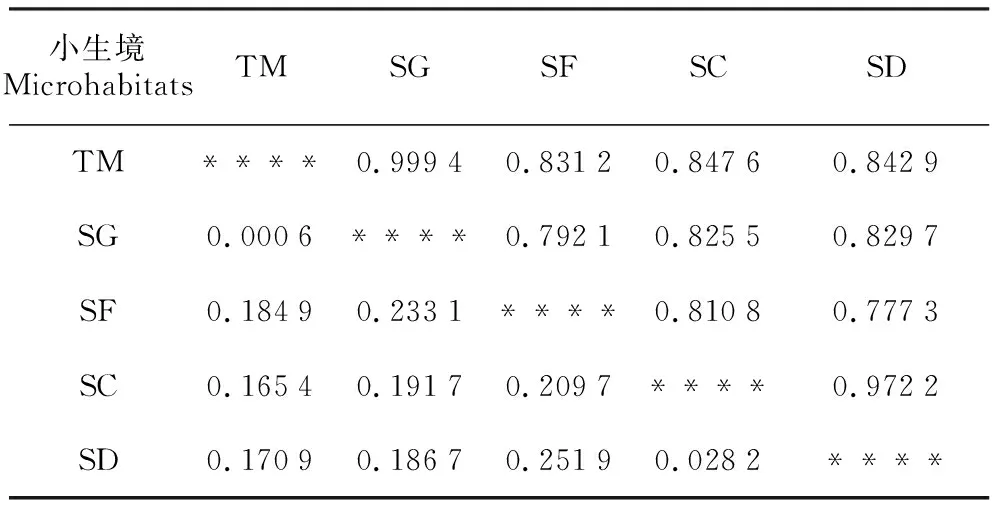
各类小生境间遗传相似性系数(I)在0.777 3~0.999 4,平均为0.865 6,遗传距离(D)在0.000 6~0.251 9,平均为0.148 3。由于是小生境,其遗传相似性系数都较大,遗传距离均较小,应分别大于和小于不同天然地理大居群的对应值,这有待进一步研究证明。其中,石沟(SG)和土面(TM)两类小生境间小蓬竹的遗传相似性系数(I)最大,为0.999 4,遗传距离最小,D=0.000 6,说明这两类小生境间小蓬竹的遗传相似度最高,变异分化程度最低。遗传距离(D)最大的是石洞(SD)和石缝(SF)生境,其遗传距离D=0.251 9,说明在5类小生境中,石洞(SD)和石缝(SF)生境间小蓬竹的遗传变异度最高,相似度最低,遗传分化程度最大(表5)。
表5不同小生境中小蓬竹的Nei’s遗传相似性系数和遗传距离
Table5Nei’sunbiasedmeasuresofgenticidentityanddistanceofA.luodianensisindifferentmicrohabitats
小生境MicrohabitatsTMSGSFSCSDTM****0.99940.83120.84760.8429SG0.0006****0.79210.82550.8297SF0.18490.2331****0.81080.7773SC0.16540.19170.2097****0.9722SD0.17090.18670.25190.0282****
根据Nei’s遗传相似性和遗传距离,使用NTSYSpc V2.10e软件通过UPGMA法构建了5类小生境中小蓬竹的遗传关系聚类图。聚为同一类者,相应的遗传特性较一致,遗传关系最接近,遗传相似性最高,根据生物遗传多样性与生境之间存在的互作关系,可猜测对应小生境之间生态因子的差异性亦为最小。
聚类结果(图3)显示,首先5类小生境的小蓬竹聚为两大类:石缝(SF)单独为一类,土面(TM)与石沟(SG)、石槽(SC)和石洞(SD)聚为一类。说明石缝(SF)小生境小蓬竹的遗传多样性与其他4类小生境中的遗传多样性之间存在较大差异。其次,土面(TM)与石沟(SG)相聚,石槽(SC)与石洞(SD)相聚,然后四者共同相聚为一类,与石缝(SF)对应,说明土面(TM)小生境与石沟(SG)小生境中小蓬竹的遗传多样性相似,石槽(SC)与石洞(SD)小生境中小蓬竹的遗传多样性相似。聚类结果与遗传相似度计算结果相符。
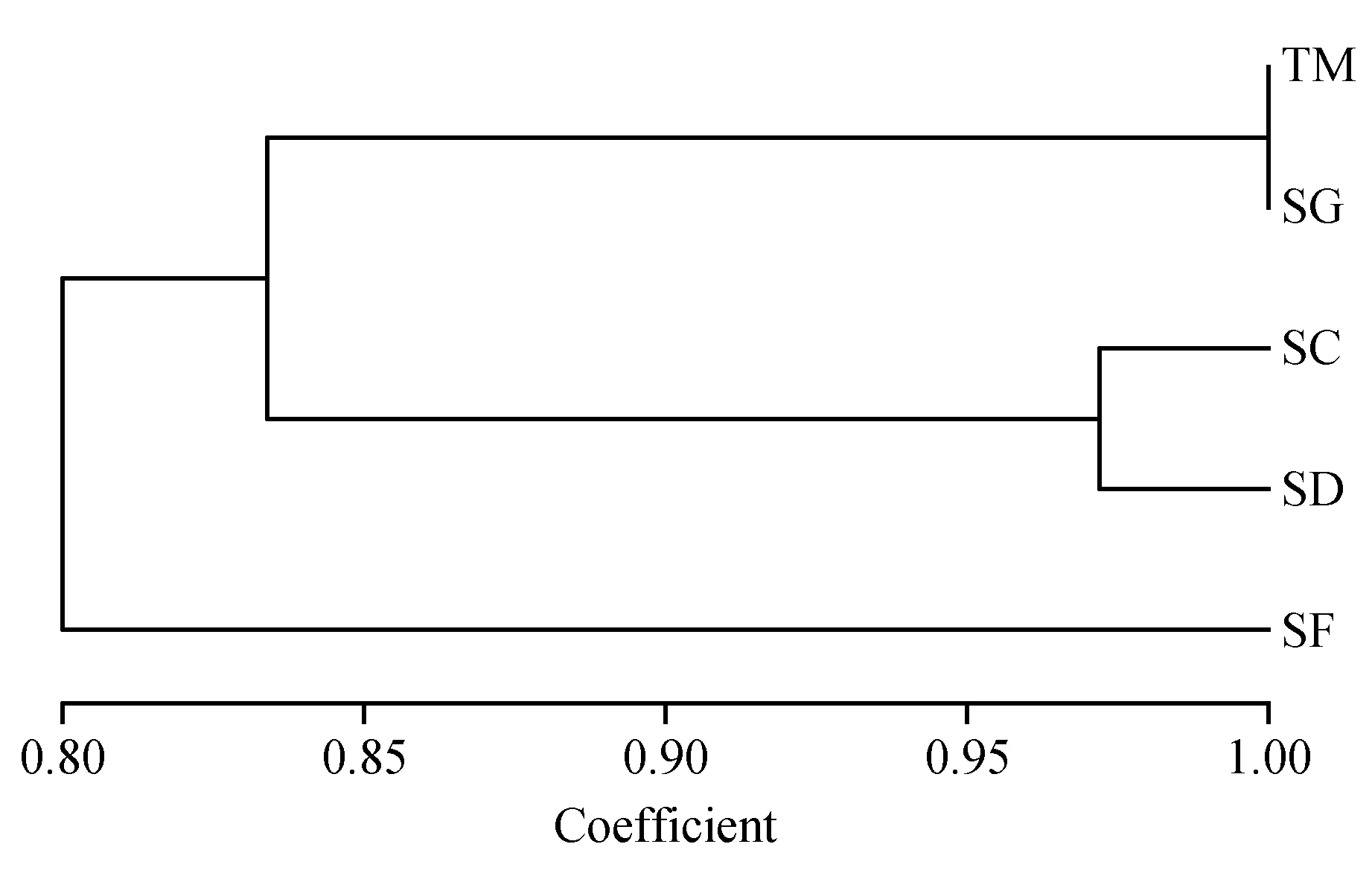
图3 基于RAPD标记的5类小生境中小蓬竹的UPGMA聚类图Fig.3 UPGMA dendrogram for 5 different microhabitatsof A.luodianensisbased on RAPD markers
3 讨论
3.1 喀斯特生境对小蓬竹遗传多样性的影响
喀斯特生境系统是由各类不同小生境共同组建而成的复合整体,该类生境的生态有效性取决于各类小生境之间的组建情形,小生境差异及其复合整体的多样性又直接决定了喀斯特生境的高度异质性。而极危物种小蓬竹则专一分布于这类生境破碎化、高度异质且土壤尤为稀薄的喀斯特山地。
本研究对5类小生境中的小蓬竹进行了遗传分析,结果表明,不同小生境间的遗传分化系数Gst=0.415 1,基因流Nm=0.704 5,即不同小生境间小蓬竹的遗传变异度较高。不同小生境间遗传相似系数变化范围为0.777 3~0.999 4,平均为0.865 6;遗传距离D从0.000 6~0.251 9不等,平均为0.148 3。5类小生境的小蓬竹聚为两大类:石缝(SF)单独为一支;首先土面(TM)与石沟(SG)相聚,石槽(SC)与石洞(SD)相聚,然后四者相聚为一支,与石缝(SF)对应,聚为一类的亲缘关系较近。进一步说明,不同小生境之间具较高遗传多样性。本文作者也曾在小蓬竹所生长的不同小生境条件土壤的理化性质方面有所研究,发现不同小生境的土壤,其含水率、有机质、水解性氮、速效钾、有效磷等都存在较大差距,其中属含水量差异最大[21]。因此,不同小生境的环境因子差异可能是造成小蓬竹遗传多样性差异的原因,小生境生态因子差异与小蓬竹遗传多样性之间的关系有待进一步探究。
3.2 小蓬竹濒危机制分析
小蓬竹是编入《IUCN红色名录》和《中国物种红色名录》的极危竹种,马乃训和陈光才[22]在其“竹类植物濒危等级标准”中亦将小蓬竹归为Ⅰ级保护物种即濒危物种。
根据本研究的RAPD分析结果,目前为止小蓬竹尚且保存较高的遗传多样性,其遗传变异也仍然主要存在居群内部。该结论证明,小蓬竹种群自身的遗传变异不是致使其濒危的主要原因。由此证明遗传基础并非致使小蓬竹濒危的关键因素,人为活动等外界干扰才是造成小蓬竹濒危的主要原因。根据本研究组的调研,在二十世纪末期,小蓬竹原生地的造纸厂对其进行过度利用,影响极其严重的是新生竹幼苗被大量砍伐,直接导致了其无性系种群的迅速衰退,成竹不断衰老、死亡,种群规模剧烈下降;另外,小蓬竹分布地居民有意或无意地烧山行为也对小蓬竹居群造成了毁灭性的坏破。
小蓬竹生境质量持续下降是促使其种群濒危的直接原因。野外调研发现,小蓬竹特殊的生境选择也对自身造成了威胁。在同经纬度地区,小蓬竹只在喀斯特石山分布,泥土山坡则完全不生长,但它对生境的水分含量又有一定要求,所以,分布区干旱也会造成成片小蓬竹森林消失。恶劣生境条件下,小蓬竹会采取开花结籽的方式保存物种,然而遭遇连续干旱气候,产生的种子也无法及时发芽繁衍以恢复种群。调查发现,不少曾经繁茂的居群,历经连续干旱、冰冻后便只剩斑点分布甚至荡然无存。另外,小蓬竹濒危的原因与自身繁殖能力和特殊的繁殖方式差亦有很大关系。小蓬竹是一次性开花竹种,主要以分蔸方式繁殖,一旦开花就立即死亡,种群更新与恢复极其困难。
虽然小蓬竹的濒危机制主要是人为干扰、生境破坏,遗传多样性居于次要地位,但生物体本身与其生存环境之间是相互作用、相互影响的,小蓬竹生长立地条件的破坏和生境退化等也会造成种群数量下降和种群隔离,最终导致物种遗传多样性降低甚至整个物种的灭绝。
3.3 小蓬竹种群保护策略
保护珍稀濒危物种的关键,在于保护它们的遗传多样性和进化潜能。物种遗传变异度愈高,多样性越丰富,越能适应环境,其进化潜能也更高。
科学制定珍稀濒危物种保护策略,前提需要大量、深入地研究和充分了解该物种的遗传多样性与遗传结构,而两个遗传变异主要发生在居群之间和居群之内的物种,在对其开展保护性研究时所采取的取样与保护方针应是完全不相同的。葛颂的研究表明,基因流弱,遗传分化度较高,Gst=0.60的物种,实际研究中最低需取6个居群,方可获得该物种95%的遗传多样性,但若是基因流较强,遗传分化度较低,Gst=0.20的物种,则做2个居群的取样即可得到相同的效果[23]。
小蓬竹种的Gst值为0.323 1,种内具有丰富的遗传多样性,故在取样时须取3或4个居群,取样的数目固定时,居群内的取样数量可适当减少。在制定保护措施时,要保护尽可能多的居群,须高度重视就地保护。由于小蓬竹原分布区生境恶劣,亦可考虑科学合理地实行迁地保护,并不断加强和深化小蓬竹遗传学、生殖生态学、植物生理学、种苗育林等方面的研究,实行扦插繁育、组织培养和遗传育种等。建立小蓬竹快速繁殖体系是对其进行切实保护与合理开发利用急需开展的研究。

