空气等离子体技术对面包酵母的诱变选育研究
(石家庄学院化工学院,河北石家庄 050035)
面包酵母即酿酒酵母(Saccharomycescerevisiae)是人类掌握并利用的较早的微生物,几千年前人类就使用面包酵母来制作主食,现代食品工业中也被广泛使用[1]。好的面包酵母应具备较高的糖酵解效率和麦芽糖发酵利用率、快速的底物适应性和繁殖能力、适宜的水解能力、较强的耐受性等特点[2-4]。目前,由于冷冻面团的开发和利用,对于面包酵母的低温适应性能等又有了更高的要求。
空气等离子体是低温等离子体的一种,属于活化放电激发形成等离子体,其发生装置简单,易于操作[5]。近几年,有关等离子体技术应用于微生物育种改良的研究已取得了较大的进展。如李小坤等[6]利用常压室温等离子体技术进行诱变育种,在处理时间为55 s的情况下,筛选出一株高RNA含量的酿酒酵母,并对其培养条件进行了优化。曹纲等[7]利用等离子体诱变技术处理乳酸克鲁维酵母,得到了一株对苯乙酮转化率高达91.8%的菌株。目前,空气等离子体技术在面包酵母上的应用未见报道。
本文拟使用空气等离子体技术对面包酵母进行诱变育种工作,以期得到高发酵力、高抗葡萄糖阻遏能力和高耐低温能力的,具有良好传代稳定性的优良菌株,同时为空气等离子体技术在面包酵母菌种选育中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
面包酵母BY-1、BY-2、BY-3、BY-4、BY-5 实验室保藏;面包酵母BY-6 分离自安琪干酵母;麦芽糖标准品(94.3%)、葡萄糖标准品(98%) 中国食品药品检定研究院;小麦粉 包头宏基面粉有限公司;酵母膏、蛋白胨、琼脂粉 北京奥博星生物技术有限责任公司;乙腈(色谱纯) 美国Fisher试剂公司。
Agilent 1200series高效液相色谱仪(配备Agilent-380-ELSD蒸发光检测器) 美国安捷伦公司;电火花发射及检测器 三鱼电气设备有限公司;HH-2数显恒温水浴锅 金坛市杰瑞尔电器有限公司;3K15高速冷冻离心机 美国Sigma公司。
1.2 实验方法
1.2.1 培养基的制备
1.2.1.1 YPD培养基的制备 分别称取质量分数为1%的酵母膏,2%的蛋白胨,2%的葡萄糖,在121 ℃下灭菌20 min(固体培养基需另加入2%琼脂)。
1.2.1.2 液体发酵培养基(Liquid Fermentation,LF)的制备 向高纯水中分别加入质量分数为1%的葡萄糖、3%的蔗糖、3%的麦芽糖、0.25%的(NH)2SO4、0.50%的尿素、1.6%的KH2PO4、0.50%的Na2HPO4·12H2O、0.06%的MgSO4、0.0225‰的烟酸、0.005‰的泛酸、0.0025‰的VB1、0.00125‰的VB6、0.001‰的VB2、0.0005‰的叶酸,混匀,灭菌后备用[8]。
1.2.1.3 麦芽糖模拟面团培养基的制备 糖类只添加质量分数为3.8%的麦芽糖,其它同1.2.1.2[9]。
1.2.1.4 混合糖模拟面团培养基的制备 糖类只添加质量分数为3.325%的麦芽糖和0.5%的葡萄糖,其它同1.2.1.2[9]。
1.2.2 酵母菌的活化 用接种环挑取酵母斜面保存菌种一环,接入YPD培养基中,于恒温摇床上30 ℃,150 r/min培养20 h。3000 r/min离心10 min,将菌体使用无菌水清洗2次,接种于固体培养基,备用[10]。
1.2.3 发酵力的测定 本研究采用失重法[11-12]测定菌种的发酵力(F),用量筒量取50 mL LF培养基,加入1.0 g活化后的酵母,将锥形瓶置于30 ℃恒温摇床上,150 r/min培养3 h,每30 min记录质量,用重量的变化来表示酵母发酵力大小,见公式(1):
式(1)
式中:F为菌种的发酵力,mg/(h·g);X前为发酵前锥形瓶的重量,mg;X后为发酵后锥形瓶的重量,mg;T为发酵时间,h;m为添加酵母的重量,g。
1.2.4 初始菌种的选择 取面包酵母BY-1、BY-2、BY-3、BY-4、BY-5、BY-6,采用失重法测定其发酵力的大小,择优选择初始菌种。
1.2.5 空气等离子体对初始菌种的诱变 把等离子体装置放置于超净台中,取灭菌后的5枚小铁片分别标号为0、1、2、3、4、5置于5个平板中。用移液枪分别移取1.2.4所挑选的初始酵母菌液10 μL于小铁片上,使小铁片距电火花发射端约1 cm,开启设备,分别作用0、5、10、15、20、25 s,将作用后的铁片放入盛有适量无菌生理盐水的离心管中,震荡洗脱菌液,将洗脱后的菌液进行适当稀释,并进行平板涂布,30 ℃培养20 h,计算致死率。
从每批处理后的菌株中随机挑取50株菌株进行斜面保藏,同时测定其发酵力,以发酵力高于初始菌株发酵力的5%以上为正突变,计算正突变率。
1.2.6 高发酵力菌种筛选及传代稳定性的测定 测定筛选得到的正突变菌株发酵力,从而得到高发酵力菌株;选取筛选得到的发酵力较高的面包酵母菌株在菌种斜面培养基上进行传代,取1、3、6、9、15代的菌株进行发酵力的测定。
1.2.7 蔗糖酶活力的测定 为了保持细胞的通透性及活性,在高糖环境中面包酵母应具备较低的蔗糖酶活力[13-14]。
1.2.7.1 葡萄糖标准曲线的制作 取6支干燥洁净的试管,分别加入0.01 mol/L的葡萄糖标准液0、0.3、0.6、0.9、1.2、1.5 mL,加水至2 mL,混匀后加入DNS显色液2 mL,然后置入沸水浴中加热5 min,冷却后加水至20 mL,以未加入葡萄糖标准液的试管为空白,在540 nm处测定吸光度值并绘制标准曲线。
1.2.7.2 酵母干物质含量的测定 准确称取1.0 g待测酵母于电热干燥箱中,95 ℃干燥4 h,然后置于干燥器中冷却,称重,并根据公式(2)计算干物质含量。

式(2)
式中:m1为未烘干前的鲜酵母质量,g;m2为烘干后干物质的质量,g。
1.2.7.3 蔗糖酶活力的测定 取洁净试管加入0.1 mol/L的蔗糖溶液1.0 mL,NaAc-HAc缓冲液(pH=5.2)2.0 mL,水6.5 mL,混匀后于30 ℃水浴中平衡5 min,加入0.5 mL已知浓度的酵母液,迅速混匀后继续在30 ℃下恒温5 min,取1 mL反应液于先加入2 mL DNS溶液的试管中,沸水浴5 min,冷却后测定吸光度值[9],并根据标准曲线求得葡萄糖含量。见公式(3)

式(3)
式中:蔗糖酶活力为在30 ℃,pH为5.2的条件下,每分钟每g酵母干物质分解蔗糖产生1 mg葡萄糖为一个活力单位,U;A为根据标准曲线方程求得的葡萄糖含量,μmol;0.180为1 μmol葡萄糖的摩尔质量,mg;5为显色反应时间,min;0.5为加入的酵母液的体积,mL;c为酵母液浓度,g/mL。
1.2.8 葡萄糖阻遏能力的测定 酵母对面团的发酵作用存在葡萄糖阻遏效应[15-16],优良的面包酵母应具备较低的葡萄糖阻遏,这样才能缩短发酵过程的延滞期,提升酵母的发酵能力。
1.2.8.1 液相色谱检测条件 色谱柱:Carbohydrate柱(4.6×150 mm,5 μm);柱温:30 ℃;流动相:乙腈∶水=75∶25;流速:0.7 mL/min;进样量:3.0 μL;ELSD气化室温度:80 ℃;气体压力:3.5 bar。
1.2.8.2 待测溶液的处理与测定 称取1.0 g酵母,在超净台中操作分别接入100 mL麦芽糖模拟面团培养基和混合糖模拟面团培养基中,置于30 ℃培养箱中静置发酵3 h,每隔30 min按照1.2.8.1中的方法进行测定,绘制耗糖曲线[9],并根据公式(4)计算葡萄糖阻遏能力。
式(4)
式中:发酵结束时混合糖发酵液中总糖糖耗为u1;麦芽糖发酵液中糖耗为u2。
1.2.9 菌种耐冷冻性的测定 冷冻面团技术是一种极为方便的食品工业技术,而面包酵母对低温的耐受性直接决定了冷冻面团的质量[17-19]。对高发酵力的诱变菌株进行耐冷冻性能测定,测定方法如下:
取1.0 g酵母加入50 mL LP培养基中,30 ℃下保温30 min,测定未冷冻酵母发酵力。取1.0 g酵母加入50 mL LP培养基中,-20 ℃冰箱中冷冻两周,解冻至30 ℃后测定菌株冷冻发酵力。取新鲜酵母泥于-20 ℃冰箱中冷冻两周,解冻至30 ℃后,测定酵母泥冷冻发酵力。
相对发酵力(%)=冷冻后发酵力×100/冷冻前发酵力
1.3 数据处理
每组实验进行3个平行样,每个平行实验测定3次取其平均值,结果用“平均值±标准差表示”。数据差异显著性采用SPSS 18.0软件分析。
2 结果与分析
2.1 初始菌株的确定
对不同来源的6株菌种进行发酵力测定实验,并采用失重法测定其发酵力数值,实验结果见图1。由实验结果可知,在6株酵母菌种中,BY-3的发酵力达到(140.906±0.539) mg/(h·g),均高于其它5株酵母菌种,因此选择BY-3为初始菌株,进行空气等离子体诱变。

图1 不同菌株的发酵力测定Fig.1 Fermentation ability of different strains注:图中不同小写字母表示差异显著(P<0.05)。图2、图3、图5、图7、图8同。
2.2 空气等离子体对面包酵母菌株的筛选
2.2.1 作用时间对致死率影响 如图2所示,在空气等离子体的作用下,随着作用时间增加,细胞致死率明显升高,作用10 s时其致死率达到61.807%±0.881%,作用25 s时,致死率为100%。因此下文正突变率选择作用时间为5~20 s。

图2 作用时间和致死率的关系Fig.2 Relationship of treatment time and lethality rate
2.2.2 作用时间与正突变率的关系 结果如图3所示,正突变菌种多出现在作用10 s时,该点正突变率达到22.000%±0.592%。因此,选择10 s为最佳的作用时间。

图3 作用时间和正突变率的关系Fig.3 Relationship of treatment time and positive mutation rate
2.2.3 高发酵力菌株的获得 以酵母菌BY-3为出发菌株,在10 s下反复诱变[20],得到正突变菌株22株,并测其发酵力,结果如图4所示,以改良菌株3G-10和3G-28的发酵力提高最为显著(P<0.05),其中3G-28的发酵力达到209.347 mg/(h·g),较初始菌株BY-3的140.906 mg/(h·g)高出了48.57%。

图4 正突变菌株发酵力对比Fig.4 Fermentation ability of positive mutation strains
2.2.4 传代稳定性测定 将BY-3和筛选得到的3G-10和3G-28进行传代稳定性测试对比,测定结果如图5所示,在传代过程中发现,3株菌种的发酵力均出现波动,相比较其它两株菌种,3G-28的发酵力浮动较平稳,发酵力衰退较慢,传代15次,其发酵力仍可保持87.5%。可见,菌种3G-28在传代稳定性方面表现优异。

图5 不同传代次数下菌株的发酵力Fig.5 Fermenting power of different strains at different passage number
2.3 蔗糖酶活力的测定
2.3.1 标准曲线的绘制 在540 nm下所测定的葡萄糖标准曲线如图6所示,标准方程为y=0.1023x+0.0409,R2=0.9992,线性关系良好。

图6 葡萄糖标准曲线Fig.6 Standard curve of glucose

表1 菌株BY-3和3G-28在混合糖液体培养基中的麦芽糖耗糖结果Table 1 Maltose consumption curve of BY-3 and 3G-28 in liquid medium of mixed sugar
注:同列间不同的字母表示差异显著(P<0.05);表2~表3同。

表2 BY-3和3G-28菌株在混合糖液体培养基中的葡萄糖糖耗糖结果Table 2 Glucose consumption curve of BY-3 and 3G-28 in liquid medium of mixed sugar

表3 BY-3和3G-28菌株在麦芽糖液体培养基中的耗糖结果Table 3 Consumption curve of BY-3 and 3G-28 in liquid medium of maltose
2.3.2 蔗糖酶活力测定结果 蔗糖酶酶活是影响高糖面团中酵母发酵力的主要因素,对诱变得到的高发酵力菌株3G-28及原始菌株BY-3进行蔗糖酶活力测定,结果如图7所示,3G-28的蔗糖酶活力为10.944 U/g酵母干物质,较对照株BY-3降低了71.89%。说明与出发菌株相比,经诱变后的菌株3G-28具有更好的耐高糖性能。

图7 不同菌株的蔗糖酶活力Fig.7 Invertase activity of different strains
2.4 葡萄糖阻遏能力的测定
2.4.1 菌株在混合糖模拟面团液体培养基中的耗糖曲线 菌株BY-3和3G-28在混合糖模拟面团液体培养基中3 h内的耗糖实验结果如表1、表2所示,菌株3G-28与BY-3对混合糖液中麦芽糖的消耗量存在显著性差异(P<0.05),而对葡萄糖的消耗没有显著性差异,造成该现象的原因可能是葡萄糖总量含量较低,但发酵结束时,菌株3G-28对麦芽糖和葡萄糖的消耗速率均高于菌株BY-3。
2.4.2 菌株在单独糖模拟面团液体培养基中的耗糖曲线 由表3可知,在发酵1 h内,菌株3G-28与BY-3对于麦芽糖的消耗量存在显著性差异(P<0.05),当发酵结束时,二者糖耗趋于一致,但3 h总耗糖量较混合糖液培养基明显增加,其原因可能是存在葡萄糖阻遏现象。
2.4.3 菌株的葡萄糖阻遏现象对比 BY-3和3G-28的葡萄糖阻遏能力对比如图8所示,筛选菌株3G-28与初始菌株BY-3相比,抗葡萄糖阻遏现象的能力有明显增加,提高了34.84%。
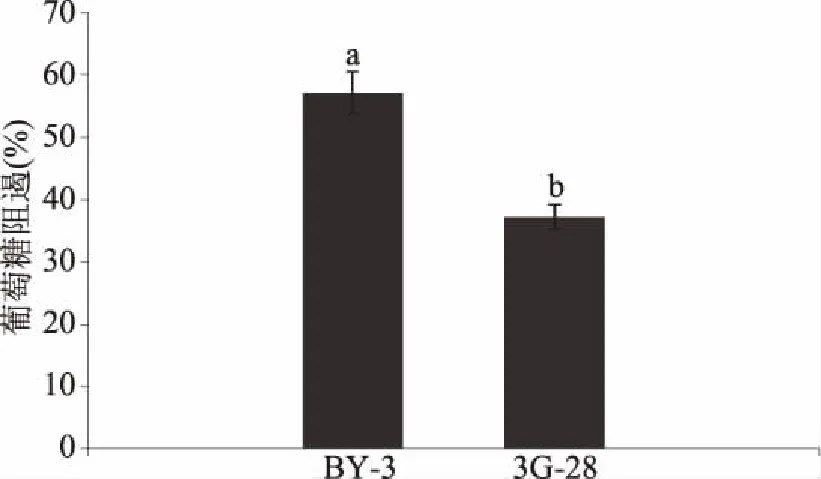
图8 BY-3和3G-28菌株的葡萄糖阻遏程度Fig.8 Glucose repression of BY-3 and 3G-28
2.5 菌株耐冷冻性的测定
测定结果如表4所示。从表中可以看出,无论是直接冷冻酵母泥还是冷冻发酵液,3G-28的相对发酵力均高于BY-3。可见3G-28具有较好的耐低温性能。
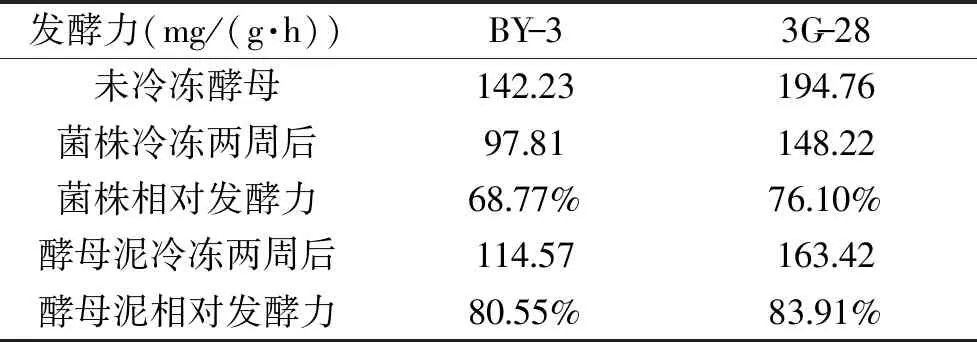
表4 BY-3和3G-28菌株的相对发酵力Table 4 Relative fermenting power of BY-3 and 3G-28
3 结论
本文将空气等离子体技术应用于面包酵母菌种选育工作中,以酵母菌BY-3为初始菌株,经过诱变得到高发酵力菌株3G-28,该菌传代稳定性良好,其发酵力较初始菌株BY-3提高了48.57%。对该菌株的性能进行测定,发现经过空气等离子体诱变后,3G-28菌株在高糖面团和无糖面团中均能保持较高的酵母活力,其蔗糖酶活力较初始菌株BY-3降低了71.89%;抗葡萄糖阻遏现象的能力提高了34.84%。除此之外,3G-28菌株在低温耐受性方面优于初始菌株BY-3:在-20 ℃低温下进行保藏,两周后,其菌株的相对发酵力可达到76.10%,酵母泥的相对发酵力为83.91%。本实验为面包酵母的菌种选育提供了一定依据,但突变株3G-28性能提高的机理尚不清楚,有待研究。

