鹰嘴豆中植物甾醇的提取工艺优化及其抑菌活性
,2,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083; 2.农业部农业转基因生物安全评价(食用)重点实验室,北京 100083; 3.农业部农产品贮藏保鲜质量安全风险评估实验室(北京),北京 100083)
鹰嘴豆(CicerarietinumLinn)是豆科一年生草本植物。别名鸡头豆。鹰嘴豆种子长5~9 mm,直径4~7 mm。气无,味淡,质地坚硬,表面呈现淡白色或微红色。种脐附近有喙状突起,形似鹰头。其栽培历史悠久,可追溯至9500年前的亚洲西部和地中海沿岸。目前主要分布在较为温暖干旱的地区,是世界第二大消费豆类,也是栽培面积较广的食用豆类作物之一[1]。
鹰嘴豆富含多种植物蛋白、碳水化合物、粗纤维、异黄酮及钙、镁、铁等成分,其蛋白质功效比、氨基酸的含量以及消化率等均优于其他豆类[2]。鹰嘴豆具有非常高的食用价值,目前,国内外的学者研究发现,食用鹰嘴豆及其相关产品可以降低血清血脂水平,同时减少胆固醇的累积,对于心脑血管疾病等具有明显的预防作用[3-5]。鹰嘴豆具有低淀粉、较高粗纤维含量的特征,因此是糖尿病患者的理想食品。其蛋白质降解产物具有显著的抗氧化作用,对治疗便秘和预防直肠癌具有积极作用[6-8]。也有大量研究证明鹰嘴豆在降血脂、降血糖等方面具有明显的效果[9-11]。例如傅樱花等考察了鹰嘴豆酸奶(CY)和鹰嘴豆粗黄酮(CCFE)对链脲佐菌素(STZ)诱导的糖尿病小鼠降血糖活性,其结果表明鹰嘴豆酸奶(CY)可能与增强肝糖原合成能力有关,从而降低糖尿病小鼠模型的血糖[12];张泽生等研究了鹰嘴豆中D-松醇对STZ诱导的II型糖尿病小鼠的降血糖功效,其结果表明鹰嘴豆中D-松醇可有效改善患病小鼠糖耐量,降低患病小鼠的空腹血糖,同时具有一定修复肝损伤的功效[13]。姚余祥等人以鹰嘴豆为原材料,制备了降胆固醇活性肽,其在动物实验中证明具有一定效果[14]。
随着生命科学、食品工程及油脂科学与工程技术的高速发展,甾醇类物质在食品、化工、饲料和医药等多个领域得到了人们广泛的关注和重视。现已有许多研究证实从一些物质中提取出的植物甾醇具有良好的抑菌效果[15],但国内外对鹰嘴豆中植物甾醇作用的研究尚未见报道。因此,本文拟将超声波提取法和柱吸附法相结合,优化鹰嘴豆中植物甾醇的提取,纯化提取产物,并进一步鹰嘴豆中植物甾醇对常见菌种的抑制作用及程度,旨在为鹰嘴豆中甾醇的综合利用以及研发一些新型食品添加剂提供理论依据。
1 材料与方法
1.1 材料与仪器
鹰嘴豆 当地市场;大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌 中国农业大学食品科学与营养工程学院转基因生物安全评价(食用)重点实验室;甾醇标准品(胆固醇、胆甾烷醇、菜油甾醇、菜籽甾醇、豆甾醇、β-谷甾醇)、青-链霉素混合液N-甲基-N-三甲基硅烷基七氟丁酰胺、1-甲基咪唑 美国Sigma公司;柱层析硅胶、六水合三氯化铁、氢氧化钾、乙酸乙酯、无水乙醇、石油醚、无水乙醚、磷酸 均为分析纯,西亚试剂。
JY98-IIIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;101-0ES型电热鼓风干燥箱 上海科恒实业发展有限公司;LGJ-25C型冷冻干燥机 北京四环科学仪器厂有限公司;FW100型高速万能粉碎机 天津泰斯特仪器有限公司;TGL-16M台式高速冷冻离心机 美国Beckman Coulter公司;Varioskan Flash全波长酶标仪 美国赛默飞世尔科技公司;GC6890-MS5973气相色谱质谱联用仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 样品前处理 将鹰嘴豆清洗、烘干后,使用粉碎机粉碎,过40目筛并收集筛下豆粉,用于后续实验。
1.2.2 超声波辅助提取单因素实验 选择乙酸乙酯为提取溶剂,使用超声波细胞破碎仪进行植物甾醇的提取,称取5.0 g鹰嘴豆粉。固定液料比10∶1 mL/g,提取时间7 min,选取超声功率分别为250、300、350、400、450 W进行试验,考察超声功率对植物甾醇提取率的影响。在液料比为10∶1 mL/g,超声功率300 W的条件下,选取提取时间分别为3、5、7、9、11 min进行试验,考察提取时间对植物甾醇提取率的影响。在超声功率300 W,提取时间为7 min的条件下,选取液料比分别为5∶1、8∶1、10∶1、12∶1、15∶1 mL/g进行试验,考察液料比对植物甾醇提取率的影响。
1.2.3 响应面优化试验 在单因素实验条件初步确定的基础上,以超声功率、提取时间、液料比为自变量,以鹰嘴豆中植物甾醇的提取率为评定响应值,进行三因素三水平的响应面分析试验。试验水平与因素设定见表1。

表1 因素水平表Table 1 Factors and levels table
用二阶多项模型对独立变量与响应值之间的相互关系进行拟合,进一步预测最佳制备条件。
式中,Y为预测值,即粗提物中植物甾醇提取率的预测值。A0为回归系数,Ai与Aii分别是对Xi的一次和二次效应,Aij表示Xi与Xj之间的线性交互效应。
1.2.4 植物甾醇提取率的测定 使用比色法检测粗提物中植物甾醇的含量[16-17]。
1.2.4.1 标准曲线的制作 使用少量无水乙醇将100 mgβ-谷甾醇标准品溶解,并转入100 mL容量瓶中定容。使用前稀释10倍,即母液质量浓度为0.1 mg/mL。分别取0.0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mL的0.1 mg/mLβ-谷甾醇溶液于试管中,继续添加无水乙醇至4.0 mL,加入2.0 mL硫磷铁显色剂,振荡摇匀,15 min后在波长538 nm处测定其吸光度值。以β-谷甾醇溶液质量浓度(单位为mg/mL)为横坐标,以吸光度值(A)为纵坐标,绘制标准曲线。
1.2.4.2 提取率的计算 记鹰嘴豆粉干重为m1(单位为g),超声波辅助提取得到的粗提物总质量为m2(单位为mg),称取质量为m3(单位为mg)粗提物溶于4.0 mL无水乙醇,并加入2.0 mL硫磷铁显色剂,总体积为6 mL。室温下振荡摇匀,经15 min冷却后在波长538 nm处检测其吸光度值,代入标准曲线中,算得粗提物中植物甾醇质量浓度值c1,按下述公式计算植物甾醇提取率C(单位为mg/100 g·dw)。
1.2.5 植物甾醇的分离纯化 将1.2.3的优化实验条件后提取得到的粗提物分离纯化。预先使用无水乙醇配制成浓度0.1 mg/mL的醇溶液。采用硅胶柱层析法进行分离纯化,具体步骤为:取约8.0 g的层析硅胶,110 ℃下活化10 min后湿法装柱。加入样品后,静置1 h使固定相充分吸附甾醇样品,使用体积比为10∶1的石油醚-无水乙醚流动相体系进行洗脱,控制流速在1 mL/min左右,收集洗脱产物[18]。旋转蒸发挥干有机溶剂后,使用硫磷铁法检测植物甾醇得率。
1.2.6 植物甾醇的种类鉴定 使用气相色谱质谱联用法(GC-MS)对分离纯化后的样品进行种类鉴定,以明确主要甾醇的种类及其所占比例。取1 mL纯化后的样品,加入20 μg胆甾烷醇作为内标,加入2 mol/L氢氧化钾-乙醇溶液2 mL,涡旋振荡1 min混匀。70 ℃水浴振摇45 min,室温冷却。加入二氯甲烷5 mL,超纯水3 mL,混合均匀,8000 r/min离心5 min弃上清,再用5 mL超纯水洗三次,弃上清,氮气吹干有机相,4 ℃贮存备用。
称取各甾醇标准品5 mg(β-谷甾醇10 mg),分别用丙酮配制浓度梯度为0.1、0.2、0.3、0.4、0.5 mg/mL的甾醇混合标准溶液,氮吹吹干后,甾醇混合标准溶液与提取的甾醇样品中均加入100 μL衍生剂(N-甲基-N-三甲基硅烷基七氟丁酰胺∶1-甲基咪唑=95∶5,v/v)于75 ℃衍生20 min,使用正己烷定容至1 mL,用于GC-MS检测。
色谱条件:使用J&W DB-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm),升温程序:100 ℃保持1 min,以10 ℃/min升至280 ℃,保持10 min;载气(He)流速1.0 mL/min,压力2.4 kPa,进样1.0 μL,不分流。
质谱条件:电子轰击(EI)离子源;电子能量70 eV;传输线温度290 ℃;离子源温度250 ℃;质量扫描范围m/z 35~500;监测方式SIM模式。
以甾醇混合标准溶液浓度为横坐标,以各甾醇峰面积(经内标校正)为纵坐标,绘制标准工作曲线,用标准工作曲线对试样进行定量,得到其检测浓度。
1.2.7 植物甾醇的抑菌活性的测定 采用抑菌圈法测定分离纯化后植物甾醇的抑菌活性[19-20]。将大肠杆菌、沙门氏菌、金黄色葡萄球菌、枯草芽孢杆菌以划线法分别接种于LB培养基中,并置于37 ℃培养箱中培养18~24 h。分别挑取单菌落,接种于LB液体培养基中,37 ℃摇床中(200 r/min)培养至菌数达对数生长期。取四种菌液体培养基1 mL于9 mL生理盐水中,制成菌悬液,置于4 ℃冰箱中保存。
以青-链霉素混合液(1 mg/mL)作为阳性对照,以丙酮配制成的甾醇样品(1、2 mg/mL)与甾醇标准品(β-谷甾醇,1 mg/mL)为处理组,以丙酮作为阴性对照。在无菌条件下取100 μL菌悬液均匀涂布于LB培养基平板。用无菌镊子夹取灭菌的牛津杯于培养基上,分别取100 μL丙酮溶液、青-链霉素混合液、甾醇样品与甾醇标准品于牛津杯中,37 ℃培养24 h。用无菌镊子去除牛津杯,游标卡尺测量三次抑菌圈直径,记录数据。
1.3 数据处理
使用Design-Expert 8.0.6软件进行响应面实验的设计与数据分析,拟合得到二元方程并绘制三维响应曲面。使用SPSS 17.0进行数据的显著性分析,采用单因素方差分析评价统计参数,使用Duncan法进行多重比较。
2 结果与分析
2.1 单因素实验
2.1.1 标曲的建立β-谷甾醇溶液质量浓度(单位为mg/mL)与吸光度值的标准曲线如图1所示,标曲方程为Y(Abs)=10.103X+0.0432,决定系数R2=0.9871。

图1 植物甾醇浓度标准曲线Fig.1 Standard curve of concentration of phytosterol
2.1.2 单因素实验结果
2.1.2.1 超声功率对植物甾醇提取率的影响 由图2可知,当超声功率为250~400 W时,植物甾醇提取率变化不显著,而当功率继续升高至450 W时,甾醇提取率随功率的增大而显著增大(P<0.05),这说明超声功率对甾醇含量影响较大。考虑到变幅杆所能承受的最大功率为450 W,选择350、400、450 W三个水平用于后续优化实验。
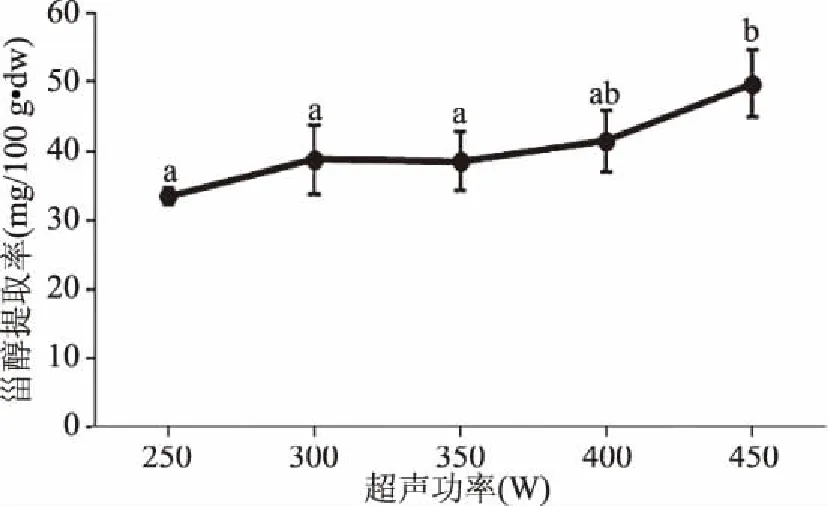
图2 超声功率对甾醇提取的影响Fig.2 Effect of ultrasonic power on extraction yield of phytosterols
2.1.2.2 提取时间对植物甾醇提取率的影响 由图3可知,当提取时间为3~11 min时,植物甾醇提取率呈现出先增大再减小的变化趋势,在9 min时达最大,显著高于其它组(P<0.05)。因此选择7、9、11 min三个水平用于后续优化试验。

图3 提取时间对甾醇提取的影响Fig.3 Effect of time on extraction yield of phytosterols
2.1.2.3 液料比对植物甾醇提取的影响 由图4可知,液料比为8∶1 mL/g时提取率显著高于5∶1 mL/g(P<0.05),但与10∶1、12∶1 mL/g之间无显著差异,整体上呈现出先增大再减小的变化趋势。因此选择5∶1、8∶1、10∶1 mL/g三个水平用于后续优化试验。

图4 液料比对甾醇提取的影响Fig.4 Effect of ratios of liquid to material on extraction yield of phytosterols
2.2 响应面法优化提取工艺条件
2.2.1 响应面法设计及实验结果 响应面法设计及实验结果见表2。

表2 响应面法设计及试验结果Table 2 Response surface methodology design with their observed responses
使用Design-Expert 8.0.6对表2的实验结果进行分析,以总甾醇含量为响应结果,对超声功率(W)、提取时间(min)、液料比(mL/g)建立二元多项回归模型并对其所得数据进行分析,得到的回归分析结果见表3,相应回归方程为:

由表3可知,三因素中超声功率与液料比均对提取率具极显著影响(P<0.01),提取时间对甾醇得率无显著影响(P>0.05);超声功率的二次项(A2)对提取率有显著影响(P<0.05);植物甾醇的提取率随超声功率与液料比的增加均呈现出持续增大的变化趋势。由F值可知,影响超声波—乙酸乙酯提取鹰嘴豆植物甾醇的因素主次顺序为:超声功率>液料比>提取时间。
植物甾醇提取率的三维响应曲面如图5所示。三维响应图中等高线的形状可以表明超声功率、提取时间和液料比之间的交互效应对响应值的影响,椭圆形表示两因素交互作用显著。由此可知,以上三种因素的两两交互作用对响应值无显著性影响。
根据所建立的数学模型,可得出优化后的最佳提取条件:超声功率450 W,提取时间7 min,液料比10∶1 mL/g,此时,预测植物甾醇提取率为66.58 mg/100 g·dw,经验证,在上述条件下,使用乙酸乙酯的实际提取率为(57.99±3.37) mg/100 g·dw。
豆类中植物甾醇的含量较高,仅次于谷类;经响应面法优化后的提取方法成本低,时间短,且试剂可回收利用;鹰嘴豆中植物甾醇的提取率于黄豆(111.08 mg/100 g·dw)与黑豆(83.84 mg/100 g·dw),与绿豆接近(64.07 mg/100 g·dw),高于花豇豆(35.61 mg/100 g·dw)、芸豆(33.01 mg/100 g·dw)等[21]。
2.3 分离纯化与种类鉴定

表3 优化实验回归模型方差分析Table 3 Analysis of variance(ANOVA)for the fitted quadratic polynomial model for optimization of extraction parameters

表4 植物甾醇混合标准品分析定量参数Table 4 Quantitative parameters of mixed standards
注:y=离子丰度/105。

图5 各因素交互作用对植物甾醇提取率的影响Fig.5 Effect of interaction of various factors on the yield of phytosterols注:a.超声功率与提取时间交互作用,液料比为8∶1 mL/g;b.超声功率与液料比交互作用, 提取时间9 min;c.提取时间与液料比交互作用,超声功率400 W。
采用体积比为10∶1的石油醚-无水乙醚流动相体系进行洗脱,经检测,纯化后产物的回收率为53.44%。回收率偏低,可能由以下因素造成:硅胶用量偏少;样品浓度偏大;洗脱剂的种类与比例需进一步调整。本次实验的主要目的为验证甾醇提取物的抑菌活性,因此,可在后续实验中使用柱层析法进一步优化植物甾醇的分离与纯化。
按色谱条件进行分析,混合标准品中各植物甾醇化合物在上述条件下能达到很好的分离效果,浓度范围内标准曲线的相关系数均大于0.998,标准品的分析定量参数如表4所示。
以标准品保留时间与GC-MS中的离子碎片对鹰嘴豆中的主要甾醇进行定性、定量分析,标准品与纯化后样品的总离子流色谱图结果如图6所示。可以看出纯化后的样品中主要含有菜油甾醇、豆甾醇与β-谷甾醇,甾醇的定量分析结果如表5所示,β-谷甾醇含量最高,相对含量达到80.43%,菜油甾醇和豆甾醇的相对含量分别为12.48%和7.09%。纯化后样品中的甾醇种类与相对含量与常见豆类比较接近[17]。

表5 纯化后样品中甾醇的相对含量Table 5 Relative amount of phytosterols after purification

表6 鹰嘴豆中植物甾醇提取物的抑菌圈直径(mm)Table 6 Diameter of zones of inhibition recorded for different microorganisms treated with phytosterols isolated from extract(mm)
注:“-”代表革兰氏阴性菌,“+”代表革兰氏阳性菌;“/”代表无抑菌效果;数字为三次平行试验平均值。

图6 植物甾醇总离子流色谱图Fig.6 Total ion current chromatogram of phytosterol注:a.标准品;b.纯化后样品。
2.4 鹰嘴豆中植物甾醇抑菌活性分析
由表6中可知,丙酮作为阴性对照,不具有抑菌活性;青-链霉素混合液对四种菌的抑制效果最好;甾醇标准品具有抑菌作用,其效果优于鹰嘴豆中的植物甾醇提取物;甾醇提取物对四种菌都具有一定地抑菌效果,其对于枯草芽孢杆菌的抑菌能力最强,鹰嘴豆中植物甾醇提取物的浓度与抑菌效果之间可能具有量效关系,抑菌效果随着甾醇浓度的增加而增强。同时甾醇标准品和甾醇提取物的抑菌效果均为枯草芽孢杆菌>金黄色葡萄球菌>沙门氏菌>大肠杆菌。
对于上述试验中使用的革兰氏阴性菌,甾醇标准品和甾醇提取物对其抑菌效果相似,但2 mg/mL甾醇提取物对于沙门氏菌的抑菌效果比大肠杆菌好。对于革兰氏阳性菌,两者抑制枯草芽孢杆菌效果均强于金黄色葡萄球菌。
3 结论
本次研究的方差分析结果显示:超声功率450 W,提取时间7 min,液料比10∶1 mL/g时,鹰嘴豆中植物甾醇具有最大提取率,为(57.99±3.37) mg/100 g·dw。柱层析分离纯化植物甾醇的回收率偏低,仅为53.44%。使用GC-MS分析分离纯化后的总甾醇,结果发现,鹰嘴豆中甾醇以β-谷甾醇、菜油甾醇与豆甾醇为主,三者比例分别为80.43%、12.48%与7.09%,检测未发现菜籽甾醇。
本次研究发现,鹰嘴豆植物甾醇提取物对于大肠杆菌、沙门氏菌、金黄色葡萄球菌与枯草芽孢杆菌均有抑制效果。因此,选取鹰嘴豆进行植物甾醇的优化提取是具有一定意义的。本文运用响应面法提取鹰嘴豆中植物甾醇得率较高,且成本低,时间短,可为进一步开发利用鹰嘴豆中植物甾醇提供一定参考。

