多重荧光定量PCR测定登革热Ⅰ~Ⅳ型方法的建立与初步评价
费云霞 张祥波 何韬 张雨婷 高依丹 高岭 王洁 陈公英


[摘要] 目的 探討多重荧光定量PCR测定登革热Ⅰ~Ⅳ型方法的建立与初步评价。 方法 针对登革热Ⅰ~Ⅳ型使用自建的引物探针对反应条件及温度进行调整,且对阳性样本进行不同浓度的稀释,检测自建多重荧光定量PCR在登革热Ⅰ~Ⅳ型测定中的重复性、灵敏性及特异性。 结果 6份登革热阳性样本通过自建的检测方法来进行检测,全部能够显示明显的S曲线扩增,且与原有确证方法相比,不同型别的结果一致。其他10份病毒阳性样本及阴性样本全部没有显示扩增曲线,提示自建的检测方法特异性良好。分别检测登革热Ⅰ~Ⅳ型,变异系数(CV%)值水平范围:0.51~5.51,提示重复性较好。使用自建的多重荧光定量PCR对登革热不同型别进行检测的平均用时与ELISA法相比无显著差异(t=1.561,P>0.05)。通过自建的多重荧光定量PCR测定通过仪器来完成核酸的自动提取,在仪器当中加样、上机之后不需要另外的操作,充分降低了发生污染的风险。 结论 本次研究设计建立的登革热Ⅰ~Ⅳ型多重荧光定量PCR检测方法,在重复性、灵敏性及特异性方面均较为理想;且相比ELISA法在加样后无需另外手动操作,更加简易方便。
[关键词] 登革热;荧光定量PCR;血清型;病毒载量
[中图分类号] R512.8 [文献标识码] A [文章编号] 1673-9701(2019)34-0008-06
Establishment and preliminary evaluation of multiplex quantitative PCR for determination of dengue fever type Ⅰ-Ⅳ
FEI Yunxia1 ZHANG Xiangbo2 HE Tao2 ZHANG Yuting1 GAO Yidan3 GAO Ling3 WANG Jie3
CHEN Gongying3
1.Zhejiang University of Traditional Chinese Medicine, Hangzhou 310053, China; 2.Hangzhou Normal University, Hangzhou 310053, China; 3.Department of Infectious Diseases and Liver Diseases, Affiliated Hospital of Hangzhou Normal University, Hangzhou 310053, China
[Abstract] Objective To establish and evaluate the method of multiplex quantitative PCR for the determination of dengue fever type Ⅰ-Ⅳ. Methods For the dengue type Ⅰ-Ⅳ, the self-built primer probe was used to adjust the reaction conditions and temperature, and the positive samples were diluted at different concentrations. The repeatability, sensitivity and specificity of self-built multiplex quantitative PCR in the determination of dengue type Ⅰ-Ⅳ. Results Six dengue-positive samples were tested by self-built detection methods, all of which showed significant S-curve amplification, and the results of the different types were consistent compared with the original confirmation method. The other 10 virus-positive samples and negative samples did not show amplification curves, suggesting that the self-built detection method was specific. The dengue type Ⅰ-Ⅳ type was detected separately, and the coefficient of variation(CV%) value range was 0.51-5.51, indicating good repeatability. The mean time to test different types of dengue using self-built multiplex quantitative PCR was not significantly different from ELISA(t=1.561, P>0.05). Through the self-built multiplex quantitative PCR assay, the automatic extraction of nucleic acid was completed by the instrument, and no additional operation was required after the sample was loaded in the instrument and the machine was taken on, which completely reduced the risk of contamination. Conclusion The dengue type Ⅰ~Ⅳ multiplex quantitative PCR method established in this study is ideal in terms of repeatability, sensitivity and specificity. Compared with ELISA, no additional manual operation is required after the sample is added. It is easy and convenient.
[Key words] Dengue fever; Real-time PCR; Serotype; Viral load
登革热病毒在临床中归属于黄病毒科,依据不同的表面抗原,临床中将其分为4个不同的血清型别,分别为DEN-Ⅰ~DEN-Ⅳ[1]。最近几年,随着气候及环境的变化,同时旅游业及城市化的飞速发展等,均为登革热病毒的扩散及传播提供更加便利、快捷的条件,导致登革热病毒的流行区域持续增大。目前临床中诊断登革热病毒的金标准方法就是病毒分离,但登革热病毒需要1 d才能在细胞中生长,且通过分离病毒进行诊断时其灵敏性较低[2]。临床中最常用的一种登革病毒抗体检测方法就是血清学检测,尤其是检测特异性抗体[3]。但抗体只能在发病后的1 d才可以检测到[4]。实时定量PCR是在普通PCR基础上发展而得,包括两种:探针类及非探针类,探针类增加了识别特异性探针这一步骤,因此具有很高的检测特异性[5]。国内已经有相关研究开始着手使用荧光定量PCR对登革热病毒进行检测。本实验进一步研究不同分型登革热病毒的荧光定量PCR检测方法,且对该检测方法的临床检测效能进行评价,现报道如下。
1 资料与方法
1.1仪器与试剂
登革热盲样、诺如病毒、乙脑病毒、流感病毒等全部由本地疾控中心提供;健康者血清由本地血站提供;引物探针:由伯乐生命医学产品(上海)有限公司合成,荧光定量PCR仪:型号:AB7500,购自Applied Biosystems;核酸提取仪器和配套试剂盒:购自上海西宝生物,荧光定量PCR试剂盒,型号:RR064A,购自上海酶联科研;登革热病毒通用型试剂盒购自上海酶联科研;登革热分型引物探针由本地疾控中心提供。ELISA特异性检测IgM抗体试剂盒:购自上海纪宁生物;流感病毒试剂盒:购自上海纪宁生物,诺如试剂盒:购自上海纪宁生物。BHK-21细胞:含胎牛血清(濃度为8%)的DMEM培养液进行传代培养,温度:37℃,CO2:5%的条件下进行培养。
1.2方法
1.2.1 标准品的制备 将登革热阳性样本、登革热病毒通用型试剂盒的阳性对照品,分别进行四个不同梯度的稀释:10倍、100倍、1000倍、10000倍。
1.2.2 核酸PCR扩增 详见说明书;PCR反应体系参数:12.5 μL Buffer,0.5 μL逆转录酶,0.5Ixl Taq酶,上游引物、下游引物共0.5 μL,探针0.5 μL,0.5 μL模板,加清水补足到25 μL。参数条件:42℃、10 min,60℃、34 s,95℃、2 min,95℃、5 s,40个循环。评估标准:扩增曲线呈S型,且CT值≤35判定阳性[6]。
1.2.3 登革混合感染Ⅰ型病毒及Ⅱ型病毒的样本制备和检测 将BHK-21细胞接种到12孔细胞培养板中进行培养到单层,并将制备好的登革Ⅰ型病毒悬液及Ⅱ型病毒悬液根据10倍的梯度进行等比稀释,接种至12孔(规格:0.2 mL/孔)细胞培养板当中并进行摇匀:15 min/次,在37℃的环境下进行1.5 h的孵育,再加入低熔点琼脂(2%):1 mL,跟2×DMEM培养基混合物进行1:1的覆盖,等到凝固之后,放置到培养箱当中继续进行培养,在6 d之后使用结晶紫实施染色,计算空斑数水平。
C6/36细胞根据2.5×105/孔转移至6孔细胞培养板当中,温度:28℃,CO2:5%进行24 h的培养后,接种病毒,共分成:感染登革Ⅰ型病毒组、感染登革Ⅱ型病毒组、混合感染登革Ⅰ型病毒及Ⅱ型病毒组。每组依据感染复数MOI=1(2.5×105 PFU/孔)来接种病毒,培养箱内温度:37℃,CO2:5%进行1.5 h的孵育后,将病毒悬液的上清层吸出,使用RPIM1640培养液进行两次清洗,再加入FBS(2%):2 mL的RPIM1640培养液分别进行不同时间段的培养:36 h、48 h、60 h、72 h、84 h、96 h、120 h,吸取病毒上清,冷冻保存待用。在取样之后,在各个培养孔内加入维持液:100 μL,补齐到2 mL,重复实验3次。依据RNA提取试剂盒当中的操作说明书来提取并收集病毒上清中的RNA,用本次实验当中所建立的多重荧光定量PCR来检测C6/36混合感染登革Ⅰ型病毒和登革Ⅱ型病毒之后的不同时间病毒拷贝数水平。
1.3 观察指标
1.3.1 观察评估多重荧光定量PCR测定的特异性 共选取16份样本进行特异性检测,其中,登革热盲样:7份,确证Ⅰ型2份,Ⅱ型1份,Ⅲ型1份,Ⅳ型1份,阴性样本2份;DEN-Ⅰ阳性标本1份:通过ELISA进行IgM抗体特异性检测,且通过核酸检测验证;乙脑阳性2份;流感阳性2份,诺如阳性2份,健康者血清2份。对上述的16份样本通过登革热不同型别探针和引物试剂盒(表1)、诺如试剂盒、流感试剂盒和登革热通用型进行分别检测,没有双重或多重病毒感染,最多感染1种病毒。使用自建的方法来检测所有样本,以评估其特异性。
1.3.2 观察评估多重荧光定量PCR测定的灵敏性 通过试剂盒阳性对照品来对登革热阳性4个不同样本型别定量,将浓度调整至:1×101 copies/mL、1×102 copies/mL、1×103 copies/mL、1×104 copies/mL、1×105 copies/mL、1×106 copies/mL。用自建的引物探针分别检测不同梯度浓度。
1.3.3 观察评估多重荧光定量PCR测定的重复性 取1.3.2中所得的不同梯度浓度核酸,1次/d,共进行3次重复平行检测,依据所得CT值来确定变异系数。
1.3.4 与ELISA方法相比,观察评估多重荧光定量PCR测定的使用性能 选取随机样本,使用两种不同的检测方法来进行平行检测,比较操作简便性及检测耗时。
1.3.5 病毒复制动态 C6/36混合感染登革Ⅰ型病毒及登革Ⅱ型病毒之后的病毒复制动态检测。
1.4统计学方法
使用SPSS22.0统计学软件进行分析,计数资料以%表示,采用χ2检验;计量资料以(x±s)表示,采用t检验;P<0.05为差异有统计学意义。
2 结果
2.1 特异性
6份登革热阳性样本通过自建的检测方法来进行检测,全部能够显示明显的S曲线扩增,并且与原有确证方法相比,不同型别的结果一致。其他10份病毒阳性样本及阴性样本全部没有显示扩增曲线,提示自建的检测方法特异性良好。
2.2 灵敏性
以DEN-Ⅰ为例,在1×103 copies/mL浓度核酸能够明显显示扩增曲线;在1×102 copies/mL浓度核酸没有显示明显的扩增曲线。因此,DEN-Ⅰ的检测浓度限制范围为1×103 copies/mL;DEN-Ⅱ的检测浓度限制范围为1×102 copies/mL;DEN-Ⅲ的检测浓度限制范围为1×102 copies/mL;DEN-Ⅳ的检测浓度限制范围为1×102 copies/mL。
2.3 重复性
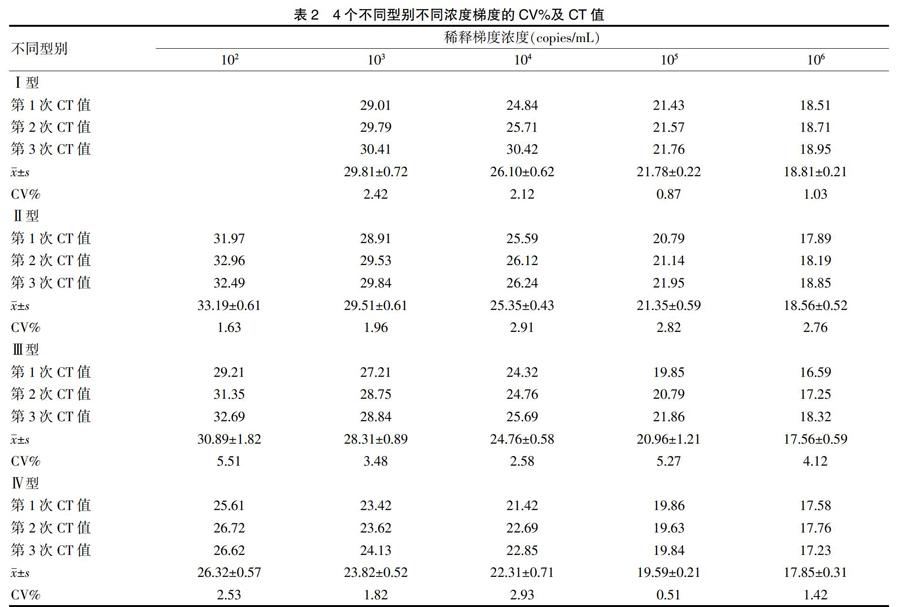
分别检测登革热Ⅰ~Ⅳ型,每个不同的型别梯度浓度分别为102 copies/mL、103 copies/mL、104 copies/mL、105 copies/mL、106 copies/mL,变异系数(CV%)值水平范围:0.51~5.51,提示重复性较好,见表2。
2.4 与ELISA方法相比,多重荧光定量PCR测定的使用性能
使用自建的多重荧光定量PCR对登革热不同型别进行检测的平均用时为(2.7±0.3)h;而使用ELISA法进行检测的平均用时为(2.6±0.1)h,检测时间方面无显著差异(t=1.561,P>0.05)。通过自建的多重荧光定量PCR测定通过仪器来完成核酸的自动提取,在仪器当中加样、上机后不需要另外的操作,充分降低发生污染的风险:使用ELISA法检测时加样之后,需要每隔一定时间来进行手动操作,增加污染样本的风险,多重荧光定量PCR检测相比ELISA法更加简易方便。
2.5 C6/36混合感染登革Ⅰ型病毒及登革Ⅱ型病毒之后的病毒复制动态检测
三次重复检测的最大变异系数值水平为14.3%(<15%),认为重复性好,结果完全可行。通过t配对检验:登革Ⅰ型病毒和登革Ⅱ型病毒混合感染C6/36细胞之后,登革Ⅰ型病毒的拷贝数水平与单独感染时拷贝水平相比并未出现显著的差异:36 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(4.7±0.2)copies/μL、混合感染的拷贝数为(4.6±0.3)copies/μL(t=1.021,P>0.05);48 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(5.1±0.3)copies/μL、混合感染的拷贝数为(4.9±0.4)copies/μL(t=1.164,P>0.05);60 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(5.8±0.4)copies/μL、混合感染的拷贝数为(5.7±0.4)copies/μL(t=0.492,P>0.05);72 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(5.9±0.6)copies/μL、混合感染的拷贝数为(5.8±0.4)copies/μL(t=1.021,P>0.05);84 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(6.1±0.3)copies/μL、混合感染的拷贝数为(6.2±0.2)copies/μL(t=0.946,P>0.05);96 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(6.6±0.2)copies/μL、混合感染的拷贝数为(6.5±0.3)copies/μL(t=0.361,P>0.05);120 h时间点:登革Ⅰ型病毒单独感染的拷贝数为(6.5±0.3)copies/μL、混合感染的拷贝数为(6.6±0.4)copies/μL(t=0.746,P>0.05)。通过t配对检验,在36~60 h时,登革Ⅱ型病毒混合感染C6/36细胞之后,登革Ⅱ型病毒拷贝数水平跟单独感染C6/36细胞时的拷贝数水平相比并未出现显著的差异:36 h时间点:登革Ⅱ型病毒单独感染的拷贝数为(3.8±0.3)copies/μL、混合感染的拷贝数为(3.7±0.2)copies/μL(t=1.932,P>0.05);48 h时间点:登革Ⅱ型病毒单独感染的拷贝数为(4.4±0.3)copies/μL、混合感染的拷贝数为(4.3±0.2)copies/μL(t=1.987,P>0.05);60 h时间点:登革Ⅱ型病毒单独感染的拷贝数为(4.7±0.6)copies/μL、混合感染的拷贝数为(4.6±0.5)copies/μL(t=1.036,P>0.05)。72 h时,混合感染时登革Ⅱ型病毒的拷贝数水平与单独感染的病毒拷贝数水平相比显著降低,登革Ⅱ型病毒单独感染的拷贝数为(6.1±0.4)copies/μL、混合感染的拷贝数为(5.2±0.3)copies/μL(t=16.962,P<0.05);同样在84~120 h时,混合感染登革Ⅱ型病毒的拷贝数水平与单独感染的病毒拷贝数水平相比显著降低,84 h时间点:登革Ⅱ型病毒单独感染的拷贝数为(6.6±0.2)copies/μL、混合感染的拷贝数为(5.3±0.4)copies/μL(t=19.061,P<0.05),96 h时间点:登革Ⅱ型病毒单独感染的拷贝数为(7.0±0.3)copies/μL、混合感染的拷贝数为(5.7±0.3)copies/μL(t=18.375,P<0.05);120 h時间点:登革Ⅱ型病毒单独感染的拷贝数为(7.2±0.4)copies/μL、混合感染的拷贝数为(5.8±0.5)copies/μL(t=17.942,P<0.05),见图2。
3討论
多重荧光定量PCR检测自从问世以来,在临床中得到了十分迅猛的发展,在临床多个相关领域,如食物中毒及肿瘤筛查等当中被应用[7-8]。在温度、反应体系及探针等各个方面均不同[9-10]。检测登革热的多重PCR温度及探针条件也不断得到优化。相关研究指出,在单管反应中将2种探针进行混合,可以在短时间内快速地诊断大概具体型别[11]。未来临床中对登革热早期诊断的试剂主要特点为:方便操作、高度专一、更加敏感及时间更短[12-13]。目前临床中传统普遍使用的荧光定量PCR法对登革热病毒进行检测时,灵敏性好且专一[14]。但是传统的检查方式需要分两步来进行检测操作[15]。
荧光定量PCR充分地将常规PCR技术、光学技术及光共振能量传递现象进行充分地结合,进而更好地实现对核酸的精准定量。其在PCR指数扩增的过程中通过连续性地检测荧光信号强度,完成对特异性产物量的实时测定,并以此来推断目的基因的基础初始量。TaqMan探针属于寡核苷酸单链之一,荧光基团(FAM)连接主要在探针5′的末端,但淬灭基团(TAMRA)主要在3′的末端,5′端荧光基团所发射的荧光因与3′端淬灭剂相互接近时被淬灭。当靶序列与探针相互配对之后,会通过聚合酶的作用来进行延伸反应,聚合酶5′→3′外切酶的活性会切断探针,游离出荧光基团,使得淬灭基团不再发挥其原有的淬灭效果,进而发射出荧光信号,一分子产物的生成同时会伴随出现一分子荧光信号。随着不断增加的扩增循环数,释放出的荧光基团也继续积累。因此,TaqMan探针所检测到的是最终积累后的荧光量。其优点主要是与探针杂交、PCR反应的灵敏性进行充分地结合;产生荧光的过程属于不可逆的反应,生成信号之后并不会自动淬灭;其主要是对反应起始浓度水平进行测定,并不是对最终产物浓度进行测定,因此,其结果更加准确,拥有更好的重复性。目前,这一方法的主要作用就是临床中对病毒载量的测定,即病毒数量,反映病毒繁殖能力、水平,是临床确认感染情况、临床诊断、指导治疗、疗效反应和预后评估的一个重要参考指标,在病毒感染的临床定量监测过程中具有十分重要的作用。
本次研究通过一步法来检测登革热病毒的不同4个血清型别,检测限高为102 copies/mL。本研究与卫生部所推荐的登革热的诊断标准:RT-PCR引物系统相结合,对PCR反应体系进行更进一步的优化,通过4套针来分别针对登革热病毒的不同4个型别的探针及引物,从而建立多重单管荧光定量PCR检测方法。这一检测方法有效地实现通过1个反应管,进行1次平行检测能够将登革热病毒的4个不同型别进行检测[16-17]。再与阳性对照品相比,实现病毒的精确定量[18]。与此同时,还可以监测这一检测方法的稳定性[19-20]。
综上所述,本次研究设计建立的登革热Ⅰ~Ⅳ型多重荧光定量PCR检测方法,在重复性、灵敏性及特异性方面均较为理想;且相比ELISA法在加样后无需另外手动操作,更加简易方便。
[参考文献]
[1] 孙爱娟,林立丰,兰策介,等.登革1型和2型病毒混合感染样本的一步法实时荧光定量PCR检测方法的建立[J].寄生虫与医学昆虫学报,2018,9(1):23-27.
[2] 高鑫,朱武洋,卢学新.实时荧光定量PCR在病毒检测中的应用[J].中国人兽共患病学报,2018,34(7):84-91.
[3] Jerusalinsky L,Oliveira MM,Pereira RF,et al. Preliminary evaluation of the conservation status of callicebus coimbrai Kobayashi & Langguth,1999 in the Brazilian state of sergipe[J]. Primate Conservation,2017,35(15):25-32.
[4] 李要星,杨爽,李娜,等.国产酶联免疫试剂检测登革热效能评价[J].中国病原生物学杂志,2017,4(5):434-436.
[5] Cucuzza LS,Biolatti B,Divari S,et al. Development and application of a screening method of absolute quantitative PCR to detect the abuse of sex steroid hormone admi-nistration in male bovines[J]. Journal of Agricultural & Food Chemistry,2017,65(23):4866-4874.
[6] 胡挺松,张海林,刘永华,等.云南省登革4型病毒全基因组序列特征研究[J].中国人兽共患病学报,2017,33(10):859-867.
[7] Min KK,Lee S,Kim BJ,et al. A preliminary analysis of the diet composition of overwintering Bean geese (Anser fabalis) and greater white-fronted geese(A. albifrons) in Korea using PCR on fecal samples[J]. Animal Cells and Systems,2017,21(2):141-145.
[8] 刘远,蒋力云,景钦隆,等.2001-2016年广州市登革3型病毒E基因序列及系统进化树分析[J].中国人兽共患病学报,2018,34(5):487-491.
[9] Naveca FG,Nascimento VAD,Souza VCD,et al. Multiplexed reverse transcription real-time polymerase chain reaction for simultaneous detection of Mayaro,Oropouche,and Oropouche-like viruses[J]. Memorias Do Instituto Oswaldo Cruz,2017,112(7):510-513.
[10] 高博,郑晖,李枢,等.登革热病毒(DENV)包膜蛋白特异性人源抗体筛选与鉴定[J].中国人兽共患病学报,2018, 34(10):62-68.
[11] Undurraga EA,Edillo FE,Erasmo JNV,et al. Disease burden of dengue in the Philippines:Adjusting for underreporting by comparing active and passive dengue surveillance in Punta Princesa,Cebu city[J]. American Journal of Tropical Medicine & Hygiene,2017,96(4):887-898.
[12] 杜燕华,李懿,王若琳,等.2017年河南省登革热疑似病例的实验室诊断与分子溯源[J].中华预防医学杂志,2018,52(11):1164-1167.
[13] Bischof GF,Magnani DM,Ricciardi M,et al. Use of a recombinant gamma-2 herpesvirus vaccine vector against dengue virus in rhesus monkeys[J]. Journal of Virology,2017,91(16):JVI.00525-17.
[14] 徐胜平,刘琪琦,张严峻,等.9种发热伴出疹病原体基因芯片检测方法的建立[J].军事医学,2017,41(2):135-140.
[15] Cherupanakkal C,Ramachadrappa V,Kadhiravan T,et al. A study on gene expression profile of endogenous antioxidant enzymes:CAT,MnSOD and GPx in dengue patients[J]. Indian Journal of Clinical Biochemistry,2017, 32(4):1-9.
[16] 张培,李春缘,陈迪嘉,等.Ⅰ型登革病毒感染后不同病程病毒核酸及其IgM抗体的变化规律[J].第三军医大学学报,2017,39(4):328-332.
[17] 师永霞,黄鹂,廖芸,等.2009-2015年广州口岸输入性登革热的流行病学分析[J].现代预防医学,2017,44(6):965-967.
[18] Tan KK,Azizan NS,Yaacob CN,et al. Operational utility of the reverse-transcription recombinase polymerase amplification for detection of dengue virus[J]. Bmc Infectious Diseases, 2018,18(1):169.
[19] 吕榜军,梁忠福.2016年柳州市蚊类种群分布和蚊虫病毒携带情况调查分析[J].现代预防医学,2017,44(17):47-51.
[20] 胡挺松,张海林,刘永华,等.云南中缅边境登革1型病毒全基因组序列特征研究[J].中国人兽共患病學报,2017, 33(6):473-480.
(收稿日期:2019-08-06)

