PERK在重症急性胰腺炎大鼠淋巴细胞中的表达及其与细胞凋亡的相关性*
,,,,,,,
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院消化内科,广西 百色 533000)
重症急性胰腺炎(severe acute pancreatitis,SAP)是临床常见的危急重症,该病发病急,病情严重,进展迅速,且并发症多,病死率高达30%~40%[1]。研究者认为SAP的病理基础是胰腺细胞内酶原的非正常激活,大量酶原异常激活引起胰腺的自我消化以及局部炎症[2]。严重时胰腺坏死,可发生系统性炎症反应综合症(systemic inflammatory response syndrome,SIRS),累及胰腺外器官,引起多器官功能障碍(multiple organ dysfunction,MODS)[3]。近年来虽然治疗有了明显的进步,但SAP的死亡率居高不下。研究发现由于SAP晚期淋巴细胞过度凋亡,引起免疫抑制,并发脓毒症,是SAP患者死亡的重要原因[4]。内质网应激(endoplasmic reticulum stress,ERS)是新近发现的调控细胞凋亡的信号通路,其中起主导作用的有蛋白激酶R样内质网激酶(protein kinase R-1ike ER kinase,PERK)、活化转录因子6(the activating transcription factor 6,ATF6)和肌醇酶l(inositol requiring enzyme l,IREI) 3种反应感受蛋白。缺乏PERK的细胞不能引起真核翻译起始因子2的α亚单位(eukaryotic initiation factor 2α,eIF2α)磷酸化,这种细胞对ERS呈高反应性,PERK信号通路在ERS中的重要性在PERK细胞中或敲除PERK基因的细胞中得到了证明[5]。本研究采用胰胆管插入逆行注射5%牛磺胆酸钠制备SAP大鼠模型,检测各组凋亡标志物Caspase-3的表达以及PERK的表达变化,探讨PERK与SAP淋巴细胞凋亡的关系。
1 材料与方法
1.1 材料 成年雄性SPF级SD大鼠20只,体重250~300 g,购自长沙市天勤生物技术有限公司,动物许可证编号:SYXK桂20117-0004;牛磺胆酸钠(美国Sigma生产);RNAsimple 总RNA提取试剂盒(北京天根生产);FastKing RT Kit(With gDNase)(北京天根生产);SuperReal PreMix Plus(SYBR Green)(北京天根生产);PCR引物合成(上海捷瑞生产);大鼠胱天蛋白酶3(Casp-3)酶联免疫试剂盒(武汉华美生产)。
1.2 动物分组及模型制备 采用随机数字表法将大鼠分为假手术组(SO组)、SAP组。SO组10只,开腹后仅翻动胰腺,即关腹。SAP组10只,采用胰胆管插入逆行注射5%牛磺胆酸钠制备SAP大鼠模型,造模后18 h处死。记录各组动物的生理活动、生命体征、死亡情况。
1.3 标本采集及检测 按照实验分组于18 h后处死动物并取材。10%水合氯醛溶液腹腔注射麻醉大鼠。经大鼠腹主动脉穿刺采血,血液凝固后于4℃ 3000 rpm离心15 min,取上清液,EP 管分装后置于-80℃冰箱保存备用。采血后迅速将大鼠处死,快速取出脾脏,立即放入液氮罐内,然后再转入-80℃冰箱保存,用于后续qPCR。取胰腺组织用10%中性福尔马林固定、石蜡包埋,进行常规病理学检查。
1.3.1 胰腺组织病理学检测 用石蜡包埋后制成4 μm厚切片,常规HE染色后光镜下观察,根据Schmidt评分标准,从水肿、炎症、出血、坏死浸润4个方面,双盲进行胰腺病理损伤评分,每张切片随机选取5个高倍视野,观察胰腺组织病理变化。
1.3.2 ELISA检测 采用ELISA法检测大鼠血清Caspase-3含量,ELIAS检测的具体步骤严格按说明书进行,采用全自动酶标仪(Thermofis,美国)进行结果判定。
1.3.3 脾脏组织qPCR检测 PERK基因引物序列:上游5′-GGACTGCCTGGGTCTTTGAT-3′,下游5′-TGTGGGGTCAAACGCCTATT-3′。Caspase-3基因引物序列:上游5′-CTAGCTCCTAGTCTCTGCTCCC-3′,下游5′-TCCGTCCCCAATACGTGTCGAAGTCA-3′。内参GAPDH引物序列:上游5′-AGGGCTACCATGCCAACTTC-3′,下游5′-CCACGTAGTAGA
CGATGGGC-3′。按照说明书所述步骤提取各实验组脾脏组织的总RNA,经紫外分光光度计(TU-1810PC,北京普析)测定OD260、OD280及浓度,琼脂糖凝胶电泳检测RNA完整性。取1 μg总RNA用反转录试剂盒按说明书方法反转录得到cDNA,并保存在-80℃。应用SYBR Green Master Mix扩增上述cDNA,使用LightCycler○R96 qPCR仪进行检测。选取GAPDH为内参,分析PERK、Caspase-3的mRNA 表达。所有样品均设3个复孔,采用2-△△Ct法计算PERK、Caspase-3 mRNA相对表达量。

2 结果
2.1 大鼠胰腺病理评分 SO组胰腺腺泡结构基本完整,偶见水肿和少量炎性细胞浸润;SAP组可见胰腺腺泡水肿,腺泡结构有不同程度坏死,腺泡间隔及小叶间隔显著增宽,间质内可见红细胞渗出和大量炎症细胞入侵。根据Schmidt评分标准,与SO组比较,SAP组胰腺病理组织学评分有显著性增加(P<0.05),见图1、图2。
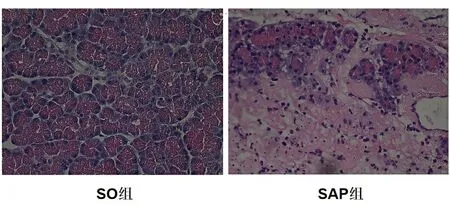
图1 大鼠胰腺组织病理改变(HE 400×)
注:SO组腺泡结构基本完整;SAP组腺泡细胞广泛空泡化、坏死,腺泡结构严重破坏,胰腺间质内可见大量炎细胞浸泡及严重出血

图2 大鼠胰腺病理评分
2.2 大鼠血清中Caspase-3水平 SO组、SAP组血清Caspase-3表达水平分别为(0.62±0.38、1.51±0.11)ng /ml。SAP组18 h血清Caspase-3水平明显高于SO组(t=7.114,P<0.05)。
2.3 大鼠脾脏组织中PERK mRNA相对表达量 SO组脾脏组织PERK mRNA低表达,SAP组PERK mRNA的表达明显升高(P<0.05),见图3、图4。

图3 PERK mRNA、Caspase-3 mRNA基因扩增曲线及溶解曲线
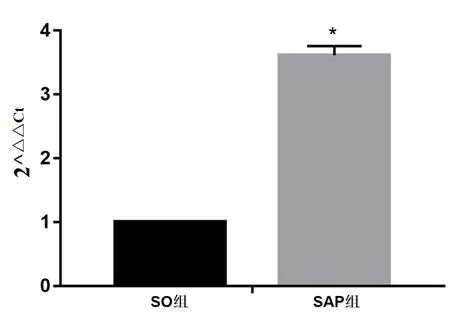
图4 大鼠脾脏淋巴细胞PERK mRNA相对表达量
2.4 大鼠脾脏组织中Caspase-3 mRNA相对表达量 SO组大鼠脾脏组织中Caspase-3 mRNA活性较低,与SO组比较,SAP组Caspase-3 mRNA活性升高(P<0.05),见图3、图5。
2.5 大鼠脾淋巴细胞PERK mRNA水平与脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平的相关性 SAP组中脾淋巴细胞PERK mRNA水平与脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平呈正相关(r=0.814、0.875,P<0.05),随脾淋巴细胞PERK mRNA水平增高,脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平升高,见图6。
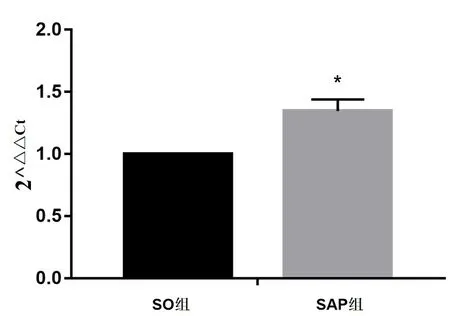
图5 大鼠脾脏淋巴细胞Caspase-3 mRNA相对表达量
注:*与SO组比较,P<0.05
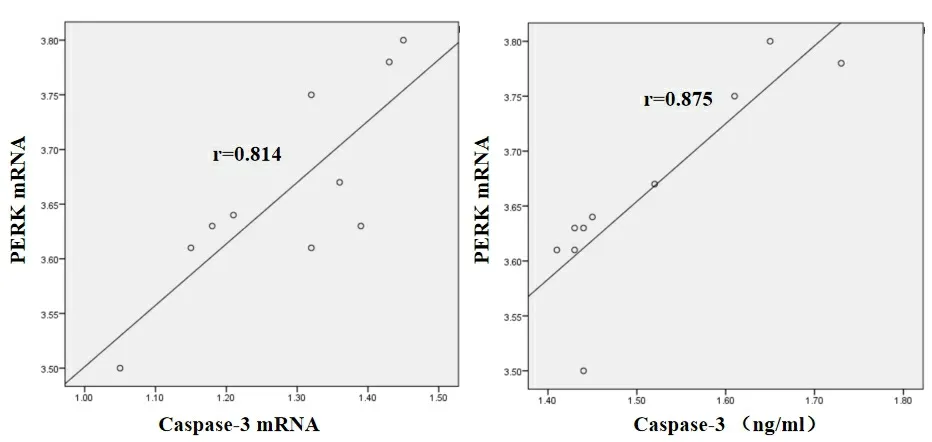
图6 SAP组中脾淋巴细胞PERK mRNA水平与脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平的相关性
3 讨论
以往研究认为SIRS是导致SAP病情进展及患者死亡的主要原因。近年研究发现,SAP患者由于外周血淋巴细胞过度凋亡,淋巴细胞亚群明显减少,导致机体免疫抑制及继发感染[6-7]。免疫抑制可促使病情急剧恶化,易并发脓毒症引起MODS,是SAP患者后期死亡的重要原因[4]。本课题组前期的研究工作中,我们也证实SAP患者及小鼠由于淋巴细胞凋亡异常,导致淋巴细胞亚群数量显著减少,与机体免疫抑制、感染及脓毒症并发症密切相关[8-9]。然而淋巴细胞凋亡在大鼠SAP模型中表达如何变化及其可能的分子机制仍不明确。
细胞凋亡经典信号通路有线粒体途径与死亡受体途径。内质网是新近研究发现的一条调控细胞凋亡的信号通路,它是细胞内最大的细胞器,主要维持生理功能[10-11]。适宜的ERS有利于细胞内钙离子及蛋白质的加工等程序的恢复,增强细胞耐受应激刺激的能力;但严重而持续的ERS可以触发反应中相关细胞的凋亡。PERK是具有丝/苏氨酸蛋白激酶的活性的一种内质网I型跨膜蛋白,也是ERS中最先被激活的感受器,被折叠错误的蛋白激活之后抑制错误折叠蛋白的合成,促进内质网功能恢复,维持生理功能。李晓娟等[12]研究证实PERK通路可促进肺癌细胞凋亡。此外,Hiramatsu等[13]在结肠癌细胞系、肝癌细胞系、宫颈癌细胞系中发现PERK磷酸化eIF2α继而下调X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)合成,并通过表达编码转录因子ATF4 ( activating transcription factor 4,ATF4)促进XIAP降解,最终促进细胞凋亡。Xia等[14]的研究证实了在急性胰腺炎胰腺腺泡细胞中PERK的激活可以磷酸化eIF2α,并上调凋亡基因caspase-12和转录因子C/EBP同源蛋白(C/EB phomologous protein,CHOP)的表达。Ma等[15]的研究证实在脓毒症中PERK-CHOP信号通路与淋巴细胞凋亡有密切关系。PERK信号通路是否参与SAP时淋巴细胞凋亡调控,具体参与的分子机制如何至今未见报道。
Caspase-3是多种凋亡途径的共同下游效应部分,在细胞凋亡过程中占据核心地位,被称为“死亡执行蛋白酶”,激活后酶解切割细胞的多种结构和功能蛋白,诱导凋亡发生[16]。本研究,我们采用ELISA法检测血清中Caspase-3的含量及qPCR检测脾淋巴细胞中Caspase-3 mRNA的相对表达量,发现在大鼠SAP模型中Caspase-3的表达水平升高,这与先前的理论、研究以及预测的实验结果相一致。通过这些研究发现大鼠SAP模型中,脾脏淋巴细胞发生了凋亡。另外我们检测了大鼠SAP组及SO组脾淋巴细胞中PERK mRNA表达,结果显示SAP组脾淋巴细胞中PERK mRNA表达水平高于SO组,提示大鼠SAP存在PERK高表达。为进一步研究PERK基因对淋巴细胞凋亡的作用,我们将脾淋巴细胞中PERK mRNA表达水平与脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平结果进行相关性分析,发现SAP组脾淋巴细胞中PERK mRNA与脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平呈显著正相关。提示PERK对Caspase-3呈正向调节作用,PERK高表达使大鼠SAP脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平升高。正常情况下,淋巴细胞 PERK低表达,缺氧、缺血/再灌注等因素导致ERS、PERK表达加剧,诱导CHOP的启动介导大量淋巴细胞凋亡,使淋巴细胞数量减少,机体免疫功能受到损害[17-18]。
本研究结果显示大鼠SAP脾淋巴细胞PERK mRNA表达显著升高,脾淋巴细胞Caspase-3 mRNA、血清Caspase-3水平升高,PERK mRNA与Caspase-3 mRNA、血清Caspase-3水平呈显著正相关,提示PERK表达对大鼠SAP淋巴细胞凋亡起重要调节作用。因此,明确PERK信号通路调节淋巴细胞凋亡的机制,将可能对SAP患者免疫功能改善及防治继发感染提供理论基础。

