蕨菜提取液对秀丽隐杆线虫体内抗氧化特性的影响
宁 粤,欧阳雅琦,郑汝婷,侯爱香
(湖南农业大学食品科学与技术学院,长沙 410128)
蕨菜具有清热利湿、消肿、利水、安神等药用价值[1-2]。有研究者对蕨菜中黄酮、多糖类功能成分等进行提取探索,如采用乙醇回流法提取蕨菜中的总黄酮、采用超声波法提取蕨菜中的水溶性膳食纤维和多糖,其提取率分别可达10.33%、36.01%和25.69%[3-5]。研究发现,蕨菜中黄酮类化合物和多糖均可以较好地清除DPPH自由基,二者在一定浓度范围内均与DPPH自由基的清除率呈正相关[6]。国内目前更多的研究是对蕨菜进行加工处理,也有新鲜蕨菜加木糖醇、柠檬酸等辅料,以生产适合糖尿病等患者食用的功能性饮料[7],但这些蕨菜研究开发中,普遍忽视了蕨菜作为日常佐餐菜肴是否危害人体健康的问题。M Campos-Da-Paz等[8]研究表明,用蕨菜提取物单独处理细胞,细胞会表现出染色质缩合、细胞质体积丢失等凋亡形态学特征,并且蕨类植物中的有害物质会增加胃癌发病率和上消化道肿瘤的发生风险[9-10],蕨菜中含有的蕨苷可以通过降低CD8+T细胞的激活和在hpv诱导的病变中的脱粒,发挥免疫抑制作用,而增加病毒持久性和侵袭性,并促进肿瘤形成[11]。这些研究结论与本课题组前期研究结果相符,笔者发现,1g/mL的蕨菜液平均缩短秀丽隐杆线虫寿命6.06d,对生殖能力损害较强[12]。保持体内自由基和抗氧化剂的平衡可以延缓衰老[13-14]。活性氧族(ROS)是含有氧并具有高反应活性的一类自由基或分子[15],通过对细胞膜结构、蛋白分子等产生氧化作用或自身含量增多导致机体氧化应激反应造成细胞损伤而引起其结构和功能障碍[16]。机体通过利用超氧化物歧化酶(SOD)、过氧化氢酶(CAT)等酶类可去除细胞生成的ROS[17]而维持ROS的平衡,谷胱甘肽(GSH)也是一种具有清除自由基的作用的三肽类组织,且几乎存在于身体的每一个细胞[18]。
通常自由基的检测较为困难,本研究以秀丽隐杆线虫为模式生物测定ROS水平、谷胱甘肽过氧化物酶(GSH-Px)、SOD、CAT,BCA法测秀丽隐杆线虫总蛋白的方法,间接测定其体内自由基含量[19],进而了解其抗氧化作用。因秀丽隐杆线虫与人体基因相似,为进一步研究蕨菜液的生理功能,探索蕨菜食用安全性,本研究参考中国人将蕨菜植株去头去尾后腌制或烹制的采食习惯,继续以秀丽隐杆线虫为模式生物,测定喂食蕨菜液后秀丽隐杆线虫体内ROS含量,GSH-Px、SOD、CAT活力以及细胞凋亡情况,对蕨菜体内抗氧化作用进行评价。
1 材料与方法
1.1 材料与试剂
蕨菜,湖南湘西雪峰山。野生型秀丽隐杆线虫以及大肠杆菌OP50,湖南农业大学实验室。NGM培养基、LB液体培养基、磷酸盐缓冲液(PBS)、M9缓冲液、2’,7’-二氯二氢荧光素二乙酯(H2DCF-DA);GSH-Px测试盒、SOD测试盒、CAT测试盒、秀丽隐杆线虫总蛋白试剂盒,均购自南京建成生物工程研究所。
1.2 仪器与设备
SW-CJ-1FD单人单面净化操作台,苏州净化设备有限公司;立式灭菌锅,山东新华医疗器械股份有限公司;电热恒温培养箱,上海博迅实验有限公司;连续变倍体式显微镜,MoticSMZ-168型,麦克奥迪实业集团有限公司;MJX-250B-Z电热恒温培养箱,上海博迅实业有限公司;超声波细胞粉碎机,南京舜玛仪器设备有限公司;Varioskan Flash多功能酶标仪,美国Therm Scientific公司。
1.3 方法
1.3.1蕨菜提取液的制备
(1)新鲜蕨菜提取液的制备:取去头去尾的新鲜野生蕨菜100g切碎,加100mL蒸馏水榨汁,纱布过滤,取滤液灭菌,制成1.00g/mL和0.2g/mL的新鲜蕨菜提取液。(2)腌制蕨菜水溶提取液的制备:取去头去尾的新鲜野生蕨菜进行腌制,再取腌制蕨菜100g切碎,加100mL蒸馏水榨汁,纱布过滤,取滤液灭菌,制成1.00g/mL和0.2g/mL的腌制蕨菜提取液。
1.3.2秀丽隐杆线虫培养及同期化 参照文献[20]的方法并做适当修改:用无菌水进行冲洗平板,收集带有虫液的无菌水于锥形管,用无菌水离心(2 000r/min,2min)洗3次,每次离心后去上清再加适量无菌水(目的在于洗去大肠杆菌)。加入裂解液(1.5mLNaClO、3.5mL无菌水、5mL NaOH)于锥形管,50mL虫液对应10mL裂解液,虫液密度大时适当增加裂解液的量。放在漩涡震荡仪上震荡至虫体均破碎(在显微镜下观察),即为卵悬液。加入与裂解液等体积的M9缓冲液离心(3 000r/min,2min)洗3次,每次离心后去上清再加适量M9缓冲液(目的在于洗去裂解液)。用完全培养基再离心清洗1次(3 000r/min,2min)以洗去M9缓冲液,去上清后,将卵悬液转移至锥形瓶,用完全培养基定容至50mL。将锥形瓶放在摇床上20℃培养29h。29h后加入大肠杆菌1.5mL(每毫升虫液加入30μL大肠杆菌)摇床20℃培养38h。
1.3.3秀丽隐杆线虫给药操作 向经38h培养的虫液中加入配好的FUDR试剂继续培养12h(加入FUDR抑制产卵),加入提取液进行处理24h,分5管各为新鲜蕨菜提取液0.2、1.0g/mL和腌制蕨菜提取液0.2、1.0g/mL以及空白对照组(加等量蒸馏水)。
1.3.4秀丽隐杆线虫体内抗氧化酶活力的测定 给药24h后,将盛有线虫的锥形管离心去上清,并用PBS定容至3mL,再于超声波细胞破碎仪以破碎功率800 W、破碎总时间8min为超声参数对线虫进行破碎。在显微镜下观察,待虫体裂解后,将混合液5 000r/min离心10min,将上清液小心转移至新离心管中,冰水浴冷却,5 000r/min离心10min,上清液即为酶液提取液,将酶液提取液转移至新的1.5mL离心管中,4℃保存备用。
1.3.5秀丽隐杆线虫体ROS水平的测定
(1)ROS水平的测定:给药24h后,将虫液离心(2 500r/min,2min)去上清(除去培养液),用PBST离心(2 500r/min,2min)洗涤秀丽隐杆线虫2次,以除去OP5O及杂质;再于超声波细胞破碎仪以破碎功率900 W、破碎总时间12 s(超声3 s、间隔3 s)为超声参数对线虫进行破碎。在显微镜下观察,待虫体裂解后,将混合液5 000r/min离心10min,将上清液小心转移至新离心管中,冰水浴冷却,5 000r/min离心10min,取上清即组织液于新的1.5mL离心管中。严格按照南京建成生物工程研究所生产试剂盒说明书要求,进行线虫总蛋白测定并记录数据。同时进行ROS水平的测定,向96孔板中加入80μL组织液,再加入20μL H2DCF-DA;将96孔板放置于20℃摇床孵育30min,并盖上盖子,以免蒸发;利用多孔化学发光检测仪进行荧光检测,激发波长485nm,发射波长535nm。
(2)数据统计处理:采用Excel 2010软件进行统计分析,结果以百分比呈现。
1.3.6秀丽隐杆线虫细胞凋亡的影响分析 吸取各组虫液各100μL于96孔板,加入100μL吖淀橙,染色1.5h(避光)后,用M9洗涤,挑取用M9洗涤过的线虫于NGM板上,使线虫恢复活力10min。用3%的琼脂糖制作琼脂平面,待凝固吸取1滴100μg/mL叠氮化钠于琼脂平面中央,再挑取10~15条虫于溶液中,盖上盖玻片,在荧光显微镜下观察,通过与对照组荧光强度大小以及各组相互之间荧光强度的对比来进行判断。
2 结果与分析
2.1 秀丽隐杆线虫体内GSH-Px、SOD、CAT活力分析
如图1所示,与对照组相比,新鲜蕨菜液和腌制1.0g/mL组均可抑制线虫体内3种抗氧化酶的活性,而腌制0.2g/mL组对线虫GSH-Px活性也有抑制作用却不如前两组明显,但对CAT和SOD两种酶活性有轻微的抑制作用。4组不同处理的蕨菜液均对线虫GSH-Px活力有抑制作用,但效果并不一致,2组新鲜蕨菜液作用效果差别不大,线虫体内GSH-Px活力分别为对照组的0.58、0.56倍,而2组腌制蕨菜液作用效果差别同样很小,线虫体内GSH-Px活力分别为对照组的0.83、0.9倍,其抑制作用不如新鲜蕨菜液组。与腌制0.2g/mL组相比,其他3种处理方法均能抑制线虫体内CAT和SOD活力,腌制0.2g/mL线虫体内CAT、SOD活力分别为对照组的1.05、1.1倍,与新鲜1.0g/mL组、新鲜0.2g/mL组、腌制1.0g/mL组相比,腌制0.2g/mL组线虫体内CAT活力分别提高了9.09%、13.41%、13.90%,SOD活力分别提高了31.82%、38.30%、37.66%。总体来说,蕨菜提取液对GSH-Px的抗氧化性抑制最为明显,SOD次之,对CAT抑制作用微弱。
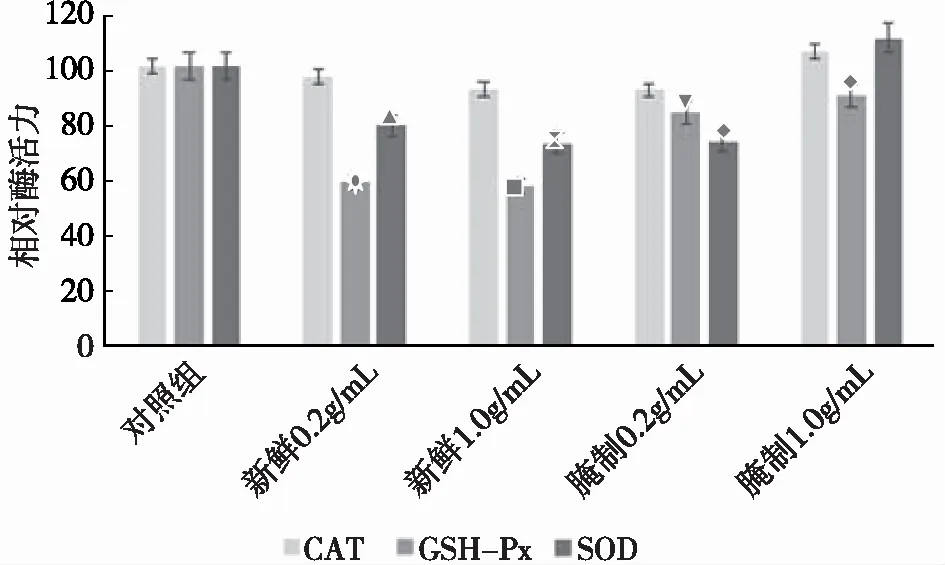
图1 4种蕨菜提取液对线虫体内抗氧化酶活力的影响注:设对照组为100%,其他组的值与对照组相比得到相对值。下同。与空白组相比,差异极显著(P<0.01);■与空白组相比,差异极显著(P<0.01);▲与空白组相比,差异显著(P<0.05);■与▼相比,差异显著(P<0.05),⦿与◆相比,差异显著(P<0.05);与空白组相比,差异显著(P<0.05);◆与空白组相比,差异显著(P<0.05)
2.2 秀丽隐杆线虫细胞体内ROS含量分析
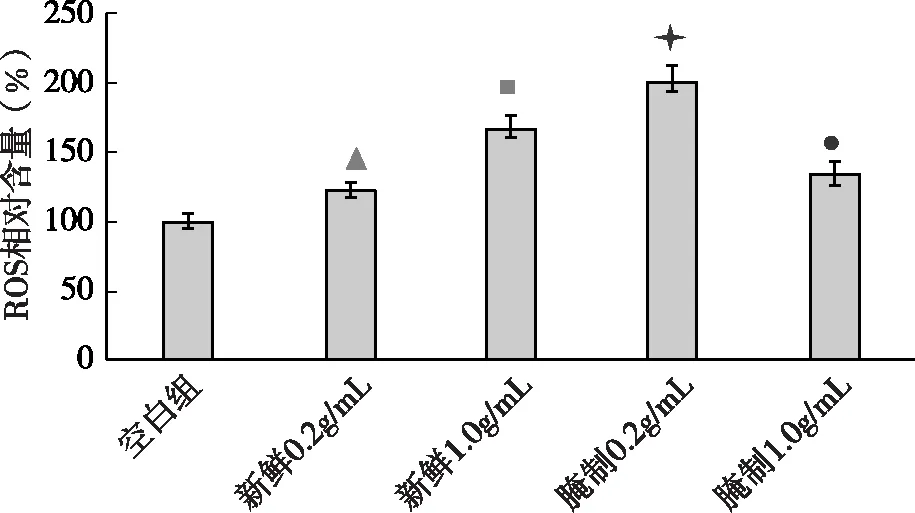
图2 4种蕨菜提取液对线虫体内ROS含量的影响注:与空白组相比,差异极显著(P<0.01);▲与空白组相比,差异显著(P<0.05);▲与相比,差异显著(P<0.05);●与相比,差异显著(P<0.05),■与●相比,差异显著(P<0.05)
如图2所示,与对照组相比,4组不同蕨菜提取液处理的线虫体内ROS含量均明显升高,其中腌制0.2g/mL组线虫体内ROS含量显著升高101.4%(P<0.01),新鲜0.2g/mL组、新鲜1.0g/mL组、腌制1.0g/mL组线虫体内ROS含量分别升高了22.9%、34.5%、67.8%(P<0.05);与新鲜1.0g/mL组相比,新鲜0.2g/mL组、腌制1.0g/mL组线虫体内ROS含量分别下降了44.9%、33.3%(P<0.05),腌制0.2g/mL组线虫体内ROS含量升高33.6%(P<0.05);与新鲜0.2g/mL组相比,新鲜1.0g/mL组、腌制0.2g/mL组、腌制1.0g/mL组线虫体内ROS含量分别升高了44.9%、78.5%、11.6%。以上结果说明,各蕨菜提取液使得线虫体内的ROS含量均显著增加,腌制0.2g/mL组线虫体内ROS含量显著增加。
2.3 秀丽隐杆线虫体内细胞凋亡的影响分析
由于DNA断裂而增加的凋亡细胞经吖啶橙染色处理后呈现黄色或橙色,正常细胞呈绿色,在荧光倒置显微镜下可观察到明显的绿色正常细胞,绿光强度越来越弱即秀丽隐杆线虫体内正常细胞越来越少,凋亡细胞越来越多。与对照组相比,新鲜组和腌制组的绿光强度均弱于对照组,即对照组的绿光强度最强;对新鲜蕨菜组,图3B-1的绿光强度强于图3B-2;对腌制蕨菜组,图3C-2的绿光强度强于图3C-1;新鲜组与腌制组相比,图3B-1的绿光强度强于图3C-1,图3C-2的绿光强度强于图3B-2,而图3B-1的绿光强度和图3C-2的绿光强度、图3B-2的绿光强度和图3C-1的绿光强度无明显差别。由此可知,蕨菜提取液对线虫细胞有凋亡作用,对新鲜组其蕨菜提取液浓度升高,其绿光强度变弱;对腌制组其蕨菜提取液浓度升高,其绿光强度变强;新鲜1.0g/mL组和腌制 0.2g/mL对线虫有明显凋亡作用,新鲜0.2g/mL组和腌制 1.0g/mL对线虫细胞的凋亡作用弱于前者。

图3A(空白对照)
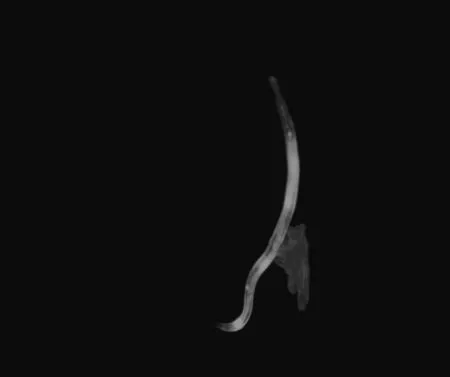
图3B-1(新鲜0.2g/mL)

图3B-2(新鲜1.0g/mL)
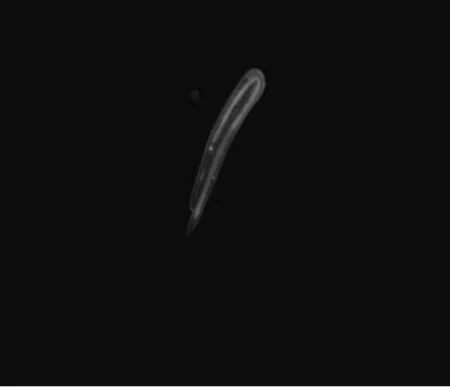
图3C-1(腌制 0.2g/mL)

图3C-2(腌制1.0g/mL)
3 讨论
3.1 不同组分蕨菜提取液对秀丽隐杆线虫体内GSH-Px、SOD、CAT三种抗氧化酶活力影响
3种氧化酶GSH-Px、SOD、CAT都是在抗氧化性方面极为重要的抗氧化剂,在清除自由基、延缓衰老、抗氧化、提高免疫力等方面有重要作用,可以在适当程度反映物质对人体的健康影响。从本实验结果来看,各组蕨菜提取液对秀丽隐杆线虫体内3种抗氧化酶活力存在抑制。先前研究显示,蕨菜中含有类黄酮和多糖类物质,类黄酮和多糖类物质均有抗氧化作用,当多糖浓度为800μg/mL时的DPPH自由基清除率可达83.1%[21]。 但从3种酶的活性分析结果和ROS测定结果来说,线虫体内酶活性受到抑制并且其ROS含量明显升高,蕨菜中此类物质的作用并未见到效果。结合细胞凋亡的结果分析,蕨菜提取液对秀丽隐杆线虫体内3种抗氧化酶在清除自由基、发挥抗氧化酶活性方面表现出消极作用,即4种蕨菜提取液抑制抗氧化性的效果较明显。从酶的抗氧化性角度分析,本实验影响线虫体内酶抗氧化性的因素很多:一是内在因素,蕨菜中本身含有抗氧化性物质可促进抗氧化酶发挥作用,但结果表明酶活性受到抑制,说明蕨菜提取液中存在抑制酶活性的物质,这种物质或抑制了蕨菜中的抗氧化性物质的表达或作用强于蕨菜中的抗氧化性物质而使得酶活性最终受到抑制;二是外在因素,本实验对蕨菜进行了腌制,腌制蕨菜中所含的亚硝酸盐等具有氧化性,一定程度上对线虫体内的抗氧化酶造成影响。这两方面也能解释为何本实验中腌制1.0g/mL组处理的秀丽隐杆线虫体内SOD、CAT的活性略高于对照组,可以对此做深入研究,从而更为准确地判定蕨菜提取液对这3种酶的作用机制和影响结果。
3.2 不同组分蕨菜提取液对秀丽隐杆线虫细胞体内ROS含量的影响
研究表明,ROS可通过细胞氧化应激反应而导致氧自由基及脂质分解物等有毒物质的产生以及诱导细胞凋亡甚至导致其坏死,并且高浓度的ROS具有细胞毒作用,也会引起细胞凋亡、坏死[22]。本实验中各组蕨菜提取液浓度处理的秀丽隐杆线虫体内ROS含量都比对照组高,其中腌制0.2g/mL组线虫体内ROS含量达到最高,新鲜1.0g/mL组次之,新鲜0.2g/mL组和腌制1.0g/mL组含量又低于前两组。通过细胞调亡试验可以证明,各组蕨菜提取液浓度对线虫细胞有明显凋亡作用,且新鲜0.2g/mL组和腌制1.0g/mL组的凋亡程度明显低于另两组,这与ROS含量测定结果对应,即ROS含量增加,对细胞有危害作用并诱导其凋亡甚至导致其坏死。再结合3种酶的活性分析,新鲜0.2g/mL组酶活抑制性弱于新鲜1.0g/mL组,且前者细胞ROS含量也低于后者;但对腌制组来说,虽然腌制0.2g/mL组酶活抑制性强于腌制1.0g/mL组且前者细胞ROS含量高于腌制1.0g/mL后者,但腌制0.2g/mL组酶活抑制性并非最强,其线虫细胞的ROS含量却为最高,从笔者上文对3种酶活性的分析讨论看,是由于各种因素对酶活性的影响而造成的结果,具体的作用机制有待进一步试验论证。但本实验可以明确得出,蕨菜提取液对线虫体内细胞的ROS含量有明显提高作用。
3.3 不同浓度蕨菜提取液对秀丽隐杆线虫细胞凋亡的影响
由本实验细胞凋亡结果可知,蕨菜提取液可以导致秀丽隐杆线虫体内细胞发生非正常的机体凋亡。各组蕨菜提取液浓度处理的秀丽隐杆线虫与对照组相比,其凋亡程度均大于对照组,其中新鲜0.2g/mL组的秀丽隐杆线虫的凋亡程度低于新鲜1.0g/mL组;腌制0.2g/mL组的秀丽隐杆线虫的凋亡程度低于腌制1.0g/mL组;对新鲜组来说,秀丽隐杆线虫体内的细胞凋亡程度与蕨菜水提取液浓度呈正相关,但对腌制组来说,则相反。从先前ROS含量测定结果来说,各组蕨菜提取液浓度处理的秀丽隐杆线虫体内ROS含量均明显升高,且其细胞ROS含量的高低与细胞凋亡程度大致对应,可以测面证实线虫细胞的凋亡。本实验中难以判断新鲜0.2g/mL组和腌制1.0g/mL组凋亡程度的大小及新鲜1.0g/mL组和腌制0.2g/mL组凋亡程度的大小;从ROS含量测定结果来说,新鲜0.2g/mL组和腌制1.0g/mL组线虫体内ROS含量分别小于新鲜1.0g/mL组和腌制0.2g/mL组线虫体内ROS含量,前两者细胞内自由基含量少于后两者,相对而言对细胞造成的损伤稍小;结合3种抗氧化酶活性的测定结果来说,新鲜0.2g/mL组和腌制1.0g/mL组线虫体内3种抗氧化酶活性分别低于新鲜1.0g/mL组和腌制0.2g/mL组,这使得二者的作用相互碰撞或抑制,其机理尚未明确不能妄下断论,可作为新的研究方向。言而总之,蕨菜提取液对秀丽隐杆线虫的这种推动非正常细胞凋亡的作用,对秀丽隐杆线虫本身而言是具有危害的。
4 结论
本文研究了不同蕨菜提取液对秀丽隐杆线虫体内抗氧化特性的影响,结果显示,不论是新鲜态蕨菜提取液还是腌制态蕨菜提取液都对秀丽隐杆线虫抗氧化性和细胞凋亡机制有消极影响。但蕨菜提取液成分复杂,自由基及细胞凋亡的影响因素众多,本文未能明确蕨菜影响抗氧化酶活和ROS的具体机理,后期可以做进一步的研究。◇

