BMP-2对ECV304细胞增殖迁移及血管生成的影响
冯鹏程, 左为汉, 蒋为民, 吴建兵
原发性肝癌,通常是指肝细胞癌(hepatocellular carcinoma,HCC),是世界上由癌症引起的死亡的第二大原因[1]。血管生成是肝癌的基本特征,对于肝癌的发生进展是至关重要的。
骨形态发生蛋白2(bone morphogenetic protein 2, BMP-2)是转化生长因子-β(transforming growth factor-β,TGF-β)家族中的一员,在细胞增殖、分化和凋亡中起着重要的作用,最近研究[2]显示BMP-2与许多恶性肿瘤密切相关,然而,BMP-2对人脐静脉内皮细胞(human umbilical vein endothelial cells,ECV304)增殖迁移和血管生成的影响尚不清楚。因此,在该研究中,构建BMP-2慢病毒载体并转染ECV304细胞,通过细胞功能实验和裸鼠模型的构建,从体内外水平观察BMP-2对ECV304细胞增殖、迁移及血管生成的影响。该研究可为肝癌临床治疗探寻新的治疗靶点和思路提供理论和实验基础。
1 材料与方法
1.1材料与仪器ECV304细胞、慢病毒载体和感染增强液(HitransG P,REVG003)均购自上海吉凯基因生物技术公司,裸鼠(15只雄性,SPF级BALB/c-nu小鼠;体质量17.7~21.8 g;室温饲养)购自湖南斯莱克景达实验动物有限公司;Real-time PCR试剂盒(AQ141)、CCK-8试剂盒(FC101)购自北京TransGen Biotech公司;Transwell小室购自美国Millipore 公司;凝胶制备试剂盒(AR0138)、总蛋白提取试剂盒(P1250)、蛋白定量试剂盒(P1511)、超敏发光试剂盒(S6009)等购自南昌Cell Scientific公司;Anti-BMP-2抗体(ab14933)、GAPDH抗体(AF7021)、Goat Anti-Rabbit IgG((BA1045)购自美国Abcam公司;核酸蛋白分析仪购自德国BioPhotometer公司;梯度PCR仪(170-9703)购自美国Bio-Rad公司;荧光定量PCR分析仪(BJ001266)、多功能酶标仪(FC)购自美国ABI公司;半干膜转仪(TE70XP)购自美国Hoefer公司。
1.2慢病毒转染及引物设计将对数生长期的细胞消化重悬后,按1×105/L密度接种于24孔板,生长过夜,等24孔板铺满30%~40%时,吸除培养液,换新鲜的培养液,根据细胞数加入复感染指数(multiplicity of infection,MOI)为20的病毒量,混合均匀后即可放入孵箱培养,24 h左右可换液,于37 ℃、5% CO2环境下贴壁培养、传代,并筛选稳定株,备后续实验使用。BMP-2引物序列:F:5′-GGAACGGA CATTCGGTCCTT-3′,R:5′-CACCATGGTCGACCTTTA GGA-3′;β-actin F:5′-AAAGACCTGTACGCCAACA CA-3′, R:5′-CGATCCACACGGAGTACTTGC-3′。
1.3Real-timePCR实验根据总RNA抽提试剂盒(ET111)说明书提取总RNA,然后用核酸蛋白分析仪对RNA浓度和纯度测定,在梯度PCR仪逆转录合成cDNA,反应条件:42 ℃、15 min,85 ℃ 、5 s,参考Real-time PCR试剂盒(AQ141)说明书加样,反应条件:94 ℃、30s,94 ℃、5s,60 ℃ 、30s,40个循环,内参为β-actin,于荧光定量PCR分析仪进行分析,根据循环阈值(cycle threshold,Ct)值计算相对表达量,实验重复3次。
1.4Westernblot实验按照总蛋白提取试剂盒说明书提取蛋白,检测蛋白浓度后加入Loading Buffer缓冲液,经100 ℃煮沸15 min,变性后上样,进行SDS-PAGE电泳,电泳结束后,采用半干膜转仪将电泳产物转移至PVDF膜上,转膜后用5%的脱脂奶粉封闭2 h,通过TBST漂洗(3 次×10 min)后,加入Anti-BMP-2抗体(稀释浓度1 ∶500)、GAPDH抗体(稀释浓度1 ∶500)4 ℃孵育过夜,TBST漂洗(3 次×10 min)后,Goat Anti-Rabbit IgG(稀释浓度1 ∶10 000)室温孵育1 h,TBST洗过(3次×10 min)后,最后浸入超敏发光试剂(S6009)中约1 min,显影成像,使用Image J 进行灰度值分析比较,实验重复3次。
1.5细胞培养与实验分组ECV304细胞在含10%胎牛血清、100 U/ml青霉素和100 μg/ml链霉素的DMEM于37 ℃、5% CO2环境下贴壁培养、传代,备后续实验使用。实验分为:① Normal组(BMP-2表达正常的ECV304细胞);② LV-SH-BMP-2组(BMP-2表达下调的ECV304细胞);③ Overexpression-LV-BMP-2组(BMP-2表达上调的ECV304细胞)。
1.6CCK-8实验胰蛋白酶消化3组对数期细胞,离心并制成细胞悬液,通过细胞计数调整浓度至6×104/ml,取3种细胞悬液分别加入到96孔板中,100 μl/孔,每组分别设计6个复孔,培养24 h(37 ℃、5% CO2的条件下培养),分别在第24、48、72小时的时候,每孔加入10 μl CCK-8溶液(不要产生气泡),在多功能酶标仪选择450 nm波长测定各组细胞吸光度(optical density,OD)值,最后统计数据和绘制增殖曲线,实验重复3次。
1.7划痕实验将3组处于对数期的细胞,接种于6孔板,当细胞生长至90%左右时,弃去培养液,用10 μl移液器的枪头沿培养板底部做“一”字划痕,划痕要垂直、均衡、相同。用 PBS 洗涤脱落的细胞,重新加入无血清的培养基,放入37 ℃、 5% CO2培养箱中培养,于0 h和24 h倒置显微镜观察并拍照,Image J计算划痕愈合率,实验重复3次。
1.8成管实验Matrigel基质胶4 ℃过夜溶解,次日在冰盒上进行铺胶,先用血清DMEM培养基1 ∶1稀释Matrigel基质胶,混匀后,50 μl/孔加入96孔板,37 ℃孵箱放置1 h;将ECV304细胞(1×105/孔)接种在Matrigel层上,并在CO2培养箱(37 ℃、5% CO2)中培养,12 h后观察,并用相差显微镜捕获图片,通过使用Image Pro Plus软件的计算机辅助图像分析确定每孔的总管长度。
1.9裸鼠移植瘤0.25%胰蛋白酶消化,用PBS混合制成单细胞悬液,取对数生长期的ECV304细胞 1×107个,注入裸鼠右侧翼皮下,负瘤小鼠4周后麻醉下处死,无菌条件下去除表面的纤维包膜、血管,剥离瘤体,测量瘤体的体积和质量。
1.10微血管密度(microvesseldensity,MVD) 将组织切片用二甲苯脱蜡,然后将玻片浸入梯度浓度的酒精(100%、95%、85%、70%)中5 min,用苏木精染色3 min和伊红染色1 min。使用EnVision检测试剂盒,用CD34标记血管内皮细胞,选择色素最强的区域作为“热点”,在显微镜下成像并计数微血管。对于一个切片,计数3个“热点”中的微血管并将它们的平均值用作切片MVD。

2 结果
2.1ECV304细胞中BMP-2mRNA的表达Real-time PCR结果:Normal组、Overexpression-LV-BMP-2组、LV-SH-BMP-2组ECV304细胞BMP-2 mRNA表达量分别为(0.98±0.02)、(2.28±0.87)、(0.35±0.03),三组间差异有统计学意义(F=177.2,P<0.01)。与Normal组比较,Overexpression-LV-BMP-2组ECV304细胞BMP-2 mRNA的相对表达增高(P<0.01),LV-SH-BMP-2的相对表达量降低,差异有统计学意义(P<0.01)。见图1A。
2.2ECV304细胞中BMP-2蛋白的表达Western blot结果显示:Normal组、Overexpression-LV-BMP-2组、LV-SH-BMP-2组ECV304细胞BMP-2 蛋白表达量为(0.89±0.11)、(1.49±0.05)、(0.43±0.09),3组间差异有统计学意义(F=89.83,P<0.01)。与Normal组比较,Overexpression-LV-BMP-2组ECV304细胞BMP-2 蛋白的相对表达量增高(P<0.01),LV-SH-BMP-2组相对表达量降低(P<0.01),差异有统计学意义。见图1B。
2.3ECV304细胞增殖能力CCK-8实验结果:与Normal组(0.76±0.11)比较,Overexpression-LV-BMP-2组ECV304细胞在72 h的增殖能力(1.43±0.19)增高(P<0.05),LV-SH-BMP-2组ECV304细胞在72 h的增殖能力(0.49±0.10)降低(P<0.05),3组间差异有统计学意义(F=326.5,P<0.05)。见图1C。
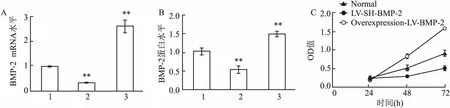
图1 ECV304细胞中BMP-2 mRNA与蛋白的表达及ECV304细胞的增殖能力
A、B:ECV304细胞中BMP-2 mRNA与蛋白的表达 ;C:各组ECV304细胞的增殖能力;1:Normal组;2: LV-SH-BMP-2组;3:Overexpression-LV-BMP-2组;与Normal组比较:**P<0.01

图2 ECV304细胞的迁移能力 ×100
2.4ECV304细胞迁移能力划痕实验结果:Normal组、Overexpression-LV-BMP-2组、LV-SH-BMP-2组ECV304细胞划痕愈合率为(40±4)%、(74±4)%、(11±7)%,3组间差异有统计学意义(F=119.1,P<0.01)。与Normal组比较,Overexpression-LV-BMP-2组ECV304细胞迁移能力增高(P<0.01),LV-SH-BMP-2组ECV304细胞迁移能力降低(P<0.01),差异有统计学意义。见图2。
2.5血管生成Normal组、Overexpression-LV-BMP-2组和LV-SH-BMP-2组ECV304细胞血管数量分别为(9.32±0.97)、(19.37±0.9)、(1.66±1.73),3组间差异有统计学意义(F=70.88,P<0.01)。与Normal组比较:LV-SH-BMP-2组及Overexpression-LV-BMP-2组差异均有统计学意义(P<0.01)。见图3A。
2.6微血管密度与Normal组MVD(31.28±1.95)相比,Overexpression-LV-BMP-2组小鼠肿瘤组织中的MVD(57.20±2.01)增加(P<0.01),LV-SH-BMP-2组小鼠肿瘤组织中的MVD(15.53±3.82)降低(P<0.01),3组间差异有统计学意义(F=361.5,P<0.01)。见图3B。

图3 三组ECV304细胞血管数量及MVD
1: Normal组;2 :LV-SH-BMP-2组;3:Overexpression-LV-BMP-2组;与Normal组比较:**P<0.01
2.7血管生成相关蛋白的表达Western blot结果显示:Overexpression-LV-BMP-2组ECV304细胞内血管内皮生长因子(vascular endothelial growth factor,VEGF)、白细胞介素-8(interleukin-8,IL-8 )、金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)、MMP-9蛋白的表达水平明显高于Normal组和LV-SH-BMP-2组,差异有统计学意义(P<0.05),见图4。

图4 血管生成相关蛋白的表达水平
1:Normal组;2:LV-SH-BMP-2组;3:Overexpression-LV-BMP-2组;与Normal组比较:*P<0.05
2.8体内移植瘤的体积与质量LV-SH-BMP-2组ECV304细胞的体内移植瘤的体积与质量显著小于Normal组ECV304细胞(P<0.05);然而,Overexpression-LV-BMP-2组ECV304细胞的体内移植瘤的体积与质量大于Normal组(P<0.05),见图5。
3 讨论
骨形态发生蛋白(bone morphogenetic protein,BMPs)是一种多功能分泌细胞因子。最初发现这些BMPs能够诱导骨和软骨的形成和发育[3],近年发现BMPs在多种癌细胞(前列腺癌、肺癌、乳腺癌、胃癌、肝癌和卵巢癌等)中异常表达[4-5]。如BMP-2在肺癌组织中的mRNA表达明显高于相应的正常组织,下调BMP-2表达可显著抑制A549和H460细胞的增殖和迁移[2]。使用慢病毒或BMP-2抗体抑制BMP-2的活性可导致肺肿瘤生长速度下降[6]。用DMH1(BMP-2抑制剂)阻断BMP信号传导可抑制非小细胞肺癌的增殖、迁移和侵袭能力,促进细胞死亡。有研究[3]通过qRT-PCR检测鼻咽癌和对应癌旁组织中BMP-2的表达水平,结果显示BMP-2mRNA在癌组织中高与癌旁组织。体外过表达BMP2可促进鼻咽癌细胞增殖和侵袭性,内源性敲低BMP-2后,结果与之相反。BMP-2也可通过激活PI3K/AKT和MEK/ERK通路促进胃癌细胞的迁移与侵袭[6]。Kim et al[7]研究表明BMP-2通过促进肿瘤干细胞增殖,来增强结肠癌细胞的运动性和侵袭性,在结肠癌转移中发挥重要作用。BMP-2沉默可以通过MAPK/ERK通路下调MMP-2和MMP-9来抑制肝癌细胞的增殖、迁移和侵袭[8]。众所周知,血管生成在恶性肿瘤的发生发展、侵袭和转移中起着重要的作用。VEGF是最强的促血管生成因子,VEGF沉默后可通过PI3K/AKT(phosphatidylinositol 3-kinase,Serine/threonine kinase)信号通路抑制HCC进展和促进细胞凋亡并减少骨肉瘤中的血管发生[9-10]。据文献[11]报道,BMP-2通过刺激VEGF分泌来促进血管生成。BMP-2也可通过刺激分化抑制因子和促分裂素原活化蛋白激酶途径参与肿瘤血管生成[12]。敲低BMPR-II后可抑制MAPK/p38和MAPK/ERK1/2途径导致VEGF-C的表达降低[13]。两种血管生成因子VEGF和BMP-2在肺恶性肿瘤的生物学评估中起重要作用,BMP-2可以增强进展性肺肿瘤的血管生成能力[14]。BMP-2可以增强VEGF和成纤维细胞生长因子-2对血管生成活性的作用。组织或者肿瘤发生发展的过程都需要足够多的必需物质,这些物质的持续输入需要一个快速有效的运输系统,最重要的就是血管的发生[15]。
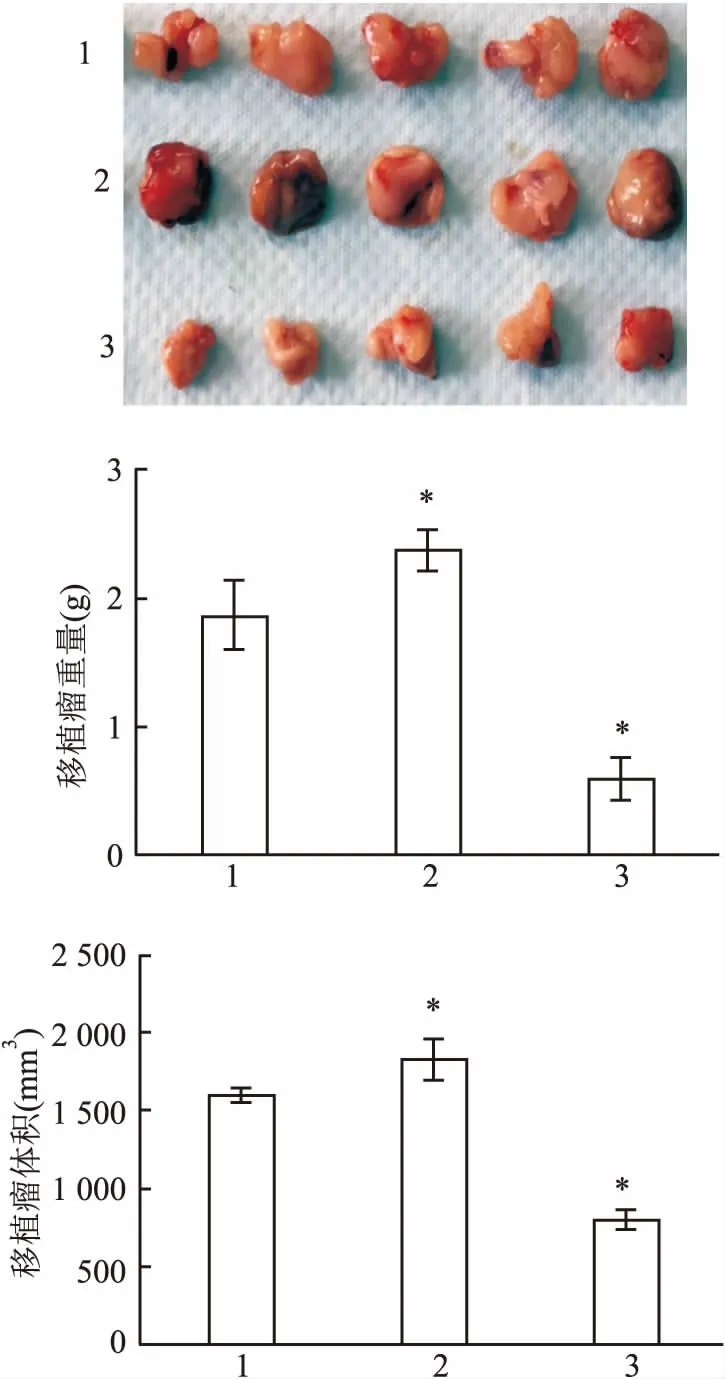
图5 体内移植瘤的体积与重量
1:Normal组;2:Overexpression-LV-BMP-2组;3: LV-SH-BMP-2组;与Normal组比较:*P<0.05
因此,在本研究中,用慢病毒在ECV304细胞中下调和上调BMP-2的表达,Real-time PCR和Western blot结果显示BMP-2 mRNA与蛋白表达增高或降低(转染成功),然后采用CCK-8、划痕实验、成管实验和Western blot检测ECV304细胞的增殖、迁移、成管数量和VEGF、IL-8、MMP-2和MMP-9蛋白的表达量,结果显示,与Normal组比较,Overexpression-LV-BMP-2组ECV304细胞的增殖能力、迁移能力、生成小管的数量和VEGF、IL-8、MMP-2和MMP-9蛋白的表达量都增加,LV-SH-BMP-2组结果与之相反,差异有统计学意义(P<0.05),同时体内实验结果显示Overexpression-LV-BMP-2组ECV304细胞的移植瘤的体积、质量和MVD较Normal组和LV-SH-BMP-2组多,且差异有统计学意义(P<0.05),体内外实验结果与上述观点一致,所以BMP-2可促进ECV304细胞的增殖、迁移和血管生成。因此,BMP-2将来有可能用于HCC的新型抗血管生成的治疗。

