即时检测芯片通道表面亲水涂膜处理工艺*
李 霞, 刘 冲, 梁 超, 李经民
(1.大连理工大学 机械工程学院,辽宁 大连 116024;2.大连理工大学 辽宁省微纳米技术及系统重点实验室,辽宁 大连 116024)
0 引 言
即时检测(point-of-care testing,POCT)技术是指临近患者病床的一种病情快速检测、分析的新兴技术,而其核心技术就是微流控检测芯片[1~3]。近些年,聚合物微流控芯片因为其制造成本低、高质量的检测表现、溶剂消耗低以及良好的生物兼容性在各个领域广泛应用[4,5]。一个典型的微流控即时检测芯片通常包括进样单元、混合反应单元、检测通道网络、废液收集单元和一些液流控制阀[6~8]。在微流控检测器件里,液体待检测样品流过通道网络进行相关反应从而获得检测结果[9~11]。液流在即时检测芯片通道网络中前进的驱动力一般是依靠毛细管通道本身的毛细力作为驱动力。但是超过通道结构一定尺度,以聚合物作为基底材料的微流控芯片,只依靠其本身材料的表面张力并不足以驱动液流平稳前进,且在检测液流过程中液体在通道中前进的液体前端流动形状不稳定,严重会产生气泡,更甚通道表面的驱动力不足会引起断流现象。当血样进行检测时,血样中的目标配体与已经事先与附着在混合反应区域的检测试剂发生反应进而得到响应信号结果[12]。也就是指血样中的抗原必须和抗体在检测区发生特异性结合才可以产生响应信号。然而不通畅平稳的液体流动会影响后续的反应和检测工作,降低检测效率和准确性。除此之外在即时检测芯片的批量生产中,片间流动的差异性也是需要控制在一定范围之内的[13]。规模化、批量化的微流控芯片表面改性处理尤其是针对即时检测芯片正面临着巨大挑战。
用于微流体驱动的常见方法有压力驱动[14]、电渗流驱动以及电水力驱动[14]等方法。其中压力驱动是依靠入口与出口的压力差驱动液流前进,产生压差的一般为微泵,而用于即时检测的微流控芯片中如再加入微泵会极大地提高制造成本。另外电渗流与电水力驱动原理相似,都是利用电场作用使液体在管道或多孔介质中流动,此方法无疑会时检测步骤繁琐,即时检测也就失去了其快速检测的意义。
本文的主要研究内容是应用增强材料表面张力的办法,针对具体一种聚合物微流控即时检测芯片的液流驱动展开研究。 具体方案为运用自行设计优化配比的二氧化钛(TiO2)溶胶作为涂膜溶液,运用一个半自动化的提拉机器,对即时检测芯片进行浸渍提拉涂膜工艺处理。亲水涂膜后芯片通道的亲水性大幅提高,样液在通道中流动形状稳定,避免了气泡产生的情况,提高了荧光检测峰值,缩小流动速度的片内与片间差异性。
1 实验部分
1.1 材料与溶液准备
实验所用芯片结构是在聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA,日本旭化成公司)经热压工艺制作的,PMMA的玻璃花转变温度约为105 ℃。实验所用主要试剂包括钛酸四丁酯(tetrabutyl orthotitanate,TBOT,AR)、无水乙醇(ethyl alcohol,EtOH,GR)、硝酸(HNO3,AR)、乙酰丙酮(acetylacetone,AcAc,AR)、去离子水等。热压工艺后基片与盖片均被浸没在DZ—1清洗剂与去离子水按照1︰20的比例配制的溶液中,在超声清洗机内超声清洗30 min,而后用清水超声清洗30 min后干燥备用。实验所用的人体血清由大连理工大学生命科学与生物技术学院提供。
1.2 芯片设计
实验所用微流控芯片如图1(a)所示,芯片整体由基片和盖片两部分组成。芯片大小为108 mm×20 mm×2 mm,芯片通道以及各控制反应单元的微结构均在基片上热压成型。基片结构由进样区、混合区、时间阀、反应通道以及废液区组成。其中进样区内放有滤纸过滤样血;混合区域用于血样中的抗原与荧光物质结合;时间阀用于放慢液体流动速度,利于抗原与荧光物质的充分结合;流动通道尺寸为宽2 mm,长60 mm,深70 mm,通道内有微柱阵列增强表面张力,通道内一段距离为荧光检测区域,该区域内附着有抗体与血液中抗体结合进而实现检测。浸渍提拉专用提拉机器移动精度为1 μm,提拉装置上下运动实现浸渍提拉动作,如图1(c)所示。
1.3 芯片制造
芯片微结构运用紫外光光刻(ultra violet-LIGA,UV-LIGA)技术制作在硅模具上,通过热压技术将微结构热压到PMMA基片上。采用超声焊接工艺将基片与盖片实现焊接形成密闭通道。基片的热压成型工艺如下:运用激光切割机将PMMA板切成芯片所需外形,将干净的PMMA板放置到热压机(本实验室自行设计制造,如图1(b))的热板上,将热板以0.5 ℃/s的速度将温度升至90 ℃保持2 min;将温度以0.2 ℃/s的速度升至120 ℃,同时将热压头下降至热压位置以0.02 MPa/s的速度加压;当温度升至120 ℃,压力升至2.0 MPa后,保持5 min;将基片降温至40 ℃,同时压力降至0.5 MPa;将温度升至70 ℃进行脱模操作。热压微结构如图1(a)所示。超声焊接过程比热压步骤简单,超声焊接机如图1(d)所示,焊接压力设定为0.2 MPa;焊接时间和保温时间分别设置为0.01 s和5 s;芯片采用高频超声焊头将基片与盖片压紧后加压焊接,焊接工艺完成;准备步骤结束后进行荧光检测,检测仪器如图1(e)所示。

图1 实验芯片及工艺所需设备
1.4 溶胶制备
实验中,溶胶配制与已有TiO2溶胶成分类似,但基于大量的配比及实验数据,优化出了一个基于本文特定芯片具体检测要求的配比及工艺方案。溶胶TBOT作为前驱体,无水乙醇为溶剂,硝酸为催化剂,AcAc作为络合剂。通过水解钛酸丁酯制备TiO2溶胶。经一系列对比试验,综合实际检测实验需要,最终获得优化溶胶配制流程如下:
1)采用20 mL TBOT溶于90 mL无水乙醇,并用磁力搅拌器进行搅拌。同时,取AcAc 6 mL滴入溶液中,不断搅拌30 min,形成1#溶液。
2)70 mL无水乙醇与4 mL去离子水混合并加入2 mL硝酸,形成2#溶液。
3)将2#溶液缓慢滴加入1#溶液中,后持续磁力搅拌器2 h,直至黄色溶胶的形成。
4)经3~5天的密封避光陈化,溶胶即可用作浸涂液。
另外,溶胶配置完成后取洁净的芯片基片,运用浸渍提拉机器以2 mm/s的提拉速度缓慢提拉成膜,后将基片放入真空烘箱60 ℃干燥30 min。后超声水浴5 min,干燥。如图2所示涂膜前后接触角对比,未经处理的PMMA接触角约为80°,处理后表面接触角约为32°。液体流动实验测录是运用体视显微镜(本实验室自主研发)。将人的血清滴入芯片进样口中,经表面亲水涂膜后的芯片通道中液体均匀流动且流动形状稳定,没有出现气泡或断流情况。最后用荧光检测仪器检测荧光强度,进而检测血样中cTnI浓度。
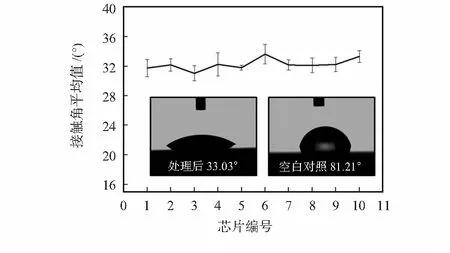
图2 亲水涂膜片间差异性实验结果(每片随机取5个测量点)
2 实验与结果分析
2.1 实验原理分析
液体在毛细管中流动时液体由毛细管内的毛细力作为驱动力,液滴滴入芯片后,液流由毛细力驱动流至检测区。Zimmermann M等人[15]研究了毛细管系统的液体流动特性,指出在毛细管中流体速度的变化符合下列理论
式中Q为流体速度,η为流体的粘度,ΔP为毛细管中的气液差,RF为毛细管中的流动阻力。可知ΔP越大Q越大,RF越小Q越小。
实验芯片通道的横截面呈矩形,在矩形毛细管系统中,气液压力符合以下理论
式中Pc为毛细管中气液半月板压差;γ为液体的表面张力;αb,αt,αl,αr分别为毛细通道上下左右4个面的接触角;a,b分别为毛细通道矩形截面的长和宽。如上述理论所示,通道内表面接触角越小,毛细管压力绝对值越大,微通道内的液体流动速度越快。基于此,可以减小通道内表面的接触角来加速通道内液体流动。
另外,在TiO2溶胶和凝胶膜形成的制备过程中发生的反应如图3(a)所示,前躯体钛酸丁酯发生水解和缩聚反应最终形成稳定凝胶膜。亲水涂层工艺处理后由工具显微镜(STM6—F10—3型,OLYMPUS公司)拍摄的芯片表面微结构如图3(b)所示,通道表面微结构处理前后并未有较大差异。如图3(c) 所示,通过表面基团红外光谱分析,经过亲水涂膜的材料表面羟基峰升高,羟基含量上升,表面羟基含量的增加提高了材料表面的亲水性,即表面接触角变小,表面张力增大。
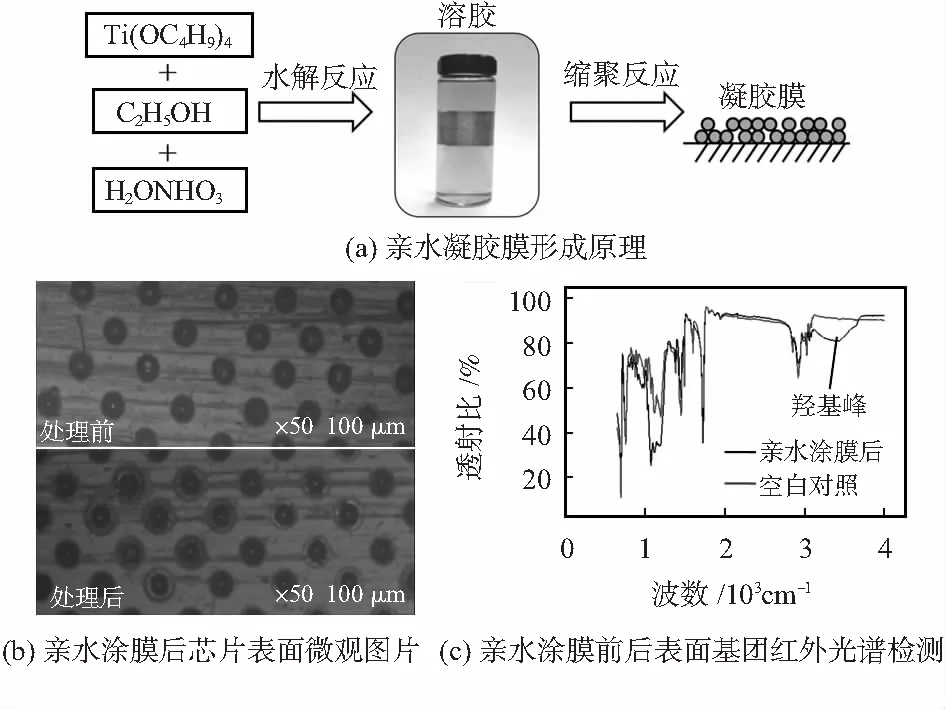
图3 亲水膜形成原理及亲水膜表面研究
2.2 亲水膜性能表征
运用Zygo表面轮廓仪检测涂层表面形貌,检测表面形貌图如图4所示。

图4 亲水膜表面质量表征
图4(a)为空白对照表面,图4(b) 为亲水涂膜处理后表面,检测结果显示空白对照的表面粗糙度为0.017 μm,亲水涂膜处理后表面粗糙度为0.010 μm,二者之间差别不大。芯片通道表面亲水性增强的原因是表面羟基含量增高而不是表面粗糙度的原因。此外运用台阶仪(ET4000M,KOSAKA,日本)测量当提拉速度为2 mm/s,温度为20 ℃的亲水膜厚。基片一半经亲水涂覆一半不处理,台阶仪探头划过两个界面表面,选取两个测量点取均值后测得平均膜厚约为234 nm。最后运用DIN EN ISO 2409︰2007方法测试膜与基底表面的结合力,检测结果如图4(a)所示,脱落比例约为8 %,因此该亲水膜与基底有很好的结合力。另外,如图4(d)所示若表面处理后不经过水浴处理会出现水滴痕迹,因此,在本文表面处理工艺中水浴处理不可或缺。
2.3 芯片流动性能表征
运用体视显微镜观察并记录芯片为通道内的液体流动情况,以研究其流动稳定性。设置一组对照实验,每组10个芯片,一组经亲水涂膜处理,一组作为空白对照,经相同的处理工序将芯片超声焊接后,观察实验结果。每个芯片注入150 μL血清,血清在芯片中流动过程由显微镜电荷耦合器件(charge coupled device,CCD)镜头拍下,检测结果及数据分析如图5。
在空白对照组中有6片芯片出现断流情况,其余未断流的芯片流动时间过长或出现不规则流动形状进而产生气泡极大影响检测。而经过亲水涂层处理的芯片则流速平稳且流速控制在可用速度范围内,如图5 (a)所示。为研究液体在不同芯片同一个功能区域内的流动速度与稳定性,将芯片主通道分为7个部分分别研究了其流动速度,结果如图5(b)所示,在每个区域内不同片间的速度标准差均不超过15 %。另外处理后液体在微通道中流动形状稳定,与未处理芯片流动形状对比如图5(c)和5(d)所示,处理过的芯片液体流动呈现稳定凸液面。
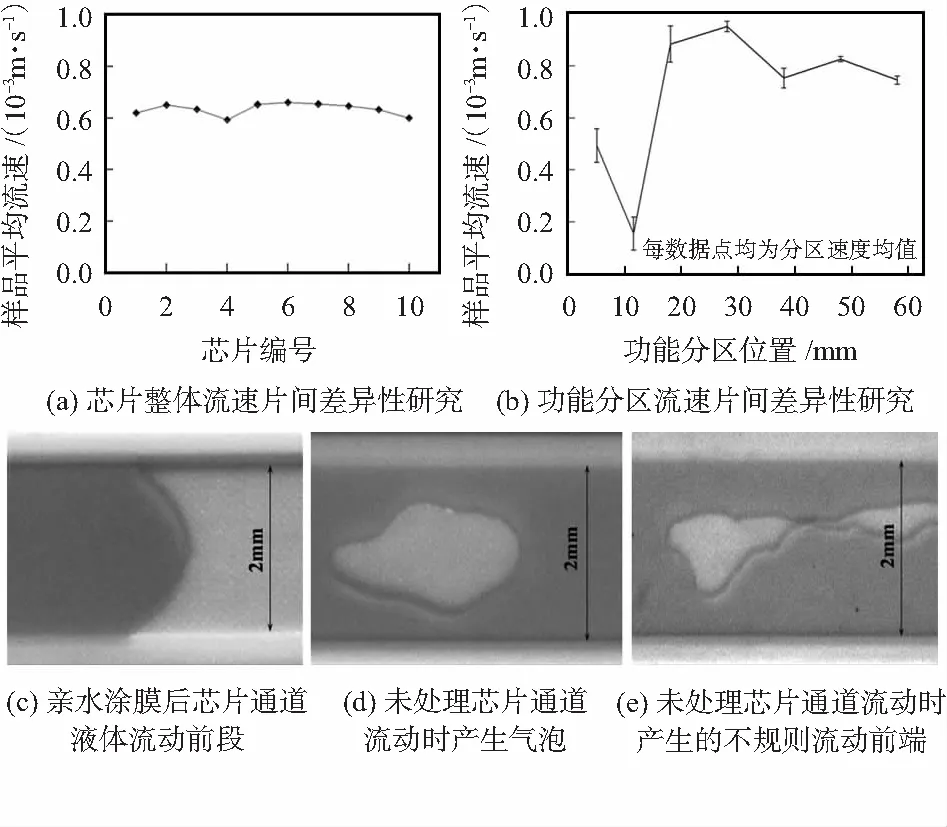
图5 亲水涂膜后芯片流动性检测
2.4 荧光配体检测
本实验即时检测芯片用于检测心肌梗死的一个生物标志物cTnI。荧光检测之前,混合区域附着有水溶性荧光物质,检测区域附着有抗体。血清进入通道时,样品与混合区中水溶性荧光物质混合,血清中cTnI与荧光物质结合。随后,血清将流入检测通道并与通道内的抗体反应,运用荧光检测技术,通过荧光强度进而判断血清中cTnI含量。检测结果如图6所示,经表面亲水处理的芯片检测结果荧光峰值均超过荧光检测强度的允许下限,基线值约为5 000~8 000,且峰值差稳定在50 000以内,均为单峰,检测曲线形状较稳定。

图6 芯片cTnI荧光检测结果
3 结 论
经研究表明:溶胶—凝胶涂层可以增加毛细管对液体的驱动力,涂膜前后材料的接触角分别为80°和32°。另外亲水浸渍提拉涂膜厚度为234 nm达到纳米级别,远小于通道结构尺寸,因此涂层不会影响通道原有微结构,且成膜质量良好,与基底粘附性好。且亲水涂层改性后,液体在微通道内流动性能得到提高。最后亲水涂层工艺可以显著提高cTnI荧光检测峰值,峰值稳定不会出现多峰情况。

