静宁颗粒对治疗小儿注意缺陷多动障碍的作用机制研究*
杨爱玲,严素玉,张天睿,张彩峰,张硕峰,程 龙,马 丹,宋敬怡
(北京中医药大学中药学院 北京 100029)
小儿注意缺陷多动障碍(attention deficithy peractivity disorder,ADHD)是常见于儿童时期的精神行为异常性疾病[1-3]。学龄儿童患病率为2%-10%,并呈逐年上升的趋势。ADHD 通常发病早于6 岁[4],其中患儿症状可持续到青春期的人数高达70%,可延续至成年的患儿有1/3。临床上ADHD患病率高,并且多数患儿共患其他行为障碍,对患儿整个成长过程中的学习、生活等产生深远的影响。因此,国内外学者对ADHD 的研究越来越重视,并成为近年来研究热点[5]。西医治疗本病的常用药盐酸哌甲酯,该药起效快、效果满意[6],但禁用于6岁以下儿童[7],随着临床投入使用不断出现的不良反应,也严重限制了临床对该药的使用;中药制剂具有低毒、不良反应少、安全的优势,研发安全有效的中药制剂,对于成长发育期的儿童来讲极其重要。
目前ADHD 的病因和发病机制还未明确[8],而大量实验研究表明,ADHD发病与前额叶、纹状体通路中的多巴胺能神经及其下游有着密切关系[9-12]。基于研究发现间接使用多巴胺能神经激动剂可治疗ADHD,研究者提出了ADHD 发病机制假说:多巴胺失调假说[13],其认为ADHD 的发病可能与脑内多巴胺水平调控失衡有密切关系。多巴胺是一种中枢神经系统中重要的神经递质,与调节人的情感表达、运动能力和认知能力等有关。多项研究表明脑内多巴胺神经功能主要通过多巴胺受体调控其功能,前额叶皮层和纹状体中DRD1 和DRD2 的高表达对机体活动控制和认知功能有重要调节作用[14-16]。
目前对于多动症的治疗药物,以化药为主,例如安非他明类(AdderallXR)以及利他林类药物(Daytrana),占据了市场大部分的份额。但由于远期疗效欠佳及药物的不良反应,限制了其广泛应用[17,18]。另外一类治疗AHHD 的化药如择思达,通过调节去甲肾上腺素水平,增加突出间隙去甲肾上腺素有效浓度发挥治疗作用,但也有不良反应如头晕、恶心等。小儿处于成长发育期,长期服用化药治疗,对小儿影响显著且长远,因而化药不良反应及副作用已日益成为大家所关注的焦点。中药制剂具有低毒少副作用的优势,研发安全有效的中药制剂是治疗处于成长发育期的儿童多动症的重要事项,因此探寻治疗ADHD 的安全有效中医方药,成为当前研究的热点[8]。
本研究采用化药利他林及小儿黄龙颗粒为阳性药,利他林代表性中枢神经兴奋剂;小儿黄龙颗粒为国家食品药品监督管理局(SFDA)批准的治疗ADHD的中药新药。
SHR大鼠是国际上公认的ADHD模型大鼠[19,20],其在4-10 周龄之间呈现出典型ADHD 的症状[21],即多动、冲动、学习记忆障碍,具有良好的表面效度[22];部分精神兴奋剂可对SHR 大鼠的行为、认知异常有改善作用,这增强了SHR 大鼠作为ADHD 动物模型的结构效度。在对SHR 大鼠前额叶、纹状体内递质含量及功能变化的研究中,SHR 大鼠表现出典型的多巴胺含量异常和功能的降低[23],这与当前ADHD 发病机制假说多巴胺缺陷理论不谋而合,具有良好的预测效度[22]。
本研究采用自发性高血压大鼠(SHR)作为注意力缺陷多动障碍(ADHD)大鼠模型[5,6,21],采用大鼠自主活动的行为学指标评价静宁颗粒对ADHD 的治疗作用,并应用PCR、Western Blot 法测定SHR 大鼠大脑前额叶、纹状体部位DRD1、DRD2基因及蛋白表达水平,探求静宁颗粒治疗ADHD的作用机制。
1 材料与方法
1.1 实验动物
SHR 大鼠72 只,雌雄各半,体重50-70 g,WKY 大鼠12 只,雌雄各半,体重50-70 g,由北京维通利华实验动物技术有限公司提供。动物合格证号:11400700165636,11400700161596。室温为(23±2)℃,相对湿度为(65±5)%,实验前动物适应性饲养3 d,自由摄取食水。
1.2 药品与试剂
静宁颗粒,棕褐色粉末,由北京中医药大学倪健教授提供;临床人用量为3.38 g·kg-1,大鼠受试剂量为20.25 g·kg-1,10.13 g·kg-1,5.06 g·kg-1。
小儿黄龙颗粒:由重庆希尔安药业有限公司生产,规格每袋装5 g,批号:150501,大鼠受试剂量为0.9375 g·kg-1,为临床人用量的6 倍。盐酸哌甲酯缓释片(利他林):由西安杨森制药有限公司生产,规格18 mg,批号:41E416,大鼠受试剂量为6.75 mg·kg-1,为临床人用量的6倍。
逆转录试剂盒:TIANScript RT Kit;qPCR 试剂盒:SYBR FAST qPCR Kit Master Mix(2×) Universal(美国KAPA Biosystems);Trizol:invitrogen;Protein lysis buffer(优科卓业生物P001);BCA Protein Assay Kit(cwbiotech 02912E);Protein ladder(Biomed);PVDF membrane,0.45 um(Millipore);Acrylamide(Amresco 0341);Bis-Acrylamid(Amresco 0172);Glycine(Sigma G8898);SDS(Sigma L4390);APS(Amresco 0486);TEMED(Amresco 0761);Tween-20(Amresco 0777);Bromphenol Blue(Amresco 0449);DTT(Amresco 0281);Trizma base(Sigma T150);Protease inhibitor cocktail(Roche 04693116001);Non-fat milk(Erie yili);ECL(Millipore WBKLS0500);Methanol(dried)(Sinopharm10014118);nacl(Sinopharm10019392);goat anti rabbit IgG(H+L),HRP(Jackson111-035-003);goat anti mous IgG(H+L),HRP(Jackson115-035-003)。
1.3 主要仪器
AR1140/C型电子分析天平,奥豪斯(上海)公司产品;Noldus 动物行为EthovisionXT9.0;高速冷冻离心机:Beckman Allgre 21R(Beckman 公司);电泳仪(北京六一仪器厂);电泳槽(北京君意东方电泳设备有限公司);凝胶成像仪:BioSens SC 810B(上海山富科学仪器有限公司);分光光度计:UV-2000(上海菁华科技有限公司);实时定量PCR 仪:ABI7500(USA);High speed refrigerated centrifuge(XIANGYI);Multiskan Mircoplate reader(Thermo);VE180 Mini-protean 3 Dodeca(Tanon);VE186 TBC(Tanon);PowerPac HC Power Supply(BioRad);PH meter(Sartorius);shaker(Kylin-Bell);homogenizer(Fluka)。
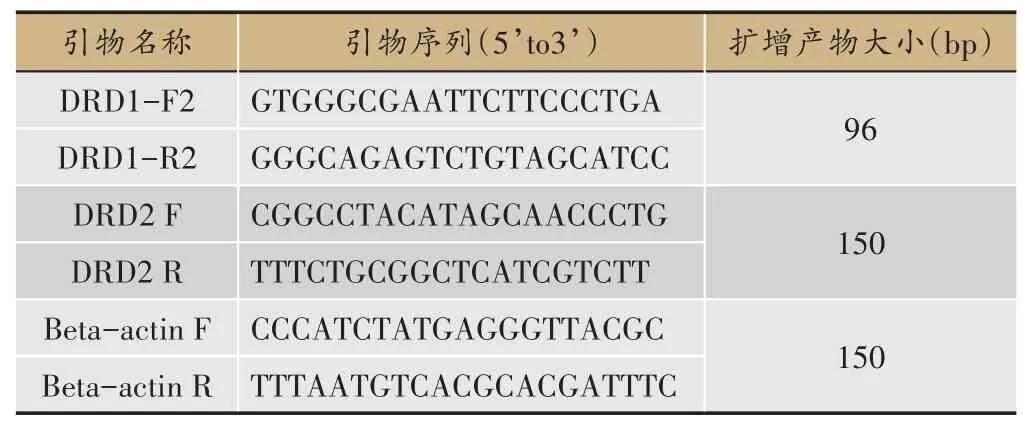
表1 DRD1,DRD2引物设计具体序列
1.4 动物分组与给药
将SHR 大鼠随机分为6 组,每组12 只,雌雄各半,即模型组、利他林组、小儿黄龙颗粒组、静宁颗粒20.25、10.13、5.06 g 生药/kg 组,另用12 只WKY 大鼠设为对照组。各给药物均按0.5 mL/100 g 体重灌胃给药,每日1 次,模型组、对照组灌服去离子水。连续给药17 d。
1.5 实验方法
1.5.1 自主活动行为学测试
末次给药1 h 后,将大鼠放在Etho Vision XT 9.0 with the Open Field test 的仪器中,观察30 min。分别记录每只大鼠4 个行为学指标,包括:Distance Moved Total、Velocity、Moving/Center-point Cumulative Duration、Body elongation Normal Cumulative Duration。
1.5.2 脑内DRD1、DRD2 mRNA 及蛋白表达含量检测
(1)样品制备
自主活动测定完成后,各组大鼠均在末次给药后1 h脱颈椎处死,在冰台上迅速分离出大脑两侧的前额叶皮质和纹状体,液氮速冻后转移至-80℃冰箱保存。
(2)引物合成
使用ncbi-primer 进行设计与调试(表1):
(3)RT-PCR 方法检测各组大鼠额叶皮质和纹状体中DRD1和DRD2的mRNA表达变化
将已称重并保存于-80℃冰箱中的组织迅速取出,用液氮研磨后,置于1.5 mL 离心管中,取20 mg 的组织加入1 mL Trizol溶液匀浆,待匀浆充分后,剧烈震荡20 s,冰上静止30 min。以每1 mL Buffer RLT 加入200 uL氯仿的比例加入氯仿,盖好管盖,剧烈振荡15 s,室温放置2 min。12 000 rpm 离心10 min,样品分层后,加入1 倍体积的70%乙醇(RNase-Free Water),混匀。将得到的溶液转入Spin Column RM 中(Spin Column RM 放 入2 mL RNase-free Collection Tube 中)12000 rpm 离 心20 s,弃Collection Tube 中废液。向Spin Column RM 中加 入350 μL Buffer RW1 8000 xg(10 000 rpm)离心15 s,弃废液。将Spin Column RM放回2 mL Collection Tube中。向70 μL DNase I Buffer中加入10 μL DNase I,混匀。向Spin Column RM 中直接加入80μL DNase I 混合液,20-30℃孵育15 min。向Spin Column RM 中加入350 μL Buffer RW2 8000 x g(10 000 rpm)离心15 s,弃废液。将Spin Column RM 放回2 mL Collection Tube 中重复1 次。将Spin Column RM 放回Collection Tube 中,12 000 rpm 离心1 min。将Spin Column RM 转入新 的 1.5 mL RNase-free Collection Tube 中,加30 μL RNase-free Water,室温放置1 min,12 000 rpm离心1 min。取8 uL RNA用1%琼脂糖凝胶进行电泳。
(4)Western-blot 方法检测各组大鼠额叶皮质和纹状体中DRD1和DRD2的蛋白表达变化
前额叶皮质和纹状体用1 mL的RIPA缓冲液匀浆,12 000×g离心后,取上清液。在95%水浴中变性5 min。样品液经SDS-聚丙烯酰胺凝胶电泳后,进行转膜。用封闭液37℃封闭1 h。封闭后,孵育一抗2 h或4℃静置过夜。PBST漂洗3次后(每次5 min),二抗室温孵育1 h。采用暗室曝光显影胶片。最后,将胶上目的条带扫描进电脑,用Bandscan软件进行灰度分析。
1.5.3 统计学处理
以上所有结果运用SAS system for windows V8 进行数据统计分析,数值采用(±s)表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 静宁颗粒对ADHD模型大鼠自主活动的影响
结果显示对照大鼠移动距离、移动速率、敞箱中心区域移动累计时间、身体拉长累计时间均较模型组大鼠差异明显(与模型组对比P<0.01),模型组大鼠行为与小儿注意缺陷多动障碍(attention deficithy peractivity disorder,ADHD)患儿活动过度、焦虑的表现相一致。静宁颗粒各剂量可明显缩短SHR 大鼠在敞箱的移动距离和在敞箱中心区域移动累计时间(与模型组相比P<0.05,P<0.01),静宁颗粒20.25 g·kg-1可明显降低SHR 大鼠的移动速率(与模型组相比P<0.05)。静宁颗粒各剂量可不同程度减少身体拉长累计时间(与模型组相比P>0.05)(表2,表3)。
表2 静宁颗粒对ADHD模型大鼠自主活动的影响(1)(±s,n=12)
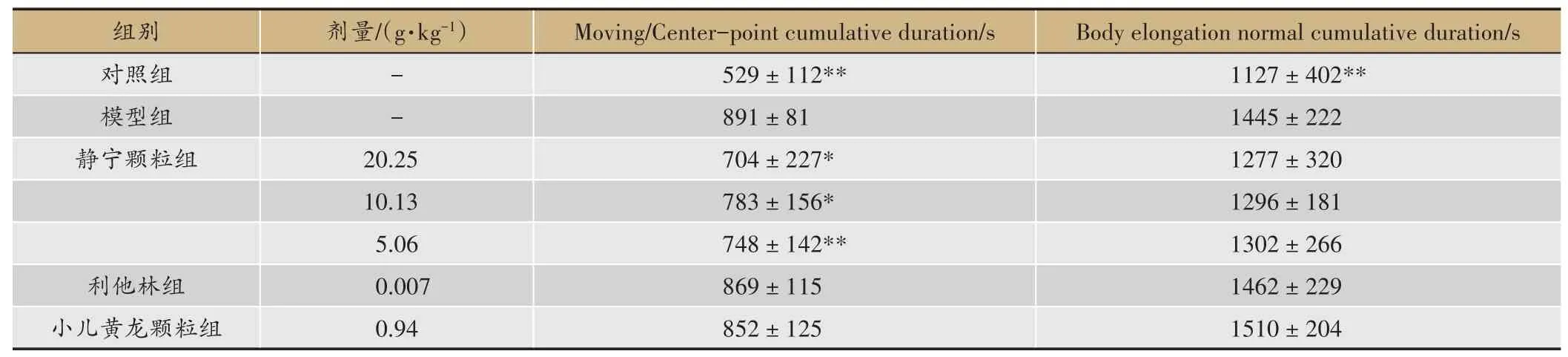
表2 静宁颗粒对ADHD模型大鼠自主活动的影响(1)(±s,n=12)
注:与模型组相比*P <0.05,**P <0.01
2.2 静宁颗粒对ADHD 模型大鼠多巴胺能神经的影响
2.2.1 PCR检测结果
结果显示,模型组大鼠脑前额叶、纹状体中DRD1,DRD2 mRNA 相对含量均较WKY 大鼠不同程度的减少,其中纹状体中DRD1,DRD2 mRNA 相对含量明显减少(与模型组相比P<0.05)。静宁颗粒20.25 g·kg-1可不同程度增加SHR 大鼠脑前额叶、纹状体中DRD1,DRD2 mRNA 相对含量,但与模型组相比较无统计学意义(表4,表5)。
2.2.2 Western blot检测结果
SHR 大鼠脑前额叶、纹状体中DRD1、DRD2 蛋白表达量均较WKY 大鼠明显减少(P<0.05)。静宁颗粒各剂量均可明显抑制SHR 大鼠脑前额叶、纹状体中DRD1 蛋白表达减少(与模型组相比P<0.05);静宁颗粒20.25、10.13 g·kg-1可明显抑制SHR 大鼠大脑前额叶、纹状体中DRD2 蛋白表达减少(与模型组相比P<0.05),静宁颗粒20.25 g·kg-1可明显抑制SHR 大鼠大脑纹状体中DRD2 蛋白表达减少(与模型组相比P<0.05)(表6,表7)。
3 讨论
小儿注意缺陷多动障碍(ADHD),亦称小儿多动症,患儿与同龄儿童相比,有明显的多动、学习或记忆障碍的一组综合征。ADHD是儿童时期最为常见的行为障碍,学龄儿童患病率高,并呈逐年上升的趋势。
表3 静宁颗粒对ADHD模型大鼠自主活动的影响(2)(±s,n=12)
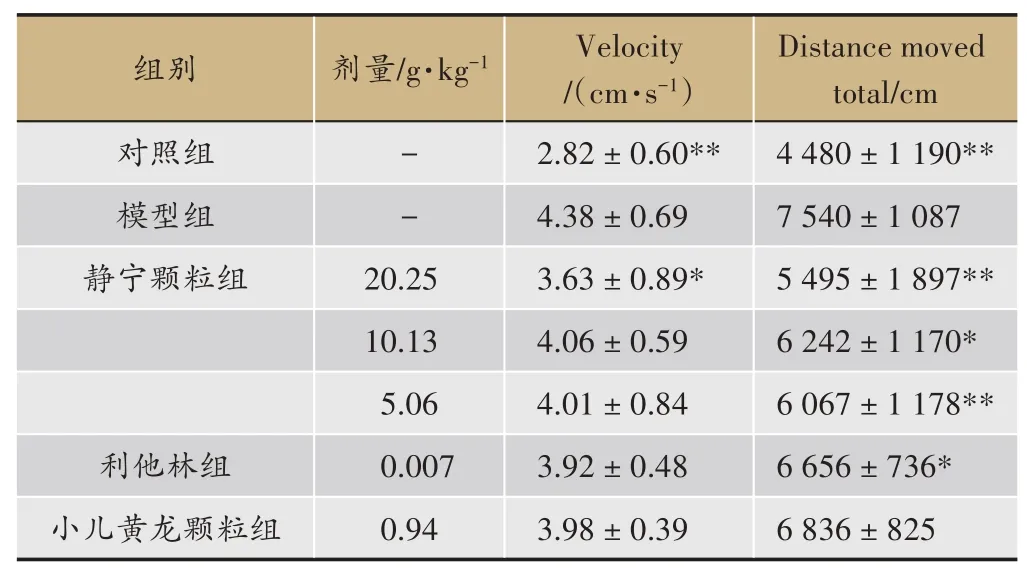
表3 静宁颗粒对ADHD模型大鼠自主活动的影响(2)(±s,n=12)
注:与模型组相比*P <0.05,**P <0.01
表4 静宁颗粒对ADHD模型大鼠大脑前额叶中DRD1,DRD2 mRNA相对含量的影响(±s,n=4)
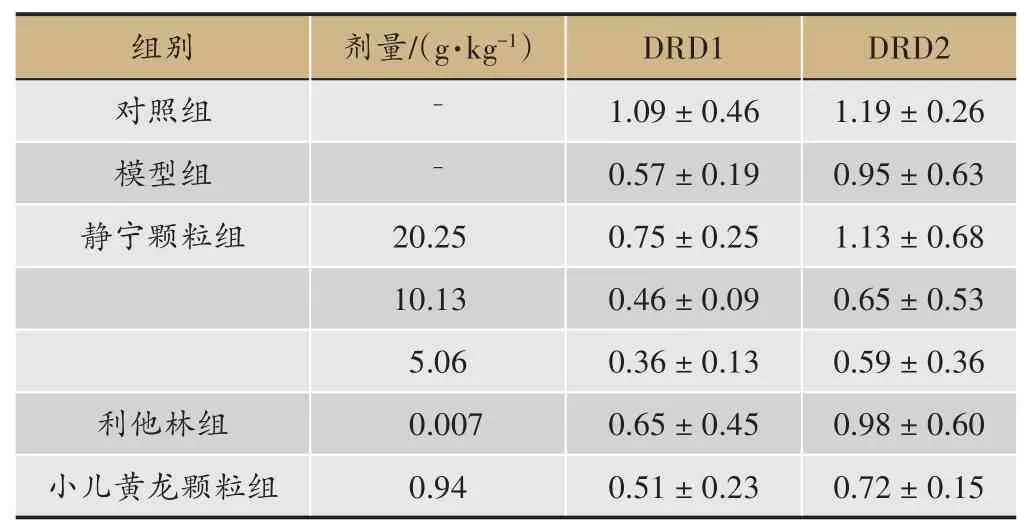
表4 静宁颗粒对ADHD模型大鼠大脑前额叶中DRD1,DRD2 mRNA相对含量的影响(±s,n=4)
表5 静宁颗粒对ADHD模型大鼠大脑纹状体中DRD1,DRD2 mRNA相对含量的影响(±s,n=4)
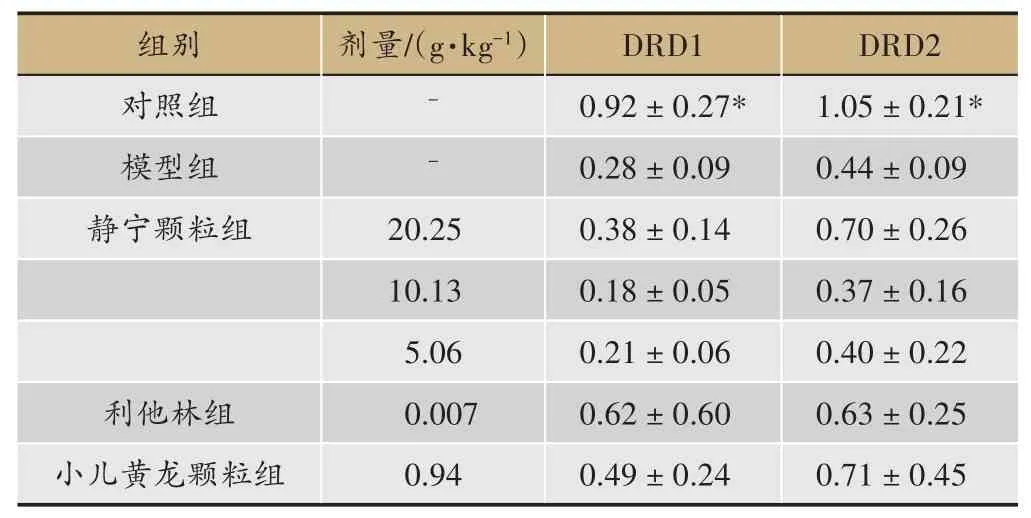
表5 静宁颗粒对ADHD模型大鼠大脑纹状体中DRD1,DRD2 mRNA相对含量的影响(±s,n=4)
注:与模型组相比*P <0.05
表6 静宁颗粒对ADHD模型大鼠大脑前额叶受体表达的影响(±s,n=4)
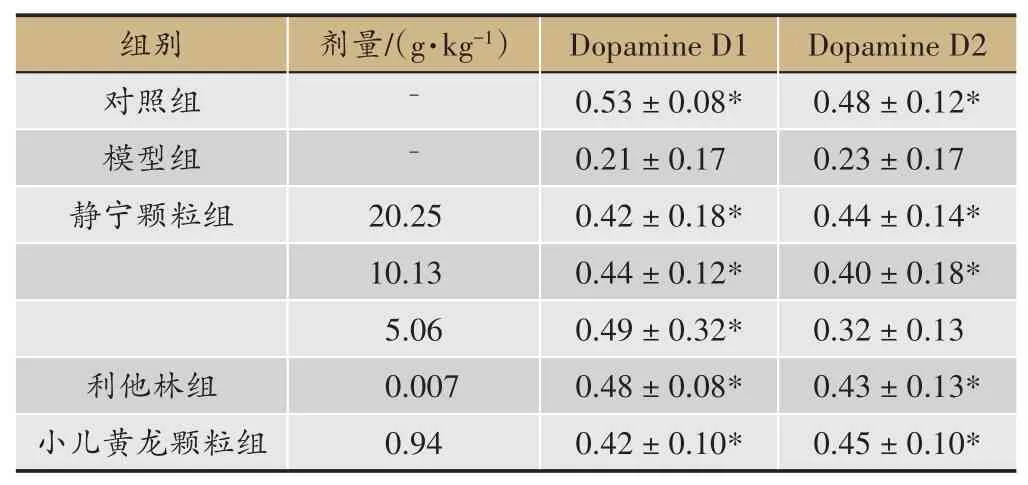
表6 静宁颗粒对ADHD模型大鼠大脑前额叶受体表达的影响(±s,n=4)
注:与模型组相比*P <0.05
表7 静宁颗粒对ADHD模型大鼠大脑纹状体受体表达的影响(±s,n=4)
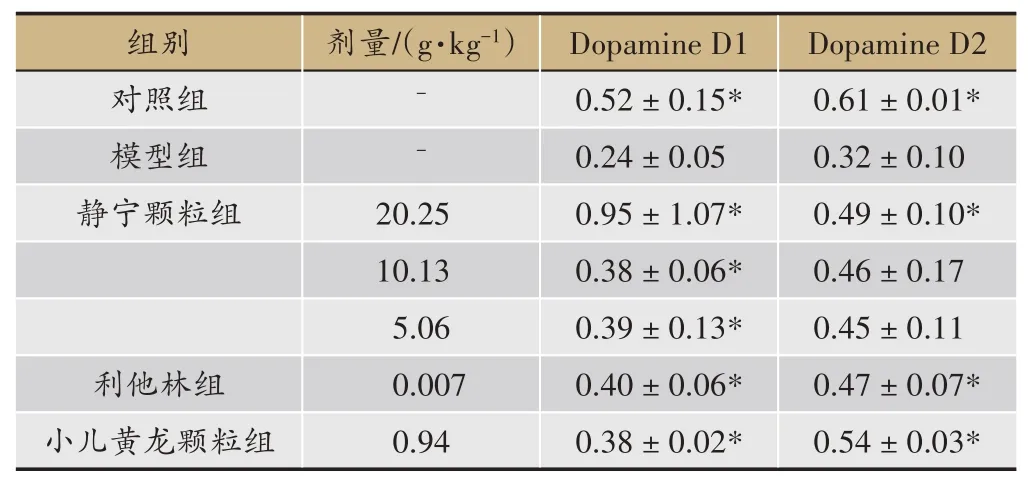
表7 静宁颗粒对ADHD模型大鼠大脑纹状体受体表达的影响(±s,n=4)
注:与模型组相比*P <0.05
传统中医对ADHD 没有专门记载,根据其临床主症来看,可以归于“脏躁”、“躁动”等疾病范畴;该病总体主要原因是阴阳失衡,脏腑失调,根本病症是虚症,辅助病症是虚症,即虚证为主,实证为辅,“心、肝、脾、肾、肺、脑”为其病位。“阴阳失调,阴虚为主,阴静不足,阳亢有余,因而阴不能制阳;脏腑阴阳失调,五脏均受其损害,神伤为主”为病机要点。针对此特点王俊宏教授根据多年来临床患儿的用药经验,总结出了静宁颗粒经验方[24]。该方由太子参、熟地、枸杞子、五味子、远志、石菖蒲、茯苓等组成。方由太子参、熟地补脾补血,益气益精,生津养阴,共为君药;枸杞子、五味子补血补肾,安神宁心,共为臣药;远志、石菖蒲安神开窍醒神益智,茯苓健脾补中共为佐使药。全方益气养阴,宁心安神,突破传统的中医治疗多动症的思路,从更深层面上研究其中医病机“阴阳失调”,突出“阴平阳秘,精神乃治”的中医理论。现代药理研究也表明,远志、石菖蒲具有镇静安神,醒神开窍的作用[25],可改善SHR 大鼠多动症状[26]。本研究使用Noldus 动物行为分析系统评价SHR 大鼠的自主活动,实验结果显示,SHR 大鼠的移动距离、移动速率、敞箱中心区域移动累计时间、身体拉长累计时间均较WKY 大鼠明显增加,显示了SHR 模型大鼠具有多动、焦虑的症状,与临床上ADHD 的症状极为相似,而静宁颗粒连续灌胃给药17 d 可明显逆转上述SHR 大鼠行为特征,提示静宁颗粒具有治疗ADHD的作用。
注意缺陷多动障碍(ADHD)的病因和发病机制目前研究尚未明确,目前临床主要采用中枢兴奋剂进行治疗。研究表明ADHD 发病与前额叶和纹状体功能障碍有关,前额叶是维持注意、控制冲动等行为活动的重要调控部位,纹状体是神经环路与前额叶皮质相连形成认知调控的重要通路的组成部分,并对随意运动的稳定、肌紧张的控制、本体感觉冲动信息的处理有着调节作用。近年来,许多研究者提出了诸多ADHD 发病机制假说,其中“多巴胺缺陷理论”被普遍接受的假说之一,因而对多巴胺系统的研究很重要。多巴胺的受体分为D1样和D2样,DRD1和DRD2的高表达与机体活动和认知功能相关[27-29]。本实验进一步研究表明静宁颗粒可显著升高大鼠大脑脑前额叶、纹状体中DRD1、DRD2 蛋白表达量,提示静宁颗粒治疗ADHD 作用机制可能与影响多巴胺能神经作用,增加前额叶、纹状体中DRD1、DRD2蛋白表达量有关,这与中医病机“阴阳失调”,突出“阴平阳秘,精神乃治”的中医理论相吻合。
4 结论
研究结果表明静宁颗粒对ADHD 模型大鼠行为具有一定干预作用,ADHD 模型大鼠的自主活动显著减少,提示静宁颗粒对ADHD 具有一定的治疗作用。静宁颗粒益气养阴,宁心安神,主要适用于具有气阴两虚证的小儿多动症,其突破传统的中医治疗思路,从更深层面上研究了其中医病机“阴阳失调”,突出“阴平阳秘,精神乃治”的中医理论。进一步研究表明静宁颗粒可显著升高大鼠大脑脑前额叶、纹状体中DRD1、DRD2 蛋白表达量,提示静宁颗粒治疗ADHD作用机制可能与影响多巴胺能神经作用,增加其下游蛋白表达量有关,这与中医病机“阴阳失调”,突出“阴平阳秘,精神乃治”的中医理论相吻合。在中医药理论的指导下治疗ADHD 获得良好的治疗效果,目前未发现毒副作用,在治疗和改善ADHD 症状方面具有重要的意义。

