翘嘴鲌胰岛素样生长因子-Ⅰ的克隆及序列分析
刘士力 程 顺 蒋文枰 迟美丽 郑建波 贾永义 赵金良 顾志敏
(1. 浙江省淡水水产研究所, 农业农村部淡水渔业健康养殖重点实验室/浙江省淡水水产遗传育种重点实验室, 湖州 313001;2. 上海海洋大学, 农业农村部淡水水产种质资源重点实验室, 上海 201306)
下丘脑-垂体-肝轴(Hypothalamic-pituitary-liver axis, HPL)在脊椎动物的生长发育中起到重要作用,生长激素(Growth hormone, GH)和类胰岛素生长因子-Ⅰ(Insulin like growth factor-Ⅰ, IGF-Ⅰ)是HPL轴的核心多肽[1]。IGF-Ⅰ主要由肝脏合成, 局部组织细胞也可产生和分泌, 在体内主要存在于血液中,具有调节细胞代谢, 促进细胞增殖和分化等多种生理功能[2]。IGF-Ⅰ是由70个氨基酸残基组成的碱性单链多肽, 具有B、C、A、D四个结构域, 在脊椎动物中高度保守[3]。鱼类IGF-Ⅰ基因具有4个内含子, 其中第2内含子较长[4, 5]。基因的内含子在调节基因的表达过程中具有重要作用[6], 其中经常包含一些微卫星和单核苷酸多态性位点(Single nucleotide polymorphism, SNP), 有时与生产性状密切相关。阮瑞霞等[4]在吉富罗非鱼(Oreochromis niloticus)内含子1和内含子3中发现与增重有关的2个SNP; 鲤(Cyprinus carpio)内含子1和2中也存在2个微卫星位点与体质量有关[1]; 大西洋鲑(Salmo salarL.)内含子1和内含子3中分别包含1个与增重相关的SNP[7]。
翘嘴鲌(Culter alburnusBasilewsky)是鲌亚科中体型最大的一种鱼类, 隶属于鲤科(Cyprinida)、鲌亚科(Culterinae)、鲌属(Culter), 广泛分布于中国各大水系[8]。太湖中出产的翘嘴鲌被誉为“太湖三白”之一, 其肉白而细嫩, 味美而不腥, 一贯被视为上等佳肴。此外, 翘嘴鲌在淡水水域生态系统中处于食物链的顶端, 对维持生态系统的稳定具有重要作用。近年来, 翘嘴鲌养殖规模不断扩大, 浙江省养殖面积达到2×107m2以上。开展翘嘴鲌的育种具有巨大的经济效益, 采用分子标记技术作为辅助手段可以提高育种效率。目前已有一些翘嘴鲌微卫星标记被开发[9, 10], 并获得了翘嘴鲌GH基因序列信息, 其编码的210个氨基酸与团头鲂(Megalobrama amblycephala)完全一致[11]。IGF-Ⅰ序列相对较长, 其内含子1长度一般在6000 bp以上, 本研究通过转录组中的mRNA序列与草鱼和鲤的IGF-ⅠDNA序列进行比对, 设计引物扩增了翘嘴鲌IGF-Ⅰ基因全序列, 通过对其核苷酸序列及编码的氨基酸进行比较分析, 以期为翘嘴鲌分子标记选育做好铺垫, 同时为鲌亚科鱼类进化机制研究提供理论依据。
1 材料与方法
1.1 实验材料
实验动物: 实验用翘嘴鲌采自浙江省淡水水产研究所综合试验基地。其中用于定量表达分析的材料为2龄翘嘴鲌, 雌雄各3尾, 每尾翘嘴鲌取适量的肝、脾、肌肉、肾、脑、心脏、鳃、胃、精巢和卵巢组织分成3份经样品保护液(Sample Protector for DNA/RNA) 4℃过夜后放在-80℃保存, 用于后续RNA的提取。用于微卫星性状关联分析的样本为同一批繁殖, 并养殖在同一池塘的翘嘴鲌。测量体长和体质量后取适量尾鳍用无水乙醇保存, 用于后续DNA的提取。
主要试剂: 样品保护液、RNA提取试剂、PCR反应试剂、pMD18-T载体和SYBR®Prime ScriptTMRT-PCR Kit购自宝日医生物技术(北京)有限公司,胶回收试剂盒、大肠埃希菌 (Escherichia coli) DH5α、氨苄和异丙基硫代半乳糖苷购自天根生化科技(北京)有限公司, 用于DNA提取的试剂购自生工生物工程(上海)股份有限公司, Reverse Transcription System购自普洛麦格(北京)生物技术有限公司。
1.2 翘嘴鲌IGF-Ⅰ基因的克隆
采用苯酚-氯仿法提取样本DNA。用1%琼脂糖凝胶检测提取DNA的完整性, DNA原液于-20℃保存备用。利用本实验室获得翘嘴鲌转录组中IGF-Ⅰ的mRNA序列在GenBank中进行Blast, 结果表明与已有DNA全长的草鱼(Ctenopharyngodon idella)(登录号: KF199853)和鲤(登录号: AF465830)推测的mRNA序列相似度较高, 根据其保守区域和已知序列设计8对特异性引物(表 1)。引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为25 μL: 10×Buffer (含Mg2+) 2.5 μL, dNTPs (各2.5 mmol/L) 2.0 μL, 模板DNA (50 ng/μL) 1 μL, 上游、下游引物(10 μmol /L)各0.5 μL,Taq聚合酶(5 U/μL) 0.2 μL, 灭菌超纯水补足体系。PCR反应程序: 94℃预变性5min; 94℃变性30s; 58℃退火30s,72℃延伸3min, 共32个循环; 72℃延伸10min; 4℃保存。PCR产物克隆后送生工生物工程(上海)股份有限公司进行测序。
1.3 翘嘴鲌IGF-Ⅰ基因的生物学分析
利用软件ContigExpress将所获得的DNA片段和已知的mRNA序列拼接在一起; IGF-Ⅰ基因的mRNA及编码的氨基酸序列按照刘士力等[12]的方法进行分析。内含子的相似度通过GenBank的Blast功能计算。微卫星和小卫星的查找分别通过SSRhunter 1.3和在线软件Repfind进行。

表 1 研究中使用的引物Tab. 1 Primers used in the current study
1.4 翘嘴鲌IGF-Ⅰ基因的定量表达分析
将翘嘴鲌肝、脾、肌肉、肾、脑、心脏、鳃、胃、精巢和卵巢组织用RNAiso Plus (TaKaRa)分别提取RNA, 用核酸定量仪和琼脂糖凝胶电泳检测RNA的质量和完整性, 随后用Reverse Transcription System (Promega)进行反转录合成cDNA, 具体方法按照说明书进行。根据本实验中已经得到的翘嘴鲌IGF-Ⅰ基因的开放阅读框cDNA序列, 设计合成一对跨内含子的正反向特异荧光定量引物IGF-Ⅰ, 并且以内参基因EF1α作为对照 (表 1)。
实时定量使用SYBR®PrimeScriptTMRT-PCR Kit (TaKaRa), 并按照说明书逐步进行。Real-time PCR反应体系包括0.2 μL 2.5 μmol/μL的引物, 1 μL逆转录产物, 2.5 μL 2×SYBR Premix ExTaq(TaKaRa),1.1 μL双蒸水。反应条件为: 95℃, 10s, 1个循环;95℃, 5s, 60℃, 20s, 40个循环。Real-time PCR反应以及信息收集都在LightCycler 480 System (Roche)上进行。所有PCR反应完成后进行溶解曲线分析确定PCR产物的特异性并得到每个基因的Ct值(荧光信号达到设定的阈值所经历的循环数)。目标基因转录本的相对表达量利用qRT (Roche)软件按照Livak等描述的方法进行计算[13]。为了保证实验结果的可靠性, 每个样品, 实验组和对照组的反应都进行了3次重复。
1.5 翘嘴鲌IGF-Ⅰ基因中微卫星的多态性检测及与生长性状的关联分析
采用“三引物PCR (Triplex PCR)”法对内含子中的6个微卫星位点在24尾翘嘴鲌中进行多态性检测, 引物用Primer6. 0 软件设计, 前3个位点上游引物的5′端加上Tail A碱基序列, 后3个位点上游引物的5′端加上Tail B碱基序列[14], 通用引物Tail A和Tail B 5′端分别采用FAM和HEX进行修饰。由于上游引物5′端加上了15 bp的通用引物接头, 因此扩增产物长度比原始序列长15 bp。具体引物序列见表 2,引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为20 μL: 2×PCR Solution 10 μL, 模板DNA(10 ng/μL) 1 μL, 通用引物Tail A (前3个位点)或Tail B (后3个位点)、上游和下游引物(10 μmol/L) 使用量分别为0.2、0.2和0.4 μL, 灭菌超纯水补足体系。PCR反应程序: 94℃预变性5min; 94℃变性30s;60℃退火90s, 72℃延伸30s, 共35个循环; 60℃延伸30min; 4℃保存。PCR产物送生工生物工程(上海)股份有限公司进行微卫星分型。采用POPGENE 1.3.1计算微卫星位点在群体内的等位基因频率、观察杂合度(Observed heterozygosity,Ho)、期望杂合度(Expected heterozygosity,He)和多态信息含量(Polymorphism information content,PIC)。运用SPSS 16.0的一般线性模型(General Linear Model,GLM)程序分析微卫星位点与体质量和体长的关系。
2 结果
2.1 IGF-Ⅰ基因的克隆、测序及鉴定
将PCR扩增的产物进行琼脂糖电泳, 选择条带清晰, 无杂带的产物进行测序。通过与已知序列进行比对, 依据重合片段的一致性可初步确定获得正确的目的片段。测序拼接获得全序列14567 bp。其碱基组成为: A+T占61. 78%, C+G占38. 22%。通过与GenBank中草鱼(KF199853) 和鲤鱼(AF465830)IGF-Ⅰ基因的DNA序列进行比对分析, 相似度分别为91%和81%, 由此可以认为所获得的序列为翘嘴鲌IGF-Ⅰ基因序列。将该序列提交GenBank数据库, 获得登录号MF170890。
分析表明翘嘴鲌IGF-Ⅰ基因包含4个内含子、5个外显子。预测的内含子均以GT开始, 以AG结束, 符合真核生物外显子与内含子之间的剪接规律。其中4个内含子大小分别为1170、9364、251和1746 bp, 5个外显子长度分别为298、160、182、36和1360 bp; mRNA序列长度为2036 bp, 5′-非翻译区(5′UTR)为250 bp, 3′-非翻译区(3′UTR)为1300 bp,开放阅读框 (ORF)为486 bp, 编码由161个氨基酸残基组成的蛋白质多肽。第一内含子中包含(GATG)5AATAT (ATAG)11微卫星; 第二内含子中包含(CT)8、(TTA)5、(AC)13、(TG)12和(ATT)5共5个微卫星序列(图 1)。

表 2 翘嘴鲌IGF-Ⅰ基因内含子中微卫星引物序列Tab. 2 Primers used for microsatellite amplification in the intron of the C. alburnus IGF-Ⅰ gene
2.2 IGF-Ⅰ基因外显子及其编码氨基酸序列的结构比较
将鲤科翘嘴鲌等5种鱼类的IGF-Ⅰ基因和另外3个科的3种鱼类进行比较发现, 其鲤科5种鱼编码区序列长度均为486 bp, 编码161个氨基酸组成的前体肽, 4个外显子中编码氨基酸碱基的长度完全相同。和另外3个科的差别主要集中在第三外显子,鰕虎鱼科、牙鲆科和锯盖鱼科第三外显子比鲤科鱼类多了69—75个碱基序列, 致使编码的氨基酸也有所增加。此外, 鰕虎鱼科的弹涂鱼(Boleophthalmus pectinirostris)在第二外显子处也与其他鱼均不一样(表 3)。
通过预测, 翘嘴鲌IGF-Ⅰ蛋白质相对分子质量为17.92 ku, 理论等电点(Isoelectric point, pI)为9.20,分子式: C766H1217N237O229S16。其中, 丝氨酸(Ser)含量最高, 为9.9%。带负电荷氨基酸残基(Asp+Glu)12个, 带正电荷氨基酸残基(Arg+Lys) 22个。脂肪族氨基酸指数为57.52。经过蛋白质序列分析, 翘嘴鲌IGF-Ⅰ基因氨基酸预测无跨膜结构。

图 1 翘嘴鲌IGF-Ⅰ基因示意图Fig. 1 Schematic diagram of the C. alburnus IGF-Ⅰgene
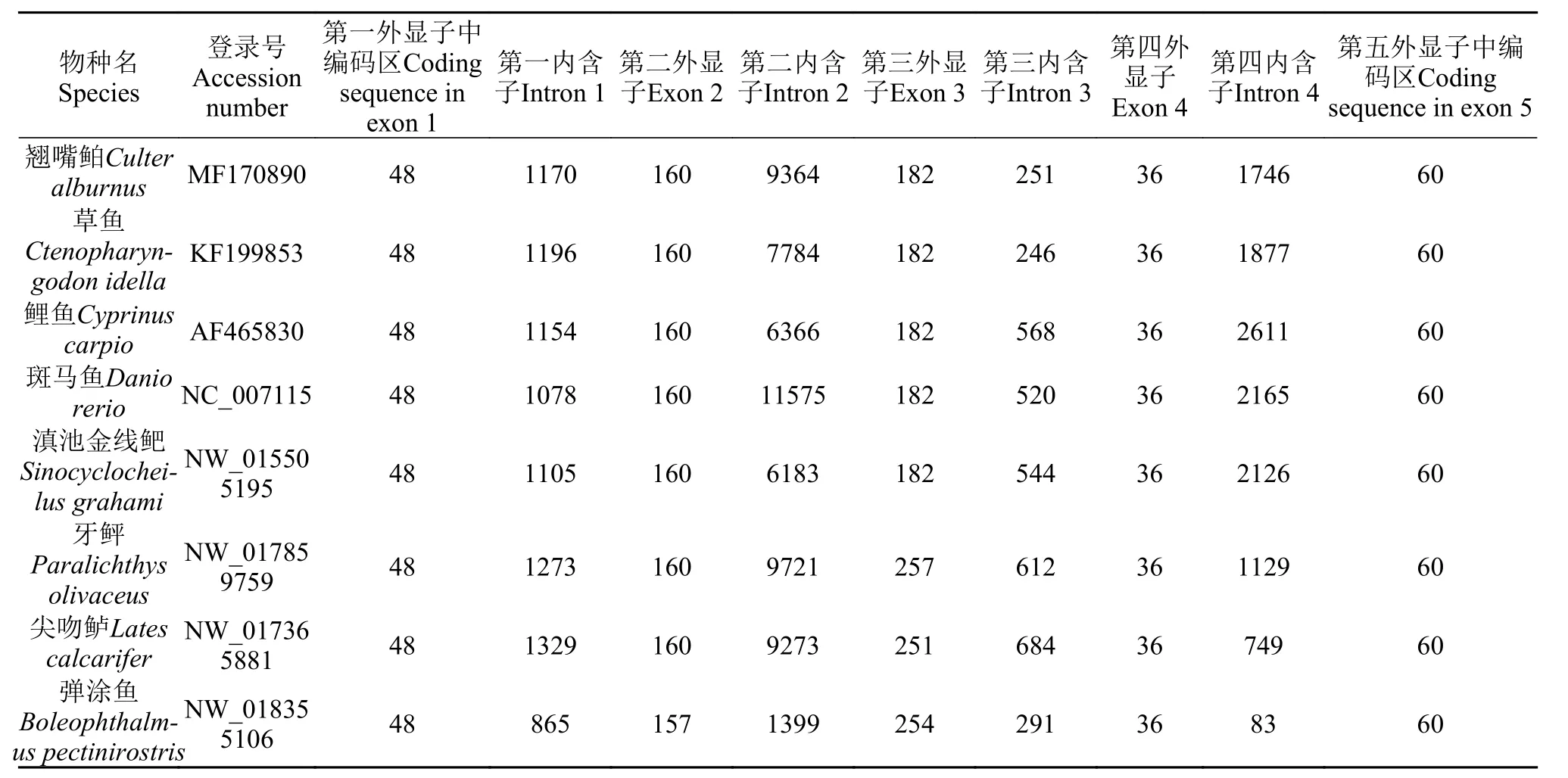
表 3 翘嘴鲌与其他鱼类IGF-Ⅰ基因外显子和内含子的比较Tab. 3 The comparison of the exon and intron of IGF-Ⅰ gene among C. alburnus and other fish species
通过NCBI经BLAST蛋白质相似性分析, 翘嘴鲌IGF-Ⅰ基因编码氨基酸序列与鲤科其他鱼类高度同源。翘嘴鲌氨基酸序列与鳡完全相同, 而与草鱼、团头鲂、鲢和鳙只有1—2个氨基酸残基的差异。翘嘴鲌IGF-Ⅰ前体肽由信号肽、成熟肽、E肽三部分组成。其中信号肽44个氨基酸, 成熟肽 70个氨基酸, E肽47个氨基酸; 成熟肽由B、C、A和D四个区域组成, 氨基酸个数分别为29、12、21和8。IGF-Ⅰ蛋白的各个结构域之间的相似性有较大的差异, 成熟肽中B结构域和A结构域的保守性最高,A结构域完全一致。翘嘴鲌成熟肽存在CysB6、CysB18、CysA6、CysA7、CysA11和CysA20六个半胱氨酸残基。其中B结构域与A结构域之间形成2个二硫键, 而A结构域的内部形成1个二硫键。在翘嘴鲌B区域也含有保守的IGF-Ⅰ受体识别序列(PheB23-TyrB24-PheB25残基)。C结构域和D结构域的保守性相对较差, 但C结构域在列举的5种鲤科鱼类(表 3)中完全一致。E肽的长度表明翘嘴鲌IGF-Ⅰ属Ea-2型[15]。
2.3 翘嘴鲌IGF-Ⅰ氨基酸序列和其他物种的比较分析
利用MEGA5. 0 等软件, 对本研究获得的翘嘴鲌IGF-Ⅰ氨基酸序列与GenBank数据库中获得的团头鲂、草鱼等共17 种鱼类IGF-Ⅰ氨基酸序列进行多序列比对。发现与翘嘴鲌IGF-Ⅰ相似度最高的为鳡(Elopichthys bambusa)的100%。与鳙(Hypoph-thalmichthys nobilis)和草鱼只有1个氨基酸的差别,与鲢(Hypophthalmichthys molitrix)和团头鲂有2个氨基酸的差别, 相似度为99%, 与露斯塔野鲮(Labeo rohita)相似度为94%, 与斑点叉尾鮰(Ictalurus punctatus)的相似度为80%, 与牙鲆(Paralichthys olivaceus)相似度为68%, 与红鳍东方鲀(Takifugu rubripes)相似度为 64%。在NJ系统进化树中(图 2), 翘嘴鲌等鲤科鱼类聚集在一起, 然后与鮰科的斑点叉尾鮰聚成一支。在亲缘关系较近的鲤科鱼类中, 翘嘴鲌并不是先与鲌亚科鱼类聚集在一起。用IGF-Ⅰ氨基酸序列在亲缘关系较近的鱼类中不能构建良好的系统进化树, 但在关系较远的鱼类中尚能阐明。
2.4 翘嘴鲌IGF-Ⅰ表达分析
以转录延伸因子基因(EF1α)作为内参基因, 采用实时荧光定量PCR检测翘嘴鲌不同组织中的IGF-Ⅰ基因表达情况。目标基因转录本的相对表达量利用qRT (Roche)软件按照Livak等描述的方法进行计算。结果表明,IGF-Ⅰ mRNA在所检测的翘嘴鲌组织中均有表达, 在肝中的转录水平最高, 脾次之。在心脏、精巢和脑中均有一定表达。在肾、鳃、卵巢和胃中的表达量较低(图 3)。
2.5 IGF-Ⅰ基因内含子的分析
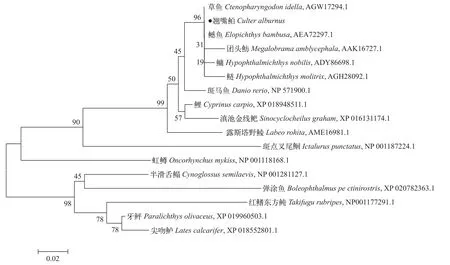
图 2 基于IGF-Ⅰ氨基酸序列构建的翘嘴鲌及其他鱼类系统发育树Fig. 2 Phylogenetic tree of C. alburnus and other fish based on IGF-Ⅰ amino acid sequences
现有的研究数据表明鱼类IGF-Ⅰ基因包含4个内含子, 5个外显子。相对于外显子,IGF-Ⅰ基因内含子存在相对较大的差异。这个差异首先体现在长度上面, 弹涂鱼第二和第四内含子长度分别为1399和83 bp, 远远低于翘嘴鲌的9364和1746 bp。弹涂鱼4个内含子通过Blast与翘嘴鲌比对相似的覆盖范围分别为1%、1%、0和0。在目前已公布的序列中, 草鱼与翘嘴鲌最为相似, 4个内含子通过Blast与翘嘴鲌比对相似的覆盖范围分别为100%、84%、100%和100%, 相似度分别为91%、90%、84%和92%。鲤科鱼类以外的3种鱼的内含子与翘嘴鲌亲缘关系非常低。在表 3列举的5种鲤科鱼类中, 第三内含子变异较大, 第一内含子变异较小。将在这5种鲤科鱼类中发现的微卫星序列进行比较, 有些侧翼较为保守, 可以跨物种扩增。有些经过进化整体切除, 或发生了碱基变异。在翘嘴鲌第一内含子中发现了微卫星(GATG)5AATAT (ATAG)11, 在草鱼和鲤中仍然能找到同源序列。第二内含子中的(CT)8在5种鲤科鱼类中均能找到同源序列, 该微卫星序列离第一外显子仅46 bp, 靠近第一外显子的侧翼序列相对保守, 另一侧变异较大(图 4)。这2个微卫星序列具有潜在的应用价值。第二内含子中(AC)13、(TG)12及其侧翼序列在其他鲤科鱼中未找到相似系列。(TTA)5经过变异, 失去了微卫星的特征, (ATT)5可找到相似的序列, 但重复次数均为5次, 不具备多态性。

图 3 翘嘴鲌IGF-Ⅰ基因在不同成体组织中的表达Fig. 3 The expression of IGF-Ⅰ in various adult tissues of C.alburnus
2.6 翘嘴鲌IGF-Ⅰ基因中微卫星的多态性检测及与生长性状的关联分析
在对6个微卫星位点在24个样本中进行初步检测时发现除了Cal-IGFⅠ-2和Cal-IGFⅠ-6外, 其余4个位点均为多态性。将这4个微卫星位点在120尾同塘养殖的翘嘴鲌中进行分析。位于第一内含子中的位点Cal-IGFⅠ-1检测到11个等位基因, 具有35种基因型。其中频率最高的4个等位基因203、207、215和227的百分比分别为29.2%、18.3%、17.5%和8.8%。第二内含子中靠近第一外显子的Cal-IGFⅠ-2仅发现了364和367 bp两种等位基因,其百分比分别为59.2%和31.7%。Cal-IGFⅠ-4中具有4个等位基因415、417、419和435, 其比例分别为30.4%、17.5%、26.2%和25.0%。Cal-IGFⅠ-5中检测到11种等位基因, 具有30种基因型。其中优势等位基因312、314、316和326 bp合计占等位基因的频率为80.8%。这4对引物观测杂合度(Ho)0.551—0.842 (平均0.704), 期望杂合度(He)0.456—0.832(平均0.707), 多态信息含量(PIC) 0.463—0.809(平均0.684), Cal-IGFⅠ-2位点多态信息含量(PIC)为0.463 (0.250<PIC<0.500), 属中度多态位点。其余3个微卫星位点PIC均大于0.5, 属于高度多态位点(表 4)。舍弃突变个体数低于样本量5%的基因型, 剩下的数据用于性状关联分析。4个微卫星位点与体长和体质量无显著关联(P>0.05) (表 5)。

图 4 翘嘴鲌IGF-Ⅰ基因第二内含子中微卫星(CT)8及侧翼与其他鲤科鱼类的比较Fig. 4 Comparison of sequence of (CT)8 microsatellite and flank region of IGF-Ⅰ gene in C. alburnus and other cyprinid fishes
3 讨论
目前, 已有很多物种的IGF-ⅠcDNA被扩增出来, 其编码的氨基酸序列揭示了IGF-Ⅰ在进化过程中的保守性。但这种保守性主要是针对编码区的,其内含子存在着较多变化。这种差异首先体现在内含子的数量和长度上, 在人(Homo sapiens)和鼠(Mus musculus)中,IGF-Ⅰ由6个外显子和5个内含子组成, 其长度超过80 kb[16, 17]。而鸡(Gallus gallus)的IGF-Ⅰ包含5个外显子和4个内含子, 长度约50 kb[18]。现有的数据表明, 鱼类大多由5个外显子和4个内含子组成, 其长度均在20 kb以下[19—21], 弹涂鱼的长度甚至只有3193 bp。在这4个内含子中, 第2内含子的长度最长。本实验通过草鱼和鲤的保守区域设计引物扩增了内含子2, 说明其在相近物种中还是具有一定的保守性。已有研究证实基因的内含子在基因的表达过程中发挥重要作用[6], 鱼类IGF-Ⅰ基因与生长性状的关联研究已见报道。Feng等[22]在采用4个SNP位点对于鲤进行研究时发现, 发现了2个生长性状相关的SNP标记, 它们均位于内含子2中。Tsai等[7]在针对大西洋鲑(Salmo salar) 3个SNP位点进行研究时发现其中2个与生长性状相关。阮瑞霞等[4]在对于吉富罗非鱼IGF-Ⅰ部分序列进行研究, 共找到3个SNPs位点, 其中2个位点与增重性状相关。
胡雪松等[1]对鲤中的2个微卫星位点进行了研究, 它们分别位于内含子1和内含子2中, 分别命名为intron1189(GATA)和intron2310(ATCT), 发现它们均对鲤的生长性能产生影响。这些研究结果表明IGF-Ⅰ基因中分子标记与生长性状显著关联的比例较高, 具有较大的应用价值。而且这2个微卫星标记在3个群体进行扩增后检测到的等位基因数分别为15和25, 具有较高的多态性。经过比对分析,发现在翘嘴鲌和草鱼中也有(GATA)微卫星序列。但在进化关系稍远的斑马鱼和滇池金线鲃中则产生了变异, 但可以看出变异的痕迹。翘嘴鲌中该位置对应的(GATG)5AATAT (ATAG)11也具备较高的多态性, 在120个样本中检测到11个等位基因, 具有35种基因型。(ATCT)微卫星在相关物种中则找不到近缘序列。在对翘嘴鲌的内含子进行分析时发现了1个CT微卫星, 目前仅发现了2个等位基因。其在所分析的5种鲤科鱼类中均能找到, 属于较保守的微卫星序列, 微卫星核心左侧距离编码氨基酸的外显子1仅46个碱基。推测其在鲌亚科鱼类中也能顺利扩增, 具有较大的潜在用途。处于翘嘴鲌内含子2中部的(AC)13和(TG)12则变异较大, 在所研究的5种鲤科鱼类中已找不到痕迹。但它们在本研究的翘嘴鲌群体中表现出较高的多态性(PIC>0.5)。对于120尾同塘养殖翘嘴鲌进行体长和体质量的测定及IGF-Ⅰ基因4个多态性微卫星位点的基因型检测后的关联分析表明,IGF-Ⅰ基因 4个微卫星位点与翘嘴鲌体长和体质量均无显著相关(P>0.05)。这与胡雪松等[1]的结果不同, 这可能是我们采用的样本量相对较少的原因。接下来我们将在扩大样本量的同时在不同群体中进行验证。

表 4 四个微卫星位点在120尾翘嘴鲌中的多态性信息Tab. 4 Polymorphism information for four microsatellite loci in 120 individuals of C. alburnus

表 5 翘嘴鲌IGF-Ⅰ基因中4个微卫星位点不同基因型与生长性状的关联分析Tab. 5 Association analysis between growth traits and different genotypes of 4 microsatellite locus in IGF-Ⅰ of C. alburnus
本文公布的翘嘴鲌IGF-Ⅰ碱基序列编码的IGF-Ⅰ前体蛋白也由信号肽、成熟肽和E肽三部分组成, 而成熟肽则由B、C、A、D四个结构域组成。B和A是相对保守的序列, 他们共包含6个极端保守的半胱氨酸(Cys)残基, 参与形成的二硫键对蛋白质的正常折叠、空间结构的维持及生理作用的发挥具有重要意义[23—25]。在成熟肽中, 翘嘴鲌与斑马鱼完全一致。与另外4种鲤科鱼类的差别都集中在D区。与鲤鱼的差别为D4, 与草鱼的差别为D7。因此我们推测IGF-Ⅰ基因的D区域属相对不稳定区。IGF-Ⅰ蛋白原中C末端的E区域保守性较差, 列举的5种鲤科鱼类和牙鲆、尖吻鲈和弹涂鱼相比多出26—27个氨基酸, 但也存在着保守的片段。列举的5种鲤科鱼类IGF-ⅠE区域 47 个氨基酸相互间都仅有 5 个氨基酸的差异。对于8 科17 种鱼类IGF-Ⅰ编码氨基酸序列进行对比分析, 发现鲤科鱼类的IGF-Ⅰ氨基酸序列同源性在94%—100%, 与其他不同科的鱼类序列同源性在64%—80%, 这表明同一科鱼类之间, 生长激素基因编码区序列具有相对较高的同源性, 不同科鱼类的生长激素基因序列的同源性明显下降。但在鲤科鱼类中, 与翘嘴鲌最相近的并不是鲌亚科中的团头鲂而是鳡, 这说明在亲缘关系较近的物种中, IGF-Ⅰ氨基酸系统进化树并不能很好地表明系统进化关系。
翘嘴鲌IGF-Ⅰ在肝脏组织中的表达量最高, 这与其他鱼类如荷那龙罗非鱼(Oreochromis hornorum)[26]、日本白鲫(Carassius cuvieri)[27]、哲罗鲑(Hucho taimen)[28]、银鲳(Pampus argenteus)[29]和花鲈(Lateolabrax japonicus)[10]等的研究结果一致。IGF-Ⅰ在肝脏中的表达量较高与肝脏是IGF-Ⅰ分泌的主要部位是一致的。不同的发育时期对于IGF-Ⅰ在肝脏中的表达水平也会造成影响。翘嘴
鲌成鱼精巢中也有较高的表达, 而且表达量要显著高于卵巢。荷那龙罗非鱼[26]中精巢和卵巢均有一定量的表达, 而且精巢高于卵巢, 但在精巢中的表达量没有那么高。在日本白鲫[27]中精巢和卵巢中的表达量最低, 卵巢中的表达情况略高于精巢。这可能与取样时机有关,IGF-Ⅰ对于性腺发育也具有调控作用。在翘嘴鲌肌肉和肾中的表达量较低, 但在银鲳[29]中仍然有一定量的表达, 另外Qian等[30]发现花鲈肌肉中表达量相对较高。不同物种在不同时期的各个组织中表达均不一致, 应该具体实验具体分析。

