急性冠脉综合征患者PCI术后CYP2C19和PON1 Q192R基因多态性与氯吡格雷抗血小板临床疗效和出血风险的相关性研究
徐晓宇,彭文星,井浣雨,林 阳(首都医科大学附属北京安贞医院药事部,北京 100029)
目前,药物洗脱支架(drug-eluting stent, DES)术后,为期12个月的双联抗血小板治疗(double antiplatelet therapy,DAPT)仍是预防术后血栓事件的发生,提高患者预后的基石。其中氯吡格雷仍有其不可替代的作用,然而很多患者服用氯吡格雷(75 mg·d-1)联合阿司匹林(100 mg·d-1)后存在血小板高反应(high on treatment platelet reactivity,HTPR),从而使患者容易发生缺血性脑卒中、支架内栓塞、再发心梗等主要心血管不良事件(major adverse cardiovascular events,MACE)[1-2]。
氯吡格雷是一种前体药物,其体内代谢过程需要经过多种酶的参与,其中编码这些酶的基因多态性是造成氯吡格雷治疗血小板高反应的一个重要因素。CYP2C19*2和*3等位基因是一种失功能(loss of function,LOF)等位基因,研究[3-6]已证实这两个位点发生基因突变会造成氯吡格雷相关HTPR,但目前研究多基于血小板聚集率(platelet aggregation rate,PAR)、血栓弹力图(thromboelastogram,TEG)或VerifyNow P2Y12检测等实验室检测结果来评价氯吡格雷疗效,甚少将临床事件作为氯吡格雷疗效的评价标准。此外,Marchini等[5]和 Cheng等[6]发现,对氧磷酶1(paraoxonase 1,PON1)可能同样是氯吡格雷活化过程中的关键酶,参与氯吡格雷的水解过程, 因此其编码基因PON1 Q192R的基因多态性也可能会影响氯吡格雷的生物活化过程,从而导致不良临床事件的发生。然而目前有关 PON1 Q192R基因多态性与氯吡格雷代谢的关系探讨只有一些小样本的研究,且总体结论并不一致[5-9]。基于上述原因,本研究将从实验室检查、临床MACE发生和出血三个方面来评价氯吡格雷的抗血小板疗效与其基因多态性之间的相关性。
1 研究方法
1.1 研究人群
收集2015年6月- 11月于北京安贞医院行药物洗脱支架植入术,同时进行CYP2C19和PON1 Q192R基因多态性检测的患者共计276例。根据研究纳入排除标准,最终共计245例患者纳入此次研究。
纳入标准:①明确诊断为急性冠脉综合征(acute coronary syndrome,ACS),包括急性非ST段抬高型心肌梗死、急性ST段抬高型心肌梗死和不稳定性心绞痛;②第一次行DES植入术;③入院后接受负荷剂量阿司匹林(300 mg)和氯吡格雷(300 mg)后,接受标准剂量阿司匹林100 mg·d-1和氯吡格雷75 mg·d-1标准双联抗血小板治疗。
排除标准:①入院诊断为稳定性心绞痛;②严重肾功能不全(肌酐清除率< 30 mL·min-1);③肝硬化;④胃和/或十二指肠溃疡;⑤血小板计数偏低(< 70×109·L-1);⑥合并使用替格瑞洛、双嘧达莫、西洛他唑、华法林和其他新型口服抗凝药(如达比加群酯、利伐沙班、阿哌沙班等);⑦随访前更改抗血小板治疗方案。
1.2 SNP(single nucleotide polymorphism,单核苷酸多态性)检测
用EDTA(乙二胺四乙酸)抗凝管采血2 ~ 3 mL,采用荧光染色原位杂交检测法。取150 μL血加入1 mL红细胞裂解液,静置5 min后,在3000 r·min-1条件下离心5 min,弃上清液,加入核酸纯化试剂(北京华夏时代基因科技发展有限公司),混匀后加入相应的测序反应通用试剂(北京华夏时代基因科技发展有限公司),采用双通道实时荧光定量PCR仪(TL988A,西安天隆科技有限公司)进行检测。
1.3 血小板聚集率检测
患者入院后接受负荷剂量阿司匹林和氯吡格雷后,连续服用标准维持剂量阿司匹林与氯吡格雷≥5 d,于晨起服药2.5 h后,采集肘静脉血,充分混匀。先将试管在4000 ~ 5000 r·min-1条件下离心5 min,获得富含血小板的血浆(platelet-rich plasma,PRP),随后将去除PRP后剩余的血样经22 500 r·min-1高度离心15 min获取贫血小板血浆(platelet-poor plasma,PPP)。将PPP和PRP混合,将血小板浓度稀释到2×105μmol·L-1,加入6 μmol·L-1的ADP诱导血小板聚集,之后测定经ADP诱导的血小板聚集率。
1.4 临床随访及观察终点
于患者出院后6 ~ 12个月期间,通过电话对患者进行随访。随访主要终点事件为MACE和出血事件。MACE主要包括顽固性心肌缺血(复发心绞痛)、心肌梗死、卒中和心血管相关死亡(所有死亡事件均被认定为心血管相关性死亡,除非有确切诊断为非心血管相关性死亡)。出血主要包括皮肤及黏膜出血、消化道出血、脑出血等。
1.5 研究方案
将CYP2C19*2和/或*3位点发生≥1个突变(CYP2C19*1/*2、*2/*2、*1/*3、*2/*3、*3/*3)的患者定义为CYP2C19突变型,该两个位点未发生突变的患者定义为野生型。分别比较两组患者服药5 d后ADP诱导的血小板聚集率,以及患者术后6个月后12个月前MACE和出血事件的发生概率。同样,比较PON1 Q192R位点突变型和野生型患者ADP诱导的血小板聚集率、MACE和出血事件的发生概率。
1.6 统计学方法
使用统计学数据处理软件SPSS 20.0进行统计学分析。计数资料采用(频数±标准差)来描述。组间比较,计数资料采用连续校正卡方检验,当超过25%的单元格的理论频数< 5时,使用Fisher精确概率法。对于符合正态分布的计量资料,采用独立样本t检验进行组间分析。检验标准为α= 0.05,P< 0.05为差异具有统计学意义。
2 研究结果
2.1 CYP2C19 LOF等位基因与氯吡格雷疗效及安全性的相关性
根据患者是否携带CYP2C19*2和/或*3突变基因,将患者分为CYP2C19野生型(n= 101)和突变型(n= 144)两组。首先对两组患者的临床基本信息进行比较,结果显示两组患者的年龄、性别、合并症以及合并用药等临床基本信息无显著性差异(P> 0.05),详见表1。
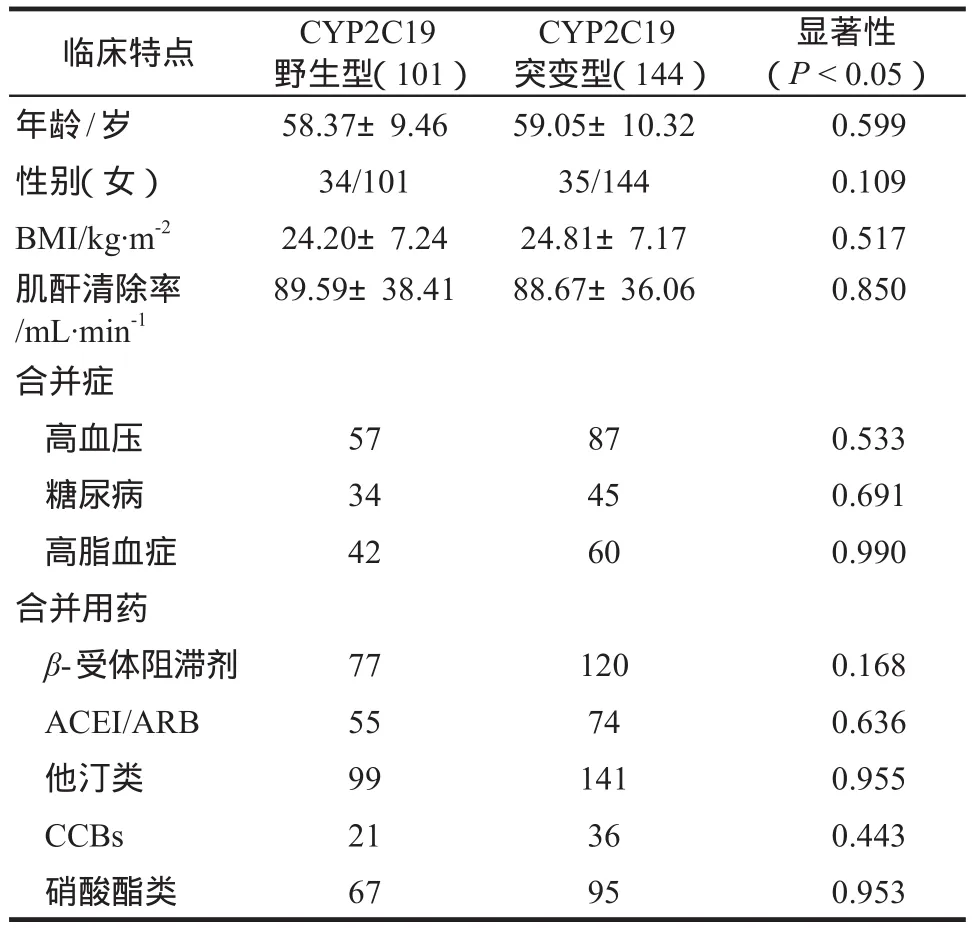
表1 CYP2C19不同基因型患者临床基本资料对比Tab 1 Comparison of baseline level between different CYP2C19 genetype in patients
随后,分别比较两组患者服用氯吡格雷5 d以后测得的经ADP诱导的血小板聚集率,以及MACE和出血事件的发生率,结果显示CYP2C19野生型组的患者经ADP诱导的血小板聚集率平均水平显著低于CYP2C19突变型患者[(36.99±15.40)%,(48.66±15.15)%,(P= 0.000)]。而CYP2C19突变型患者发生MACE事件的概率高于野生型患者,差异具有显著性(P= 0.003),携带CYP2C19*2或*3突变基因的患者发生MACE事件的概率是未携带者的2.022倍。但其出血事件的发生率低于野生型患者(P=0.009,OR = 0.406),详见表2。
2.2 PON1 Q192R基因多态性与氯吡格雷疗效及安全性的相关性
根据患者PON1 Q192R等位基因是否发生突变将患者分为PON1 Q192R野生型和突变型两组,分别对两组患者的临床基本资料进行比较,结果显示两组患者的年龄、性别、高血压、糖尿病等合并症无显著性差异(P> 0.05),但合并用药中,PON1 Q192R突变组的患者β-受体阻滞剂和钙离子拮抗剂(CCBs)的使用比例低于野生组,差异具有显著性(P< 0.05),详见表3。
随后,对不同PON1 Q192R基因型分组的患者进行氯吡格雷疗效及安全性的比较,结果未发现两组患者经ADP诱导的血小板聚集率存在明显差异(P=0.378),且MACE和出血事件的发生率上不存在显著性差异(P> 0.05),详见表4。
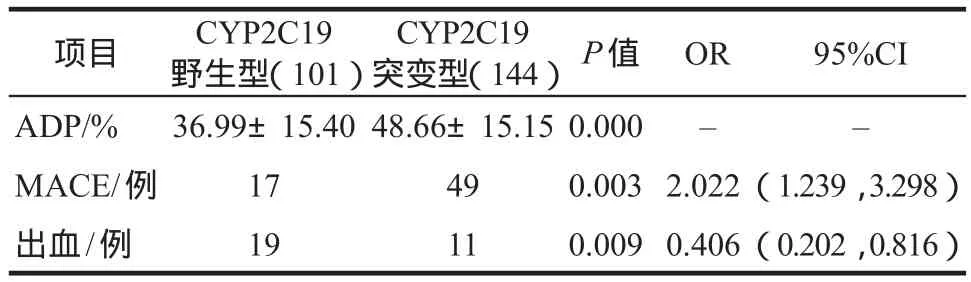
表2 不同CYP2C19基因型患者氯吡格雷抗血小板疗效及安全性的区别Tab 2 The efficacy and safety difference between different CYP2C19 genetype
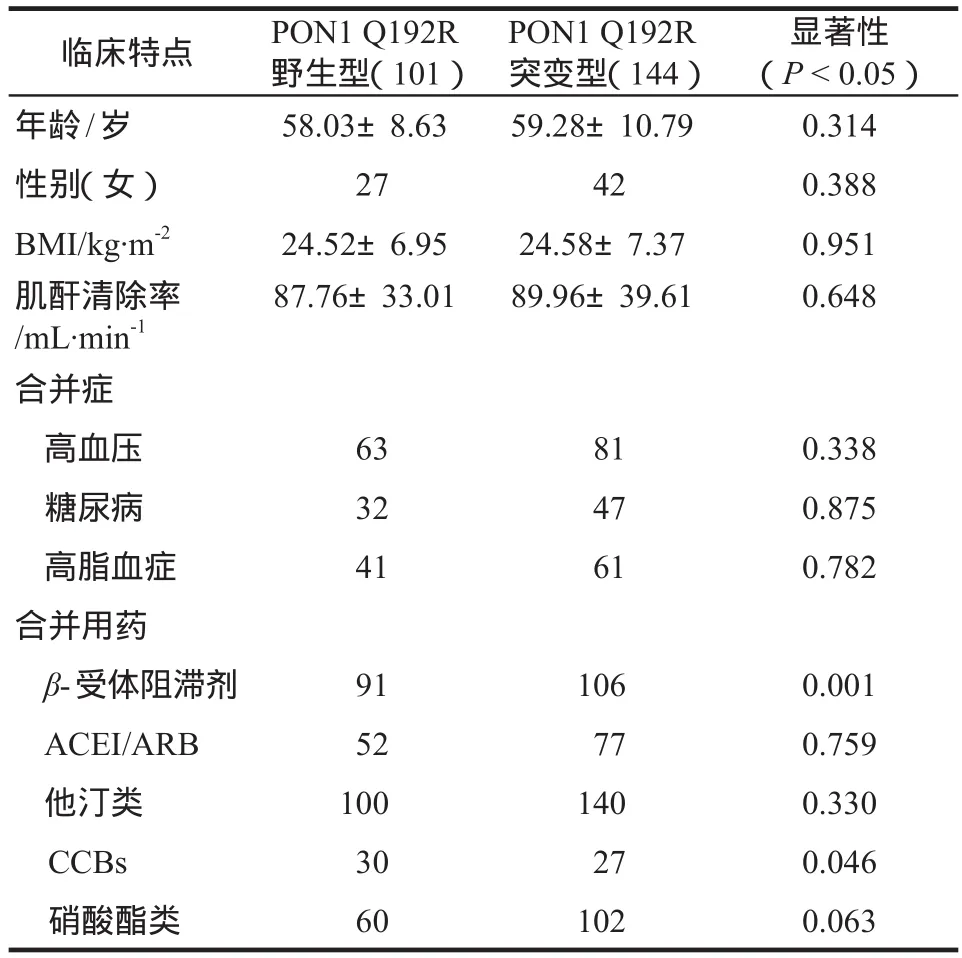
表3 不同PON1 Q192R基因型患者临床基本资料对比Tab 3 Comparison of baseline level between different PON1 Q192R genetype in patients
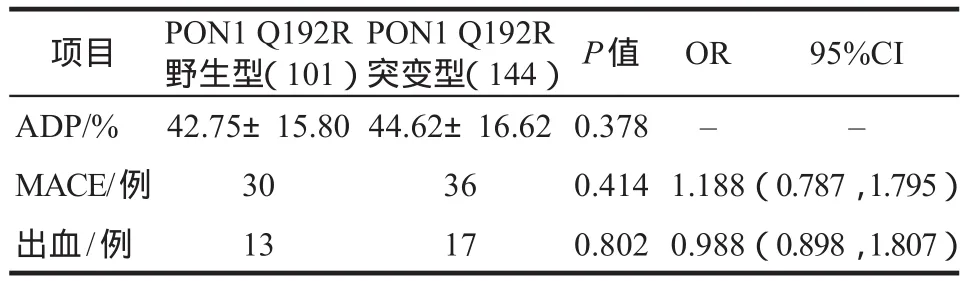
表4 不同PON1 Q192R基因型患者氯吡格雷疗效及安全性比较Tab 4 The efficacy and safety difference between different PON1 Q192R genetype
3 讨论
3.1 CYP2C19基因多态性与氯吡格雷疗效的相关性
既往研究[3,10-11]已证实,CYP2C19*2和*3等位基因发生突变的患者,会发生实验室水平的氯吡格雷治疗下的残余血小板高反应。本研究对携带CYP2C19*2和/或*3等位基因的患者以及未携带者进行比较,在临床基本情况无差别的条件下,携带*2和/或*3等位基因的患者,其实验室测得的经ADP诱导的血小板聚集率和MACE发生率明显高于未携带组,而出血事件的发生率则明显低于未携带组患者。但相对的,携带*2、*3失功能等位基因的患者,服用氯吡格雷后发生出血的危险性较未携带者降低。本研究结果与Guo等[12]和蔡泓敏等[13]的研究相一致,携带CYP2C19 LOF等位基因的患者接受血管介入治疗后,其远期预后(血管通畅率)较非携带者差。
3.2 PON1 Q192R基因多态性与氯吡格雷疗效的相关性
氯吡格雷体内的水解过程,即2-氧基-氯吡格雷水解为硫醇类活性产物,Cheng等[6]认为对氧磷酶1(PON1)是此代谢过程中的关键酶,PON1 Q192R基因多态性会通过影响PON1酶的活性影响氯吡格雷的抗血小板疗效,进而对冠心病患者PCI术后的远期缺血事件产生影响。但Reny等[8]的研究并不支持上述观点,他们在1524例PCI术后的患者中未发现PON1 Q192R基因多态性与患者服用氯吡格雷后的血小板抑制率存在显著的相关性(P= 0.56),且不同PON1 Q192R基因型患者间支架内血栓的发生率也无明显差别(P= 0.23)。本研究根据两组患者是否携带PON1 Q192R突变基因分组,发现两组患者的血小板聚集率均值无显著性差异,同时虽然突变组患者MACE发生率略高于未突变组,但两组相比无显著性差异,而且两组患者的合并用药中,未突变组患者CCBs和硝酸酯类药物的使用率明显高于突变组,因此PON1 Q192R基因多态性是否会造成患者服用氯吡格雷后抗血小板疗效的个体化差异尚无定论,仍需进一步大型前瞻性临床研究进行验证。
本研究非实时性登记收录,存在一定局限性。而患者的随访时间波动在术后6 ~ 12个月,时间波动范围较大,可能会对随访结果造成一定误差,其研究结果需要进一步大型前瞻性研究进行证实。同时该研究是单中心研究,患者群体具有一定的局限性,不能代表全部汉族人。

