TLR2、TSLP、IL-4、IFN-γ在特应性皮炎小鼠模型中的表达及意义*
张丽霞,王 倩,赵 蓓,卢 葳,段西凌
四川省医学科学院·四川省人民医院 皮肤性病研究所(成都 610072)
特应性皮炎(atopic dermatitis, AD)发病机制复杂,其中皮肤屏障功能障碍及多种致病微生物定植是AD患者发病及加重的重要因素。Toll样受体2(TLR2)可识别金黄色葡萄球菌的肽聚糖成分,通过作用于MyD88-NF-κB信号途径在引起天然免疫反应同时触发适应性免疫,诱发AD加重[1]。近年研究[2]表明,胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin ,TSLP)在启动Th2驱动的适应性免疫起总开关和主调节器的作用。本研究团队在前期的课题研究中也给与了证实[3]。有研究[4]称,在体外培养的人角膜上皮细胞中, 外源性致病原与上皮细胞的Toll样受体(toll like receptors ,TLR)结合后,可以诱导上皮细胞中TSLP的表达增加,进而促进趋化因子受体和各种黏附分子的表达增加。这一结果提示,上皮细胞分泌的TLR可通过TSLP的作用,在上皮细胞介导的固有免疫和适应性免疫间起中介作用。IL-4为TH2型细胞分泌,IFN-γ主要由TH1型细胞分泌,为常用的检查TH免疫失衡指标。因此,本研究拟通过检测TLR2、TSLP、IL-4和IFN-γ在AD小鼠模型中的表达,对TLR2、TSLP在AD免疫失衡发病机制中的关系进行初步探索。
1 材料与方法
1.1 实验动物与主要试剂及器材
将32只6~8周SPF级雌性纯系BALB/c小鼠(四川省人民医院实验动物中心),按照随机数字表法分为对照组和实验组,每组16只。2,4-二硝基氟苯(DNFB)(美国Sigma公司),小鼠IL-4、IFN-γELISA检测试剂盒(上海森雄科技实业有限公司),小鼠TSLP、TLR2 ELISA检测试剂盒(美国R&D公司)。兔抗鼠TSLP、TLR2多克隆抗体(美国Prosci公司),免疫组化染色试剂盒(SP-9001) (北京中杉金桥生物技术有限公司),DAB显色试剂、0.01M柠檬酸盐缓冲液、PBS缓冲液、多聚赖氨酸(福州迈新生物技术开发有限公司)。
1.2 方法
1.2.1 AD模型建立方法 参考张丽霞[3]、Wu G等[5]采用的2,4-二硝基氟苯接触致敏法建立AD小鼠模型。
1.2.2 血清TLR2、TSLP、IL-4、IFN-γ浓度检测 小鼠模型建立成功后,摘除右侧眼球取血,常温静置30 min后,以离心转速3 000 r/min,离心半径10 cm,高速离心15 min后,采用ELISA法测定血清TLR2、TSLP、IL-4、IFN-γ浓度。
1.2.3 组织学方法 取小鼠皮损组织,常规固定石蜡包埋、切片,进行免疫组化染色。光镜下,通过Image-proplus6.0软件分析TLR2、TSLP染色阳性细胞的平均灰度。同时做病理切片,观察组织病理改变,确认小鼠AD模型建模成功。
1.3 统计学方法

2 结果
2.1 小鼠致敏部位皮损及皮肤病理变化
实验组小鼠皮肤可见典型湿疹样改变:边界不清红斑、丘疹、点状结痂及苔藓样变等。实验组病理切片提示角化过度,程度不同棘层肥厚,细胞水肿,细胞间桥拉长,真皮浅层可见以淋巴细胞为主的慢性炎细胞浸润。实验组皮损及镜下病理表现均符合AD慢性期表现,提示AD小鼠动物模型建模成功。
2.2 小鼠AD动物模型皮损免疫组化结果
TLR2的阳性表达为棕黄色染色,主要位于细胞膜及胞浆,基底层及棘细胞层广泛表达。实验组平均光密度值(136.591±15.621)明显高于对照组(13.542±3.865)(图1), 差异有统计学意义(t= 4.551,P<0.05)。
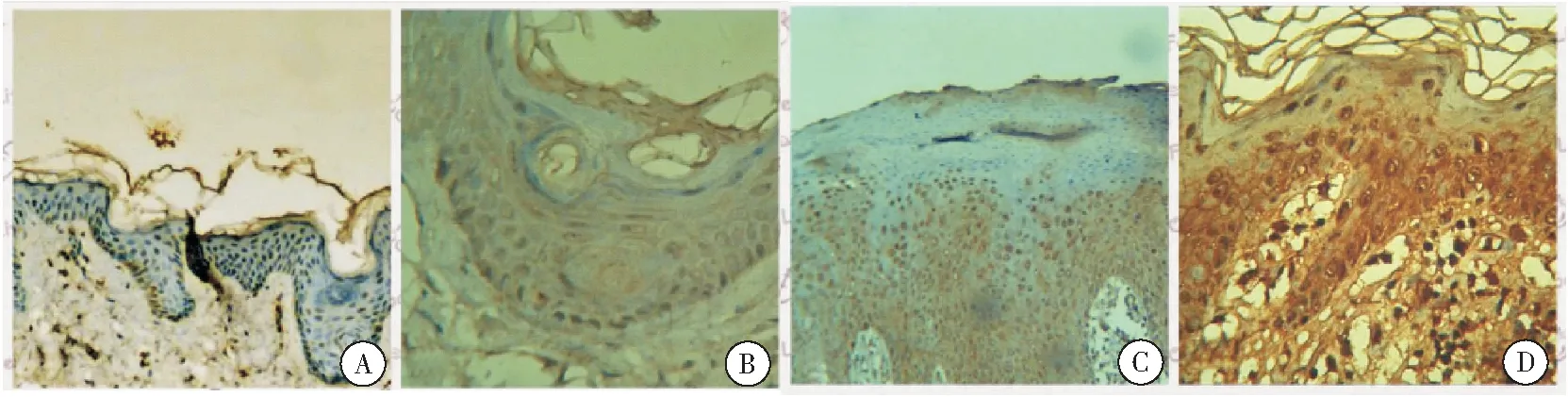
图1 TLR2在正常小鼠及AD模型组皮损处的免疫组化表达
注:图A,B为正常对照(A×100,B×400);图C,D为实验组(C×100,D×400);TLR2的阳性表达为棕黄色染色,主要位于细胞膜及胞浆
TSLP阳性表达也为棕黄色染色,主要位于胞核、胞浆及胞膜少量着色。实验组阳性表达明显高于对照组(图2)。实验组及对照组平均光密度值分别为(74.306±17.898)、(46.093±3.347),差异有统计学意义(t=15.213,P<0.05)。
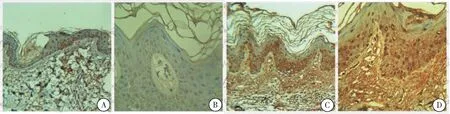
图2 TSLP在正常小鼠及AD模型组皮损处的的免疫组化表达
注:图A,B为正常对照(A×100,B×400);图C,D为实验组(C×100,D×400);TSLP阳性表达也为棕黄色染色,主要位于胞核、胞浆及胞膜少量着色
2.3 两组AD小鼠血清TLR2、TSLP、IL-4、IFN-γ表达水平比较
AD小鼠血清TLR2(142.896±11.934)、TSLP(213.621±34.666)、IL-4(97.831±15.882)、IFN-γ(70.999±9.604)的表达水平均明显高于对照组血清TLR2(14.302±3.548)、TSLP(151.997±22.328)、IL-4(60.560±9.286)、IFN-γ(51.224±4.534),差异均有统计学意义(P<0.05)(表1)。
表1 TLR2、TSLP、IL-4、IFN-γ在AD动物模型实验组和对照组血清的表达
2.4 实验组TLR2、TSLP、IL-4、IFN-γ血清表达水平的相关性分析
实验组小鼠血清中TLR2表达水平与TSLP、IL-4表达水平呈正相关(R=0.854,R=0.845,P=0.003);TSLP、IL-4表达水平呈正相关(R=0.997,P=0.005),而TSLP、TLR2均与IFN-γ表达水平呈负相关(R=-0.756,R=-0.570,P=0.002)(图3)。
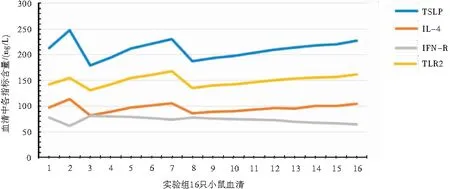
图3 实验组小鼠TLR2、TSLP、IL-4、IFN-γ血清表达水平相关性分析
3 讨论
AD是一种常见的复发性、瘙痒性、炎症性皮肤病,严重影响着患者的生活质量。AD发病机制复杂。其中皮肤屏障功能障碍伴发微生物定植是AD患者发病及加重的重要因素。TLR是识别微生物特别是细菌及其组分的识别受体之一,通过识别微生物病原相关分子模式(pathogen-associated molecular patterns,PAMPs),引起机体对于致病原的免疫应答。Forbes-Blom等[6]研究发现,小鼠皮肤角质形成细胞表面的TLR2能与金黄色葡萄球菌超抗原结合,增强其针对变应原初始暴露产生的Th2型免疫反应,并导致连续变应原暴露后诱导的Th2细胞数量明显增加。被激活后的TLRs通过细胞内的MyD88信号通路,增强炎症细胞的免疫应答作用,同时分泌各种细胞免疫因子,趋化中性粒细胞,巨噬细胞等免疫细胞向感染区域移动,杀灭致病微生物。TSLP就是上皮细胞产生的参与这种信号传导的细胞因子,并促进机体向TH2型适应性免疫分化[7-8]。
TSLP为IL-7的类似物。主要表达在人类的上皮细胞,皮肤角质形成细胞以及支气管平滑肌细胞,主要通过激活树突状细胞(dendritic cells,DC)发挥免疫效应。其主要通过3个途径发挥作用:1)TSLP通过上调效应靶细胞表面TLR及其相关配体,促进DC成熟,提高其抗原提呈能力以及致炎作用[9]。2)TSLP还可以诱导DC表达各种趋化黏附分子,促进DC向感染部位的黏附和归巢。3)TSLP还可以促进初始T细胞成熟,提高其转化为效应T细胞的转化率[10]。因此TSLP被誉为炎症反应的“总开关”。国外研究[11]表明,正常组小鼠上皮细胞TSLP不表达,而在过敏组TSLP表达较正常组明显增加。本研究团队在前期的课题研究[3]中发现,AD小鼠动物模型建立后TSLP在皮损及血清表达水平明显增高。TSLP、IL-4及IgE相关性分析发现,其间存在正相关性,相反TSLP与IFN-γ之间存在负相关性。其中IL-4为TH2型细胞分泌,IFN-γ主要由TH1型细胞分泌,初步证实TSLP参与了AD的进展、持续和慢性化发病机制。
研究[4]报道:在体外培养的人角膜上皮细胞中, 外源性致病原与上皮细胞的TLR结合后,可以诱导上皮细胞中TSLP的表达增加,进而促进趋化因子受体和各种黏附分子的表达增加。这一结果提示我们,上皮细胞分泌的TLR可以通过TSLP的作用,在上皮细胞介导的固有免疫和适应性免疫间起中介作用。
基于以上提示,我们用免疫组化方法及ELISA检测TLR2及TSLP在AD小鼠模型中的表达,结果显示TLR2的阳性表达物质主要位于细胞膜及胞浆,基底层及棘细胞层广泛表达,实验组表达水平明显高于对照组;TSLP阳性表达物质主要位于胞核,胞浆及胞膜少量着色。实验组着色密度明显高于对照组。血清中TLR2及TSLP水平均高于对照组,TLR2表达水平与TSLP呈正相关,且TLR2与IL-4、IFN-γ表达水平相关性与TSLP一致;提示TLR2有可能通过TSLP作用上调TH2型细胞分泌,下调TH1型细胞分泌,引起TH免疫失衡,诱发AD加重。
分析其可能的机理,受外界微生物刺激后,TLR2过度表达,外源性致病原与TLR2胞外段特异性识别,受体胞内段发生变构,从而激活Myd88通路蛋白,通过激活信号转导网络途径,最终激活NF-κB,继而使上皮细胞分泌TSLP增加, TSLP激活后促进DC的成熟诱导效应T细胞的趋化迁移,细胞炎症因子分泌增加,进而引起Th2免疫失衡,诱发致敏,从而在上皮细胞介导的固有免疫和适应性免疫间起中介作用。
综上所述, TLR2有可能通过识别与AD相关的外源性致敏原,诱导上皮细胞分泌TSLP,进而启动Th2的超敏反应。那么我们推测在临床症状控制后,其病理生理低水平维持时间内,TLR2及TSLP表达水平高低有可能决定Th1与Th2平衡是否再次被打破,继而诱发AD复发。因此,TSLP有可能成为预测停药后是否短期复发的有效指标,有待于今后研究进一步证实。

