LncRNA MEG3对口腔鳞状细胞癌细胞增殖、侵袭及凋亡的影响
熊 璟,何元春,罗海林,李 强,黄河浪,黄锦飞
汉中市中心医院 口腔科 (汉中 723000)
口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是人头颈部最常见的恶性肿瘤之一,在口腔癌中发病率最高,约占全部口腔恶性肿瘤的90%,易发生细胞侵袭和转移[1]。目前,手术联合放疗、化疗是治疗OSCC的主要手段,尽管在诊断和治疗方面取得了一定的进步,但患者生存质量差、5年生存率只有40%~50%[2-3]。因此,研究OSCC的发生、发展和侵袭转移的分子机制、寻找有效的治疗靶点对防治OSCC具有重要的临床意义。长链非编码RNAs(long noncoding RNAs, LncRNAs)是一类不编码蛋白质的RNA,主要参与转录激活、转录后调控和蛋白功能调节等生物过程[4]。LncRNA能通过表观遗传修饰、RNA降解和翻译后修饰等方式激活促癌基因或沉默抑癌基因,参与肿瘤的发生和转移等过程[5]。Tang等[6]实验证明OSCC及其配对的癌旁组织中,多种LncRNA差异表达;进一步研究发现,LncRNA MEG3在OSCC有较低的表达水平。但LncRNA MEG3对口腔鳞状细胞癌的生物学功能的影响报道较少。本研究旨在探讨LncRNA MEG3对口腔鳞状细胞癌细胞增殖、凋亡及侵袭能力的影响。
1 材料与方法
1.1 病理组织样本
选择2016年3月至2018年3月期间在汉中市中心医院确诊为口腔鳞状细胞癌的患者46例,其中男24例,女22例。纳入标准:所有OSCC患者均经手术后病理学检查确认病灶性质为鳞状细胞癌;无其他脏器严重疾病、无口腔疾病史;术前均未接受过放疗、化疗及免疫治疗;排除标准:伴有心、肝、脾、肺、肾等重要脏器损伤;治疗过程中死亡;未签署科研知情同意书患者。所有患者均在本院行“口腔鳞癌完整病灶切除术合并颈部淋巴结清扫术”,术后收集患者癌组织作为研究组和患者口腔粘膜组织作为对照组。所有患者均签署知情同意书,研究方案经伦理学委员会批准。
1.2 细胞与试剂
人口腔鳞状细胞癌Tca8113细胞系及人正常口腔黏膜细胞系HOK均购自上海中科院细胞资源中心;含有胎牛血清的RPMI 1640培养基、胰蛋白酶购自美国GIBCO 公司;RNA提取试剂盒、反转录试剂盒及Lipofectamine 2000购自美国Invitrogen公司;引物及抗体购自上海生物工程有限公司;细胞凋亡检测试剂盒购自碧云天生物技术有限公司;pcDNA3.1-载体购自上海艾博思生物科技有限公司。
1.3 方法
1.3.1 组织及细胞中LncRNA MEG3检测 将组织或细胞匀浆后,根据试剂盒操作步骤,采用Trizol法提取组织或细胞总RNA,并使用反转录试剂盒进行cDNA合成。以cDNA模板进行PCR扩增,所有引物为LncRNA MEG3上游5'-ATCATCCGT CCACCTCCTTGTCTTC-3',下游5'- GTATGAG CATAGCAAAGGTCAGGGC-3';内参β-actin上游5'-CTCCATCCTGGCCTCGCTGT-3',下游5'-GCTGTCACCTTCACCGTTCC-3'。采用荧光定量PCR仪Mx3006P进行定量检测。以β-actin为内参,以 2-△△Ct计算LncRNA MEG3的相对表达量。
1.3.2 细胞培养与细胞转染 人口腔鳞状细胞癌Tca8113细胞置于含有10%胎牛血清、100 IU/mL青霉素和100 mg/mL的RPMI1640培养基中,于37 ℃、5% CO2的恒温细胞培养箱中培养。在转染前1 d,将Tca8113细胞接种到6孔板上,待生长至80%时进行细胞转染。将Tca8113细胞随机分为3组,前两组使用脂质体Lipofectamine 2000分别转染过表达pcDNA3.1-MEG3的质粒(MEG3组)和空质粒pcDNA3.1-NC (NC组),转染浓度为300 nmol/孔;空白对照组(BLANK组)加入PBS。转染48 h后,qPCR检测3组LncRNA MEG3表达,方法参照1.3.1。
1.3.3 CCK-8法检测细胞增殖 细胞转染48 h后,收集各组细胞消化成单细胞悬液,以2×103/孔将细胞种植于96孔板上(每孔200 μL),分别于0、24、48、72 h时加入CCK-8溶液(每孔20 μL),继续培养1 h后,于450 nm处用酶标仪检测吸光度(OD)值。
1.3.4 流式细胞术检测细胞凋亡 细胞转染48 h后,收集各组细胞用磷酸盐缓冲液(PBS)洗涤2次后加入binding buffer (500 μL),再分别加入Annexin V-FITC和Propidium lodide各5 μL混匀,避光室温染色30 min,利用流式细胞仪检测细胞凋亡。
1.3.5 细胞侵袭实验 细胞培养至生长对数期后,重新悬浮于无血清培养基中,以每孔 1×104个细胞密度接种于Transwell 小室内,然后将小室移入6孔板内,在小室下层孔中添加含有10%胎牛血清的培养液1 mL,置入37 ℃、5%的CO2培养箱培养48 h,拭去上室表面细胞及Matirgel,使用甲醛固定,结晶紫染色。在显微镜下计数5个单独视野的染色细胞数,取平均值作为评价其侵袭能力的指标。
1.4 统计学方法

2 结果
2.1 LncRNA MEG3在OSCC组织和细胞系中的表达
qPCR检测结果显示,与正常口腔黏膜组织和HOK细胞组相比,OSCC组织和Tca8113细胞中LncRNA MEG3表达水平明显减少,差异具有统计学意义(P<0.05),提示OSCC组织和细胞中LncRNA MEG3低表达(图1)。
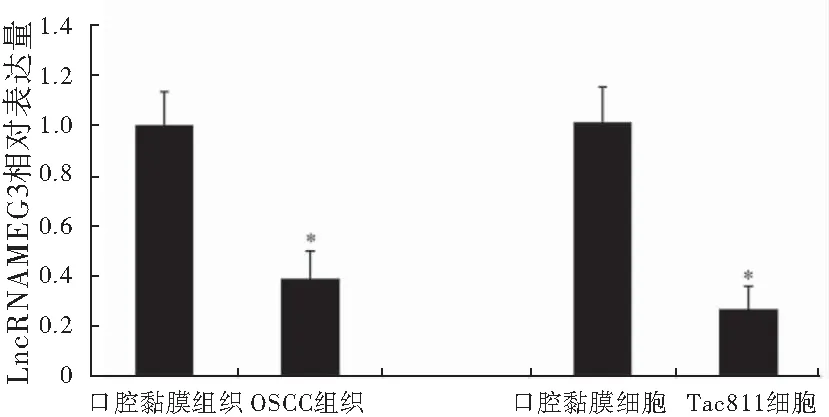
图1 LncRNA MEG3癌组织及Tca8113细胞中的表达情况注:与口腔黏膜组织/细胞组相比较,*P<0.05
2.2 LncRNA MEG3细胞转染效果
细胞转染48 h后,PCR检测LncRNA MEG3转染效果发现,过表达MEG3组LncRNA MEG3的表达水平明显高于NC组和BLANK组,差异具有统计学意义(P<0.05),说明转染成功(图2)。
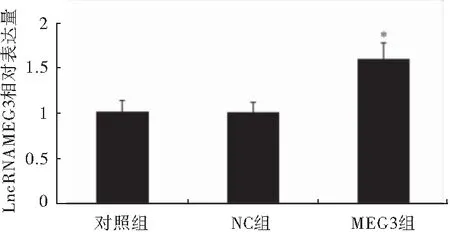
图2 转染后各组细胞LncRNA MEG3的表达注:与对照组/NC组相比较,*P<0.05
2.3 过表达LncRNA MEG3对细胞增殖的影响
CCK-8实验结果显示,细胞培养24、48 和72 h后,LncRNA MEG3过表达组OD值明显低于对照组和NC组,差异具有统计学意义(P<0.05),提示过表达LncRNA MEG3能够抑制癌细胞增殖(图3)。
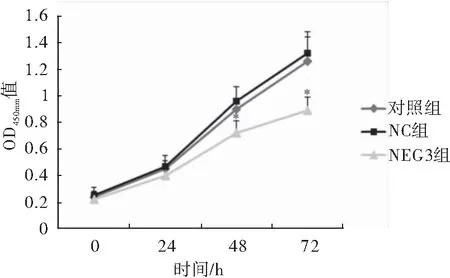
图3 过表达LncRNA MEG3对细胞增殖的影响注:与对照组/NC组相比较,*P<0.05
2.4 过表达LncRNA MEG3对细胞凋亡率的影响
流式细胞术检测结果显示,细胞培养48 h后,LncRNA MEG3过表达组细胞凋亡率明显高于对照组和NC组,差异具有统计学意义(P<0.05),提示过表达LncRNA MEG3能够促进癌细胞凋亡(图4)。

图4过表达LncRNAMEG3对细胞凋亡的影响
注:与对照组/NC组相比较,*P<0.05
2.5 过表达LncRNA MEG3对细胞侵袭的影响
细胞侵袭实验结果显示,细胞培养48 h后,LncRNA MEG3过表达组细胞数明显低于对照组和NC组,差异具有统计学意义(P<0.05),提示过表达LncRNA MEG3能够抑制癌细胞侵袭(图5)。
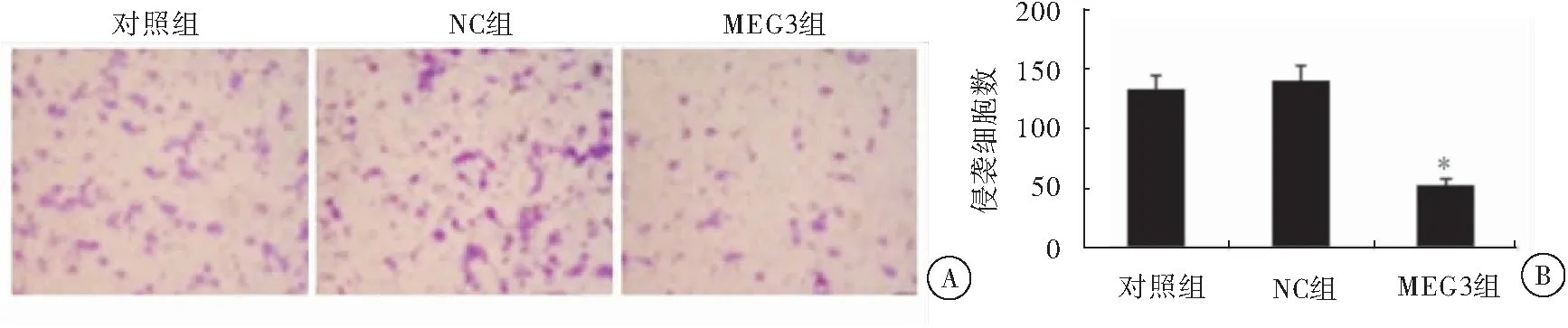
图5 过表达LncRNA MEG3对细胞侵袭能力的影响注:与对照组/NC组相比较,*P<0.05
3 讨论
LncRNA母细胞表达基因3(MEG3)位于人类染色体14q32.3位点,是一个全长约为1 700个核苷酸的母源性印记基因,同时也是第一个被发现具有肿瘤抑制作用的LncRNA[7]。LncRNA MEG3在许多正常组织中高表达,而在包括肺癌[8]、鼻咽癌[9]、卵巢癌[10]等多种肿瘤组织中低表达甚至不表达,且其表达异常和紊乱与肿瘤的发生发展及患者不良预后密切相关。MEG3启动子或基因间差异甲基化区域的超甲基化可能是导致肿瘤细胞中MEG3低表达或表达丢失的主要原因[11]。Jia等[12]研究发现,LncRNA MEG3在舌癌组织样本和SCC-15、CAL-27细胞系中表达减少。研究[6]表明,与正常的癌旁组织相比,LncRNA MEG3在口腔鳞状细胞癌组织中表达水平明显降低。本研究发现,口腔鳞状细胞癌组织及Tca8113细胞系中LncRNA MEG3的表达明显降低,提示LncRNA MEG3可能是OSCC的一个潜在独立的诊断标志。
肿瘤已经成为严重威胁人类生命健康的主要疾病之一,探索新的、更早期的诊断标记物和治疗靶点尤为重要。LncRNA是不编码蛋白质的RNA,具有调控细胞活动的功能,且功能越是复杂的真核生物,LncRNA在基因组中占比越高,人类基因组LncRNA的占比约为98.5%[13]。研究[14]证实LncRNAs在不同分期和组织学分级肿瘤中的表达存在差异,在肿瘤细胞的增殖、迁移、侵袭和凋亡等生物行为中扮演重要角色。研究[15]表明,LncRNA的表达水平与舌鳞癌患者的TNM分期、淋巴结转移状况密切相关,证实了LncRNA的异常表达与舌鳞癌的生物活性相关。在多种肿瘤细胞中过表达LncRNA MEG3能够抑制肿瘤细胞的发生发展。詹艳萍等[10]研究表明,LncRNA MEG3可通过负性调控激活SK-VO-3细胞自噬从而抑制卵巢上皮癌。刘珂等[16]的研究结果显示,过表达MEG3可抑制骨肉瘤细胞增殖和侵袭,促进凋亡。本研究选择口腔鳞状细胞癌Tca8113细胞系作为细胞模型,将重组的pcDNA3.1-MEG3转染Tca8113细胞,qRT-PCR检测发现转染pcDNA3.1-MEG3的OSCC细胞中MEG3表达增多,说明转染成功。然后通过CCK-8、流式细胞术和Transwell检测发现,过表达MEG3可明显抑制Tca8113细胞的增殖和侵袭,增加细胞凋亡率,但其具体机制尚未明确。研究[17]结果显示,MEG3可通过调控miRNA的表达水平参与肿瘤细胞的发生发展。另有研究[18]表明,MEG3可通过调控肿瘤相关信号通路影响肿瘤的进展,如Wnt/β-catenin、p53通路、DNA甲基化、pRb通路和Notch通路等。
综上所述,本研究证实了LncRNA MEG3在口腔鳞状细胞癌组织和细胞中表达降低,过表达LncRNA MEG3能够抑制口腔鳞状细胞癌细胞增殖、侵袭和凋亡,可作为OSCC治疗的潜在靶点,但LncRNA MEG3发挥作用的机制还有待深入研究。

