乳酸菌胞外多糖对结肠癌HT-29细胞增殖的影响
张将,蒋凌霜,孙梦莹,牟光庆,李新玲,钱方,*,妥彦峰,*
(1.大连工业大学食品学院,辽宁大连116034;2.新疆天润乳业股份有限公司,新疆乌鲁木齐830000)
结直肠癌(carcinoma of colon and rectum,CRC)属于恶性肿瘤的一种,是第三大常见癌症,约占所有新恶性疾病的9.5%,也是全球第四大癌症死亡原因,且由于老年人口的增加以及炎症性肠病(inflammatory bowel disease,IBD)等危险因素的流行和饮食习惯的改变,新病例的数量正在迅速增加[1-3]。乳酸杆菌属和双歧杆菌属的某些菌株是人体肠道内的共生菌株[4-5],能够维持宿主肠道的健康[6-7],在一定程度上还能抑制癌症的发生[8-10]。乳酸杆菌属微生物在自然界中分布广泛,大酱、馒头、酸奶、奶酪等食品的发酵过程均有乳酸杆菌属微生物的参与,人类食用乳酸杆菌属微生物的历史悠久。有体外实验研究发现Lactobacillus helveticus var.jugurti[11]、L.casei 01[12]作用于结肠癌细胞 HT-29可以抑制其增殖。Choi证实嗜酸乳杆菌606可溶性多糖具有抗癌活性,并诱导HT-29细胞凋亡[13]。也有动物实验研究发现从开菲尔菌株中得到的胞外多糖(exopolysaccharide,EPS)经小鼠口服后对肿瘤生长具有抑制作用[14],Bifidobacterium bifidum的EPS对大鼠荷肝肿瘤亦有明显抑瘤效果[15]。而且研究表明EPS在对癌症的辅助治疗上,具有安全性高、毒副作用小以及抑瘤效果好等优点[16-17]。Kim等的研究结果表明cb-EPS可能通过直接影响细胞形态而不是细胞周期来抑制结肠癌细胞增殖[18]。
本研究拟对大连工业大学大连市益生菌功能研究重点实验室保藏的植物乳杆菌所产胞外多糖进行研究,比较不同乳杆菌菌株所产胞外多糖对结肠癌细胞HT-29增殖的影响。
1 材料与方法
1.1 材料与试剂
发酵菌株为大连工业大学大连市益生菌功能研究重点实验室保存菌株,如表1所示;人结肠癌上皮细胞HT-29:中国科学院上海细胞库;多聚甲醛、甲醇、无水乙醇、苯酚:天津市大茂化学试剂厂;活性氧(reactive oxygen species,ROS) 测试盒、caspase 8 试剂盒、细胞凋亡试剂盒:南京建成生物工程研究所有限公司;多糖标准品试剂盒:GE Healthcare公司;TritonX-100、三氯乙酸:天津市光复精细化工研究所;30%过氧化氢、浓硫酸:天津市科密欧化学试剂有限公司;BCA蛋白浓度检测试剂盒、PBS磷酸盐缓冲溶液、胰酶消化液:北京Solarbio公司;改良型RPMI-1640培养基:美国Gibco公司。

表1 试验使用菌株Table 1 The strains of the experiment
1.2 主要仪器设备
KG-SX-500灭菌锅:上海精密实验设备有限公司;SW-CJ-2FD超净工作台:苏净集团苏州安泰空气技术有限公司;MCO-18AIC(UV)CO2培养箱:日本 SANYO公司;FQC生化培养箱:上海一恒科学仪器有限公司;S210-k精密pH计:梅特勒-托利多仪器有限公司;5804R冷冻离心机:德国Eppendorf公司;1510酶标仪:美国Thermo Fisher Scientific公司;5804R型冷冻离心机:Eppendorf中国有限公司;SC-3610型低速离心机:科大创新股份有限公司;CKX41倒置电子显微镜:OLYMPUS公司;L320生物光学显微镜:深圳市西派克光学仪器有限公司;Alpha 1-2真空冻干机:德国Marin Christ公司。
1.3 方法
1.3.1 乳酸菌胞外多糖粗糖的提取
1.3.1.1 菌株富集培养
试验所用菌株均为-80℃保存(大连工业大学大连市益生菌功能特性研究重点实验室提供)。冻存菌株37℃解冻,振荡均匀后,取0.1 mL接种于5 mL的MRS液体培养基中37℃培养18 h,连续传代2次后,于4℃保存待用。
1.3.1.2 乳酸菌胞外粗多糖的提取
乳酸菌胞外多糖的提取采用Li Zhang的方法[19],用冷冻离心机将扩大培养后的含乳酸菌胞外多糖的培养液在4℃、9 000×g条件下离心5 min,去除菌体沉淀保留上清液。用旋转蒸发仪将得到的上清液进行蒸发浓缩至原体积的1/5,加入100%浓度的液态三氯乙酸(trichloroacetic acid,TCA)至终浓度为 4 g/100 mL,在室温条件下磁力搅拌30 min。搅拌结束后将糖液用冷冻离心机在4℃、10 000×g条件下离心15 min,收集上清液,然后加入2倍~3倍体积的无水乙醇,4℃条件下静置24 h,使胞外多糖能够完全沉淀。醇沉结束后用冷冻离心机在4℃、1 000×g条件下离心20 min,弃去上清液,收集多糖沉淀,将得到的沉淀溶于适量的超纯水后,分装到透析袋中(8 kDa~14 kDa),在4℃层析柜中用超纯水透析3 d,每隔4 h换一次水以便去除小分子。透析结束后将糖液倒入平板中用冻干机冷冻干燥15 h得到胞外多糖粗糖样品,用保鲜膜封口保存在干燥器中。
1.3.2 乳酸菌胞外多糖粗糖的糖浓度及蛋白质含量的测定
乳酸菌胞外多糖的测定参照王文平[20]所描述的试验方法,采用苯酚-硫酸法测定样品糖浓度,将冻干后的乳酸菌样品溶于PBS溶液中(pH 7.2),吸取1 mL,加入1 mL 5%苯酚,5 mL浓硫酸后,振荡摇匀,静置5 min,沸水浴15 min,室温放置 20 min后,在波长490 nm处的吸光度值。以葡萄糖为标准品,以浓度为横坐标、OD490为纵坐标绘制标准曲线。
乳酸菌胞外多糖中蛋白质含量的测定使用考马斯亮蓝G-250方法来测定粗糖蛋白含量[21]。将冻干后的乳酸菌粗多糖样品溶于PBS溶液中(pH 7.4),吸取100 μL适当稀释的样品加入5 mL考马斯亮蓝G-250溶液,室温静置反应10 min,然后用酶标仪在595 nm波长下测吸光值(OD)。以牛血清白蛋白为标准品,以浓度为横坐标、OD595为纵坐标绘制标准曲线。
1.3.3 不同乳酸菌胞外多糖粗糖对HT-29增殖的影响
不同的乳酸菌胞外多糖对HT-29结肠癌细胞的影响采用Sun J等[22]的方法,将HT-29结肠癌细胞接种到96孔板中,接种细胞浓度为5×104个细胞/mL,接种量为每孔 200 μL,培养 24 h(5%CO2,37 ℃)后,用pH7.4的PBS迅速清洗2次,将不同乳酸菌(LGG、3、4、9、12、13、14、24、27、31、32、37、44、49、50) 的胞外多糖粗糖溶解在无胎牛血清RPMI1640细胞培养基,在培养基中加入不同的胞外多糖粗糖,使其终浓度分别为250 μg/mL,以无胎牛血清为RPMI1640空白对照组。培养48 h后,吸出孔内所有液体,用pH7.4的PBS迅速清洗2次,每孔加入100 μL细胞培养液和20 μL 3-(4,5-二甲基吡啶-2-基)-5-(3-羧基甲氧基苯基)-2-(4-磺苯基)-2H-四唑 [3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2H-tetrazolium,MTS]试剂(提前解冻),继续在 37℃,5%CO2培养箱中培养4 h,用酶标仪测量在490 nm处的吸光度并计算抑制率。
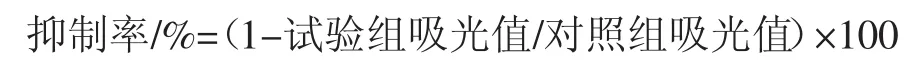
1.3.4 胞外多糖粗糖的分离纯化
采用Chu-Ting L等的方法粗多糖首先用DEAESepharose Fast Flow离子柱进行分离和纯化。称取0.1 g冻干的多糖溶于10 mL超纯水中,用0.22 μm滤膜过滤后用Tris-HCl缓冲液溶解上样。第一步洗脱用Tris-HCl缓冲液(约2 h),第二步梯度洗脱同时使用Tris-HCl与1.0 mol/L NaCl(约2 h)。每管收集量为5 mL;流速为2 mL/min。经过DEAE-Sepharose Fast Flow离子柱分离纯化后的多糖采用Sepharose CL-6B凝胶柱纯化,上样浓度为10 mg/mL,上样量2 mL,用0.22 μm滤膜过滤后用含0.15 mol/L NaCl的Tris-HCl缓冲液溶解。每管收集5 mL;流速为0.4 mL/min。将分离得到的样品经8 kDa~14 kDa透析袋透析、冷冻干燥得到多糖样品。采用苯酚硫酸法测定分离纯化后的多糖组分中多糖含量。采用MTS方法测定分离纯化后的多糖组分对HT-29细胞增殖的影响。
1.3.5 活性氧(reactive oxygen species,ROS)的测定
活性氧的测定采用Ashwaq A S等[23]的方法,将HT-29结肠癌细胞接种到黑色96孔板中,接种细胞浓度为 5×104个细胞/mL,接种量为每孔 200 μL,培养24 h(5%CO2,37 ℃)后,用 pH7.4的 PBS 迅速清洗 2次,加入无胎牛血清的RPMI1640培养基,设置1个空白对照组、1个阳性对照组和8个阴性对照组,将筛选出来的乳酸菌胞外多糖按照最终浓度为50、100、250、500 μg/mL溶解在RPMI1640培养基中后加入细胞,培养44 h后阳性对照组加入对照物Rosup(Rosup为活性氧阳性诱导药物,根据其荧光信号强度可以分析活性氧的真实水平)100 μL。细胞在培养48 h时,吸出所有多糖液及培养液,每孔加入100 μL 稀释好的 2′,7′-二氯荧光黄双乙酸盐(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)(按照 1∶1 000 用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L)。在37℃避光孵育30 min后,用荧光酶标仪(激发波长485 nm,发射波长525 nm)测其吸光度。根据所测吸光度值可以知道细胞内的ROS水平。
1.3.6 Tunel法检测HT-29细胞凋亡
本试验选用Tunel凋亡原位检测试剂盒(南京建成生物研究所)检测L.plantarum 12 EPS对HT-29细胞凋亡的影响。将HT-29结肠癌细胞接种到孔板中的爬片上,接种细胞浓度为1×104个细胞/孔,接种量为每孔 2 mL,培养 24 h(5%CO2,37 ℃)后,将加入乳酸菌胞外多糖用RPMI1640培养液稀释到50、100、250、500 μg/mL加入6孔板中培养48 h,培养结束后从孔板中取出细胞爬片,在超净工作台中吹风晾干,再于固定液中室温固定1 h、封闭液中封闭10 min、浸入通透液渗透2 min、标记和显色,最后光学显微镜下分别观察5个视野,每个视野计数100个细胞,确定其中发生凋亡的细胞个数,进行数据分析。
凋亡率/%=[紫色细胞总数/(紫色和绿色细胞总数)]×100
1.3.7 caspase 8活性检测
本试验选用caspase 8活性检测试剂盒(南京建成生物研究所)测定细胞凋亡,按试剂盒说明书进行操作。接种细胞浓度为2×105个细胞/孔,接种量为每孔2 mL,培养 24 h(5%CO2,37 ℃)后,将加入 12 号乳酸菌胞外多糖用RPMI1640培养液稀释到50、100、250、500 μg/mL加入6孔板中培养48 h,培养结束后,用胰蛋白酶消化细胞并收集,用pH7.4的PBS迅速清洗保留沉淀,然后按说明书要求加入适量裂解液,震荡混匀后冰浴裂解30 min,其间涡流震荡3次(10 s/次),然后离心(4℃,10 000×g,20 min),取上清液于冰上备用,之后用BCA蛋白浓度检测试剂盒测定蛋白浓度,并立即测定caspase 8的酶活。
按表2所示顺序添加试剂摇匀,避免产生气泡,然后于37℃孵育过夜,用酶标仪于405 nm处测吸光度,最后通过计算OD诱导剂/OD阴性对照的倍数来确定诱导凋亡组caspase 8的活化程度。

表2 Caspase 8反应体系表Table 2 The table of caspase 8 reaction system
1.4 统计分析
试验中所有试验至少重复3次,方差分析及差异显著性分析(p<0.05)采用SPSS20.0统计分析软件进行分析,图表采用OriginPro 8.5进行绘制。
2 结果与讨论
2.1 乳杆菌所产胞外多糖成分分析
根据苯酚-硫酸法测得梯度葡萄糖溶液的标准曲线回归方程为 y=3.791 1x+0.070 7(R2=0.992 4),根据此方程计算得到15株植物乳杆菌胞外多糖粗糖的总糖含量。
按照考马斯亮蓝G-250方法测得标准蛋白溶液的蛋白含量标曲的回归方程为y=0.068 8x-0.021 7(R2=0.994 1),根据此方程计算得到15株植物乳杆菌胞外多糖中蛋白质的含量。不同菌株EPS的多糖及蛋白浓度以及对HT-29抑制率如表3。
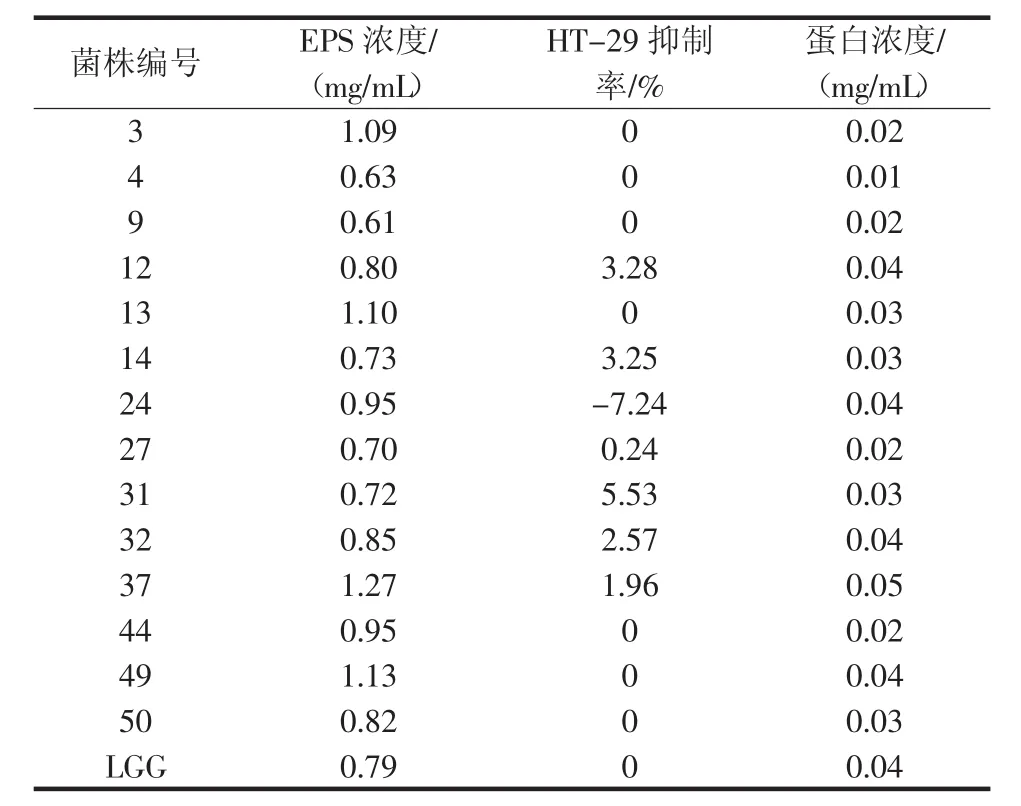
表3 不同菌株EPS的多糖及蛋白浓度以及对HT-29抑制率Table 3 The polysaccharide,protein concentrations and antiprolierave on HT-29 cells of EPS from different strains
L.plantarum 3号、L.plantarum 12号 L.plantarum 13 号 、L.plantarum 14 号、L.plantarum 24 号、L.plantarum32号、L.plantarum 37号L.plantarum 44号、L.plantarum49号、L.plantarum 50号乳酸菌的胞外多糖产量均较高。采用MTS法研究15种乳酸菌EPS在浓度为250 μg/mL时,对HT-29细胞增殖的影响,表3试验结果表明,L.plantarum 12号、L.plantarum 14号、L.plantarum 27号、L.plantarum 31号、L.plantarum 32号、L.plantarum 37号乳酸菌胞外多糖均对HT-29细胞有抑制作用。结合胞外多糖含量以及对HT-29细胞增殖抑结果,选择L.plantarum 12,L.plantarum 14,L.plantarum 32和L.plantarum 37进行后续试验。
2.2 4株菌胞外多糖对HT-29细胞增殖的影响
L.plantarum 12,L.plantarum 14,L.plantarum 32 和L.plantarum 37 4 株菌胞外多糖按照 50、100、250、500 μg/mL作用 HT-29细胞结果如图 1所示,L.plantarum12 EPS 在 50、100、250 μg/mL 对 HT-29 细胞增殖的抑制效果高于L.plantarum 14、L.plantarum 32和L.plantarum 37三株菌EPS抑制效果,且在250 μg/mL时达到了最高抑制率27.58%。所以选用L.plantarum 12为后续试验用菌,并且在后续试验中将对L.plantarum 12的EPS对HT-29细胞增殖抑制的机理做更深入的研究。

图1 4种乳酸菌EPS对HT-29细胞增殖的影响Fig.1 The effects of 4 kind of EPS on the proliferation of HT-29 cells
2.3 L.plantarum 12粗多糖的分离纯化
2.3.1 L.plantarum 12粗多糖DEAE-Sepharose Fast Flow离子柱纯化
胞外多糖在提取阶段经过三氯乙酸(trichloroacetic acid,TCA)去除蛋白、无水乙醇沉淀多糖以及透析可以除去大部分的杂质,然而多糖本身是由多种组分组成,而且含有少量的糖以外的物质,所以需要进一步对其进行分离纯化,来获得单一的组分。离子交换层析的原理是,被分离组分带有不同的电荷,以不同的结合力与离子交换剂结合,当洗脱液离子强度不同时才能将其洗脱出来。DEAE-Sepharose Fast Flow是一种阴离子交换剂,凝胶的颗粒比较大,可以进行较大流速洗脱,常用于粗多糖的分离纯化。L.plantarum 12DEAESepharose Fast Flow离子交换柱层析结果见图2。

图2 L.plantarum 12 DEAE-Sepharose Fast Flow离子交换柱层析Fig.2 DEAE-Sepharose Fast Flow·ion exchange column chromatograpHy of L.plantarum 12
经过DEAE-Sepharose Fast Flow离子交换柱分离,12号粗多糖洗脱出来两个组分,即EPS12-1、EPS12-2(如图2),透析、冻干后称重,分别为分离前粗多糖质量的37.7%和11.4%。由此可见,直接由Tris-HCl洗脱液洗脱出来的组分EPS12-1是中性多糖,而EPS12-2是由含NaCl的洗脱液梯度洗脱出来的,说明该组分是带负电荷的酸性多糖,或者是带有酸性基团的糖复合物。
2.3.2 L.plantarum 12粗多糖的Sepharose CL-6B凝胶柱分离纯化
离子交换柱只能分离出带电荷相同的组分,然而带电量相同而分子量不同的组分不能得到完全的分离,需要经过体积排阻色谱层析对其进行纯化。分子大小不同,洗脱体积也不同,从而能够分离出不同分子量的单一组分。需要通过凝胶柱进一步纯化。组分EPS12-1和EPS12-2分别经过Sepharose CL-6B凝胶柱后的洗脱曲线如图3、图4所示。
从图3、图4中可以看出,纯化后两种组分的洗脱曲线都是比较对称的单一峰,表明这两种EPS12组分为分子量大小均一的单一组分。收集出峰管中的液体,经过48 h透析后,即为纯化后的EPS12-1和EPS12-2。
2.3.3 分离纯化后单一组分对HT-29细胞增殖的影响
分离纯化后的两种多糖含量分别为31.82%和35.21%。在将分离纯化后的两种多糖分别以不同浓度作用于HT-29细胞后,通过MTS法测定细胞增殖情况,结果如图5所示。

图3 EPS12-1 Sepharose CL-6B凝胶柱层析Fig.3 Sepharose CL-6B gel column chromatography of EPS 12-1

图4 EPS12-2 Sepharose CL-6B凝胶柱层析Fig.4 Sepharose CL-6B gel column chromatography of EPS12-2

图5 不同浓度的EPS 12-1和EPS 12-2对HT-29细胞增殖的影响Fig.5 Effects of different concentrations of EPS 12-1 and EPS 12-2 on the proliferation of HT-29 cells
由图5可知,分离纯化后的EPS12-1和EPS12-2对细胞增殖同样在250 μg/mL时达到最高分别为7.11%和12.0%(p<0.05),而且两种EPS的作用浓度为 50 μg/mL~250 μg/mL 时,抑制 HT-29 细胞增殖效果随着浓度的增加而显著增加(p<0.05),在EPS浓度为500 μg/mL时有所下降但是不显著,且单一组分对HT-29细胞抑制效果低于粗多糖,因此采用粗多糖进行后续研究。
Asker等[24]研究表明从瑞土乳杆菌分离出来的EPS分子量越小抗氧化能力越强,是因为低分子量的多糖比较容易结合自由基的缘故。刘宇等[25]报道从酸奶发酵剂L.delbrueckii ssp.bulgaricus OLL 1073R-1分离得到的含β-1,6糖苷键较少的酸性多糖能够有效的促进小鼠淋巴细胞的增殖,具有调节宿主抗肿瘤活性的作用。Bleau等[26]对L.rhamnosus ATCC 9595所产的EPS结构与免疫功能之间的关系进行研究,最终发现高分子量、具有一定空间构型的EPS具有显著免疫调节功能,通过水解破坏其结构会导致IL-6的减少以及淋巴细胞活动减弱。
2.4 L.plantarum 12胞外多糖对HT-29细胞内ROS水平的影响
细胞受到外界刺激时,会产生大量高活性分子如活性氧自由基(ROS),导致细胞自身抗氧化能力不够或氧化系统失衡,从而引起细胞的损伤甚至凋亡。因此通过测定细胞内活性氧水平可以大致判断细胞的状态。L.plantarum 12胞外多糖对HT-29细胞内ROS水平的影响如图6所示。
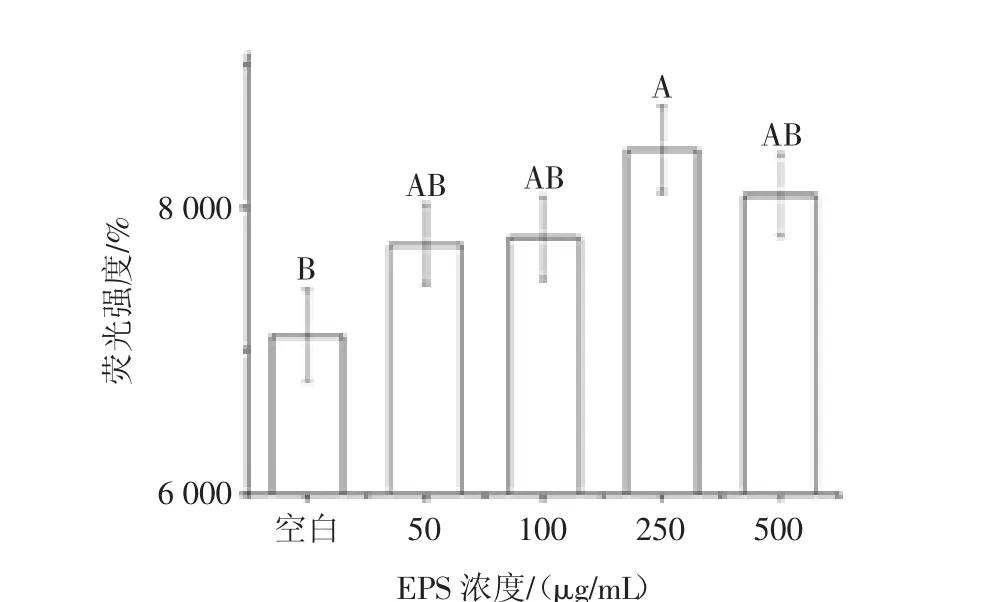
图6 不同浓度EPS12诱导HT-29细胞内ROS的产生Fig.6 The different concentrations of EPS12 in HT29-treated cells induced ROS generation
由图6可知,L.plantarum 12多糖的4个浓度处理的HT-29细胞内的活性氧强度依次为对照组的108.99%、109.56%、118.33%、113.83%。活性氧强度越高,说明细胞正处于某个凋亡状态,因此可以判断乳酸菌的胞外多糖抑制结肠癌细胞HT-29增殖的机理是诱导细胞凋亡。同时,试验结果表明,250 μg/mL是多糖诱导凋亡的最佳浓度,这与之前测得的多糖对HT-29细胞的抑制率趋势一致。ROS是正常细胞代谢的组成部分,并且是增殖,信号转导和凋亡等细胞内过程所必需的。当细胞内ROS水平升高后,细胞内原本平衡的氧化还原状态被破坏,当ROS量达到一定值,超过其自身的清除能力后,就会导致细胞凋亡。张艳生等[27]研究发现5,7-二甲氧基黄酮可以通过促进HT-29细胞产生ROS,而使得细胞发生凋亡。Hu P等[28]揭示活性副干酪乳杆菌M5L通过ROS产生诱导HT-29细胞凋亡。
2.5 L.plantarum12胞外多糖对HT-29细胞凋亡的影响
细胞发生凋亡会在胞质内形成许多有完整膜结构的“凋亡小体”,激活细胞内的核酸内切酶,该酶可把DNA切割成180 bp~200 bp的片断,通过标记在缺口处的荧光素以及甲基绿的染色反应可以在光学显微镜下观察到细胞凋亡:凋亡细胞呈紫色,正常细胞因无断裂DNA而呈绿色。
不同浓度12号多糖处理后的HT-29细胞用Tunel法染色后在光学显微镜下观察的结果如图7所示。
Tunel法测定L.plantarum 12胞外多糖作用HT-29细胞后其细胞凋亡率如图8所示。

图7 Tunel法测定不同浓度12号多糖处理的HT-29细胞Fig.7 Effects of different concentrations of EPS12 on HT-29 cells with Tunel method
图8 不同浓度EPS12诱导HT-29细胞的凋亡率Fig.8 Induction of apoptosis of HT-29 cells by EPS12 at different concentrations
由图7可知,在光学显微镜下肉眼观察到,随着多糖浓度(50 μg/mL~250 μg/mL)升高,视野内的紫色细胞数目所占的比例增加。由图7、图8可知,在250μg/mL浓度时达到最大值,而到500 μg/mL时又有所下降。紫色细胞数目越多,代表断裂的DNA越多,及凋亡细胞越多。此试验进一步表明L.plantarum 12多糖抑制HT-29结肠癌细胞增殖的原理是诱导细胞凋亡。
2.6 L.plantarum 12胞外多糖对HT-29细胞内caspase 8酶活的影响
不同浓度EPS对HT-29细胞内caspase 8活性的影响见表4。
L.plantarum 12 EPS作用后HT-29细胞内caspase 8 的活化倍数(如表 4)分别为 1.02、1.08、1.10、1.04,当EPS 作用浓度在 50 μg/mL~250 μg/mL 时,caspase 8 的活化程度提度以及活化倍数提高随着EPS浓度的升高而增加,在L.plantarum 12 EPS浓度为250 μg/mL时,caspase 8的活化程度显著高于其它三个浓度的活化程度(p<0.005),证明此浓度下细胞凋亡最强烈。

表4 不同浓度EPS对HT-29细胞内caspase 8活性的影响Table 4 Effects of different concentrations of EPS 12 on caspase 8 activity in HT-29 cells
caspase 8是caspase家族中最重要的起始因子,它可以激活所有的caspase级联反应,从而激活下游细胞凋亡,诱导细胞凋亡[29]。Zhuang H[30]研究表明当归多糖引起的细胞死亡与半胱天冬酶活性有关,伴随着线粒体膜电位的丧失,细胞色素C的释放以及从细胞质到线粒体的Bax易位。Zhou等[31]研究发现z-IETDFMK可以通过阻断了CT 26细胞中caspase 8和caspase 3的活化,来抑制EPS 116诱导的细胞凋亡。Zhang等[32]研究发现IFN-γ能逆转SY5Y细胞对TRAIL诱导凋亡功能的抵抗,其机制可能是IFN-γ能上调SY5Y细胞caspase 8的表达。
3 结论
本文通过对结肠癌细胞HT-29抑制率的测定,结合多糖产量和多糖浓度从实验室保藏的15菌种中筛选出一株高产且抑制率最高的乳酸菌,即12号乳酸菌。MTS法研究发现L.plantarum 12的EPS对HT-29细胞增殖的抑制率最高,L.plantarum 12胞外多糖在250 μg/mL时抑制率最高为27.58%。分离纯化后的EPS12-1和EPS12-2在250 μg/mL存在最高抑制率为7.11%和12.0%。L.plantarum 12的EPS可能通过增加ROS酶活和激活caspase8来抑制HT-29增殖。

