L-精氨酸对实验性牙移动大鼠牙周组织CD133表达的影响
李 慧,李明贺,汪 洋,黄 蕾,周雪纯
(1.首都医科大学密云教学医院 口腔科,北京101500;2.吉林大学口腔医院 a.口腔颌面外科;b.正畸科)
正畸牙移动的过程就是牙周组织改建的过程,研究牙周组织改建的机制对正畸临床有重要的意义。虽然学者们[1,2]做了大量的研究,提供加速牙周组织改建的方法,即加速牙移动的方法,如适当的给药、物理方法的使用等,但这些方法的具体应用仍处于探索阶段。本研究旨在通过建立大鼠实验性牙移动模型,注射一氧化氮(NO)前体左旋精氨酸(L-Arg),观察CD133在大鼠牙周组织中的表达情况,本课题组前期研究[3,4]表明:CD133阳性细胞参与了实验性牙移动牙周组织早期的血管改建,在此基础上进一步探讨其在牙周组织改建信号传导通路中的作用,从而进一步阐释实验性牙移动牙周组织改建的机制,并为L-Arg的临床相关应用提供实验依据。
1 材料与方法
1.1 实验动物和分组
取健康雄性6周龄Wistar大鼠40只,体质量为(0.15±0.02)kg,由吉林大学动物实验室提供。随机分为对照组与实验组,每组20只,按文献[5]描述建立实验性牙移动动物模型(在大鼠上颌切牙和右侧第一磨牙之间放置NiTi螺簧,以大鼠的上颌切牙为支抗牙,用50 g力拉动右上颌第一磨牙移动向近中),加力后立即采用L-Arg 300 mg·kg-1[6]溶解于0.5 mL生理盐水中,对实验组大鼠进行腹腔注射,对照组注射等量生理盐水,每天1次。
1.2 主要试剂和仪器
兔抗大鼠CD133多克隆抗体(北京博奥森试剂公司);免疫组织化学SP试剂盒(福州迈新公司);L-Arg(美国 Sigma 公司);防脱片剂:Poly-L-lysine多聚赖氨酸(福州迈新公司)。XL-I型正畸测力计(西北工业大学);病理图文分析仪:HPIAS-1000图像分析系统(同济医科大学)。
1.3 标本制作
在加力注射后的1、3、5、7、14 d用经1‰DEPCS水处理过的4%多聚甲醛经心脏灌注分别处死大鼠,制作牙周组织及牙的联合标本,用4%多聚甲醛将其固定过夜。经常规脱钙、脱水及石蜡包埋,制作5 μm厚的组织切片,以右上颌第一磨牙为中心、近远中方向。常规HE染色作组织的定位参照片,以CD133为一抗(1∶200)行SP法免疫组织化学染色,以PBS代替一抗作为阴性对照,二氨基联苯胺(DAB)显色。
1.4 镜下观察与图像分析
1.4.1CD133阳性反应灰度积分 CD133染色之后,从每组标本的切片中随机选取3张,光镜下对比观察实验组与对照组CD133阳性表达的分布情况。每张切片中随机选择5个非重叠视野(×200)测定CD133阳性反应强度灰度,将其转化为灰度积分(阳性产物面积/测量面积×阳性强度的灰度值)。
1.4.2CD133阳性新生血管计数 按Weidner方法[7],首先低倍镜下查找血管的密集区,再于高倍视野下(×200)计数每个视野含CD133阳性细胞的微血管数:即微小血管由2-3个内皮细胞或内皮细胞簇构成,以下情况不计数:5个以上内皮细胞构成管腔或管腔带有较厚肌层、达8个红细胞大小的血管。随机选择5个非重叠视野,测定值取平均值。
1.5 统计学分析
2 结果
2.1 光镜观察
2.1.1HE染色 对照组与实验组相似,因机械牵拉牙周膜分为压力侧和张力侧。压力侧牙周膜纤维排列紊乱,血管管腔变窄,破骨活跃,可见骨吸收陷窝;张力侧牙周膜纤维排列具有方向性,牙周膜相对增宽,血管扩张,成骨细胞排列成排,可见新骨形成。压力侧和张力侧均可见新生血管。实验组大鼠的微血管结构更丰富。见图1和2。
2.1.2CD133免疫组织化学染色 各时间点对照组和实验组均有不同程度的棕黄色颗粒阳性表达,在部分新生血管内皮细胞、成骨细胞及其前体细胞、成纤维细胞胞浆中可见。相同时间点实验组染色强度普遍高于对照组,尤其在加力3、5天时,实验组大鼠CD133在新生血管内皮细胞、成骨细胞及其前体细胞中表达明显。见图3-6。
2.2 图像分析
2.2.1实验性牙移动牙周组织中CD133阳性反应平均灰度积分 对照组CD133阳性反应灰度积分
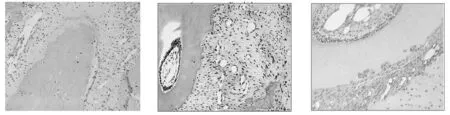
图1 对照组7天牙周组织(HE,×100) 图2 实验组7天牙周组织(HE, 图3 对照组3天牙周组织CD133
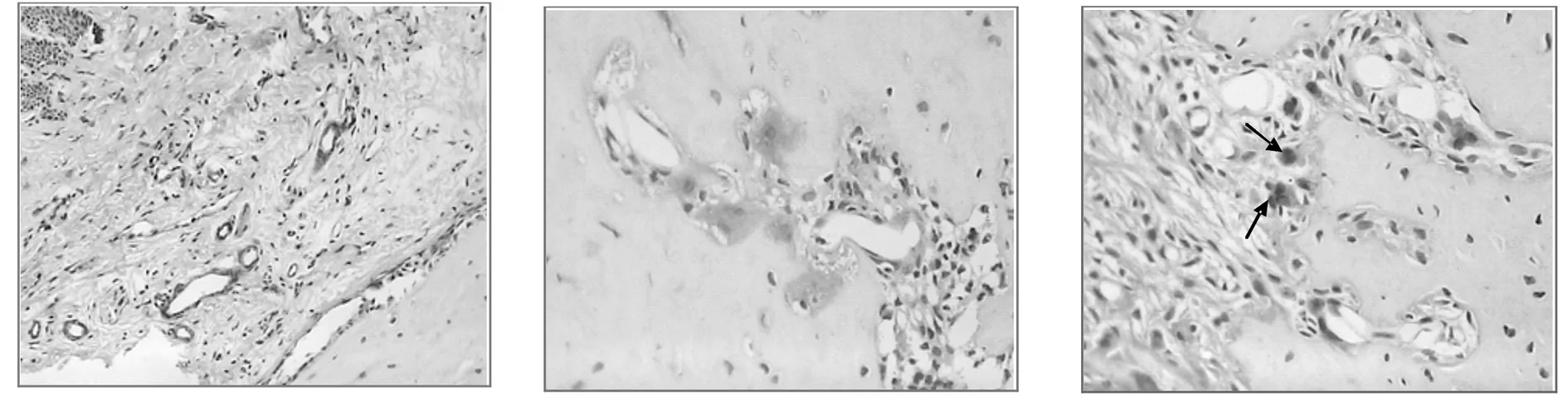
图4 实验3天组牙周组织CD133的表达(SP,×100)CD133染色阳性的新生血管较多 图5 实验组3天牙周组织CD133的表达(SP,×200)成骨细胞CD133染色阳性 图6 实验组5天牙周组织CD133的表达(SP,×200) 箭头所指为成骨细胞前体细胞CD133染色阳性
高峰出现在加力后1 d,实验组在加力后5 d出现最高值,峰值落后于对照组。实验组在加力3、5 d时表达明显高于对照组(P<0.05)。见表1。
表1 两组大鼠CD133阳性反应平均灰度积分
注:NS无统计学意义,P<0.05有统计学意义
2.2.2实验性牙移动牙周组织中CD133阳性新生血管计数 加力1天后在实验组和对照组大鼠中均观察到CD133表达阳性的新生血管,且对照组达高峰,实验组在加力3天达高峰,且明显高于对照组(P<0.05)。见表2。
表2 两组大鼠CD133阳性新生血管计数
注: NS无统计学意义,P<0.05有统计学意义
3 讨论
实现牙移动需要通过牙周组织的改建[8],牙齿移动速度和正畸矫治疗程取决于牙周组织的改建水平。CD133是一种跨膜蛋白,是研究最多、较有研究价值的干细胞表面特异标记分子之一,通过CD133 可以分选干细胞及前体细胞等[9],排除成熟内皮细胞。目前,CD133 的生物学功能还未完全明确,仅是其参与的信号通路与干细胞激活有关被基本确认[10]。在组织缺血、缺氧等内源性刺激以及加入生长因子、药物等外源性刺激的生理或病理条件下,骨髓中的造血/内皮祖细胞将被动员进入外周血并归巢参与组织中血管改建部位[11]。已有研究显示加入细胞因子,激素或药物等外源性刺激[12]可促进其的动员归巢。
本研究选用L-Arg作为外源性刺激。L-Arg是NO的前体也是促进剂,其在内皮细胞中产生的NO与细胞吸收的L-Arg几乎配对。外源性L-Arg能增加血管NO生物活性,并能明显促进NO合成和造血/内皮祖细胞增殖。而NO是最重要的一种内皮源性血管活性因子,介导和调节多种病理生理反应,具有扩张血管、信息传递、组织修复等作用。NO途径是一种重要的新血管形成的调节器,而且可以调节成血管细胞活性,影响其增殖,动员和迁移通过局部缺血及慢性损伤反应。研究[13]表明NO可调节造血/内皮祖细胞从骨髓的释放,对动员其入血起了关键作用。Qi等[14]的研究显示:外源性增加NO可显著提高循环造血/内皮祖细胞水平。而增加NO及提高其生物利用度则可以使造血/内皮祖细胞功能障碍得以恢复[15]。NO介导的信号通路更被认为是造血/内皮祖细胞动员的基础[16]。
本实验结果显示:对照组大鼠在牙周组织受到正畸力后,CD133有少量表达;而在受力3-5 d时,实验组的CD133阳性反应平均灰度积分明显高于对照组,即注射L-Arg后,在一段时间内CD133阳性表达确有增高。而实验组中CD133阳性新生血管表达也在一段时间内高于对照组,说明加入外源性刺激L-Arg促进了牙周组织改建中CD133阳性细胞数量的增多及作用的发挥。分析机制可能为NO是骨髓微环境的组成和调节成分,加入L-Arg促进内皮细胞产生和释放NO,进而促使基质金属蛋白酶-9(MMP9)的激活,从而促进CD133阳性细胞的动员和归巢[17]。而也正是由于这一过程使得CD133在实验组的牙周组织及新生血管中的表达高峰与对照组相比均后移。
实验组中CD133在牙根周围牙槽骨表面成骨细胞、成骨细胞前体细胞中表达较对照组明显,提示L-Arg促进CD133阳性细胞通过成骨细胞分化参与早期实验性牙移动牙周组织的骨改建。原因可能为虽然骨改建的发生很大程度上受血管化作用的影响,但已有研究表明造血/内皮祖细胞,既能分化为内皮细胞,也能分化成为成骨类细胞[18]。另有证据也表明,早期和功能性高活性的CD34/CD133+循环内皮祖细胞具有成骨潜能[19]。在其基础上由于NO对骨的作用,即NO是骨反应的重要媒介,其在进行骨改建及破骨细胞、成骨细胞等的功能分化过程中均起了重要的调控作用。因此注射L-Arg后,可见破骨活跃,破骨细胞活化明显,成骨也被促进,使得CD133阳性细胞的成骨分化增强。
综上所述,L-Arg通过上调实验性牙移动牙周组织中CD133的表达,促进CD133阳性细胞参与实验性牙移动的牙周组织改建,从而在促进实验性牙移动牙周组织的血管改建与骨改建方面发挥了作用。

