肿瘤患者外周血T淋巴细胞亚群及NK细胞比例检测的临床意义
赵美淇,梁新强,刘海洲,宋庆峰,张梦雅,毛莉莎,蒋士偲,杜江标,曹 雪,崔 英
(广西医科大学附属肿瘤医院 实验研究部,广西 南宁530022)
研究表明,肿瘤的发生与机体免疫功能有着密切的联系。人体的免疫细胞有很多种,其中外周血T淋巴细胞及自然杀伤细胞起重要作用,T淋巴细胞在肿瘤的发生、发展和抗肿瘤环节中,起到识别、标记和清除肿瘤细胞的作用[1,2],而自然杀伤细胞不仅与抗肿瘤、免疫调节有关,还有可能参与自身免疫性疾病的发生。通过对淋巴细胞亚群的检测,可以反映机体的免疫功能状态[3]。本研究采用流式细胞技术对肿瘤患者和健康人外周血 T 细胞亚群和 NK 细胞活性进行研究,以了解机体的免疫状态,分析其在健康人与肿瘤患者中的区别,为临床诊治提供相应依据。
1 资料与方法
1.1 临床资料
选取2013年10月—2018年1月广西医科大学附属肿瘤医院收治的621例肿瘤患者作为肿瘤组,其中男406例,女215例,年龄16-88岁,平均年龄(54.58±12.25)岁;其中,肝癌183例,肺癌114例,胃癌168例,乳腺癌67例,鼻咽癌89例。所有患者均经影像学、病理检查明确诊断。选取同期到本院体检的健康人115名为健康组,其中男76例,女39例,年龄25-69岁,平均年龄(53.97±13.08)岁。两组患者性别构成比、年龄等方面比较差异无统计学意义 (P>0.05),可以进行比较。
1.2 仪器与试剂
采用美国Beckman coulter公司生产的仪器与试剂,ABC溶血素,型号为Epics XL的流式细胞仪,型号为COULTERQ-PREP的自动溶血仪,鼠抗人单克隆抗体CD45/CD4/CD8/CD3和鼠抗人单克隆抗体CD45/CD(16+56)/CD19/CD3。
1.3 检测方法
被检者分别于清晨空腹抽取5 ml肘静脉血,将抽取的静脉血置于含有乙二胺四乙酸二钠(EDTA-Na2)的试管中。从试管中吸取100 μl全血,与20 μl荧光素标记的鼠抗人单克隆抗体 CD45/CD4/CD8/CD3、20 μl荧光素标记的鼠抗人单克隆抗体CD45/CD(16+56)/CD19/CD3混匀,在室温下进行30 min避光反应,1 h内上机检测。根据前向和侧向散射光双参数点图,设“门”于白细胞共同抗原(CD45)阳性细胞,计数5000个淋巴细胞,双参数分析淋巴细胞表面标记,计算出CD3+、CD4+、CD8+、NK和CD19+细胞的百分比含量。
1.4 统计学方法

2 结果
2.1 外周血淋巴细胞亚群在肿瘤组与健康组间的区别
肿瘤组外周血CD3+、CD4+、CD19+细胞比例、CD4+/CD8+比值均低于健康组,NK细胞比例高于健康组(P<0.05),差异有统计学意义。健康组与肿瘤组间的CD8+值差异无统计学意义(P>0.05),见表1。
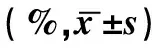
表1 两组淋巴细胞亚群检测结果比较
2.2 外周血淋巴细胞水平在不同类型肿瘤患者间的区别
对鼻咽癌患者的数据分析显示其CD3+、CD4+细胞比例、CD4+/CD8+比值低于其他肿瘤患者(P<0.05),NK细胞比例高于其他肿瘤患者(P<0.05);乳腺癌患者的CD4+/CD8+比值低于其他肿瘤患者(P<0.05);胃癌患者的CD3+细胞比例高于其他肿瘤患者,CD19+细胞比例低于其他肿瘤患者(P<0.05);不同肿瘤患者间CD8+细胞比例无差异,见表2。
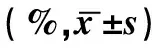
表2 肿瘤组不同肿瘤类型患者淋巴细胞亚群检测结果比较
3 讨论
机体抵抗肿瘤的主要方式是由T细胞介导的细胞免疫,机体的免疫水平可以通过对肿瘤患者外周血淋巴细胞亚群检测体现[4]。因此,对外周血淋巴细胞亚群的变化进行检测,可以快速、准确的监视机体免疫状态。外周血T淋巴细胞亚群包含多种细胞,目前对 CD3+细胞、CD4+细胞和CD8+细胞的作用研究较多[5-8]。NK 细胞在免疫调节中起到非特异性杀伤肿瘤细胞的作用,NK细胞活化后通过细胞因子发挥抗肿瘤作用,其机制是迅速分泌 IFN-α、IFN-γ、IL-2、GM-CSF 等细胞因子,与此同时,NK细胞可以对吞噬细胞的功能进行调节[9]。B细胞是体内唯一能够产生抗体的细胞,在B淋巴细胞表面有许多种跨膜蛋白,CD19分子是其中一种糖基化Ⅰ型跨膜蛋白,它能够调节B细胞的活化、增殖,并以协同受体的形式参与B细胞的活化和信号转导过程[10]。
本研究选择广西地区发病率和死亡率较高的恶性肿瘤(肺癌、肝癌、乳腺癌、鼻咽癌)[11]作为研究对象,用流式细胞仪对外周血淋巴细胞亚群的变化进行检测。结果发现,肿瘤组与健康组比较,CD3+、CD4+、CD19+细胞比例、CD4+/CD8+比值均低于健康组,NK细胞比例高于健康组。说明肿瘤患者存在免疫抑制状态,这种状态对机体识别和杀伤突变细胞的能力产生了负面影响,引起免疫功能的失衡,这与国内一些研究结果基本一致[12,13]。已有研究表明:肿瘤细胞微环境中存在许多能够抑制CD4+细胞成熟、分化的免疫抑制因子,同时CD8+细胞比例上升[14],CD4+/ CD8+比值降低,使机体进入免疫抑制状态,导致免疫功能紊乱,肿瘤细胞无法被正常清除,促进了肿瘤细胞的增殖,使病情加速恶化[15]。在T淋巴细胞被抑制的同时,NK细胞比例有所升高,说明NK细胞的免疫反应增强,提示肿瘤患者体内的细胞免疫功能可能促进并激活了NK细胞的增殖。
本研究进一步发现,患有不同肿瘤的个体外周血淋巴细胞比例有差异。其中鼻咽癌与其他肿瘤差异较大,CD3+、CD4+、CD4+/CD8+比例显著低于其他肿瘤,NK细胞比例显著高于其他肿瘤。乳腺癌的CD4+/CD8+比例低于其他肿瘤。胃癌的CD3+比例高于其他肿瘤,CD19+比例低于其他肿瘤。说明恶性肿瘤细胞在生长、侵袭的过程中,由于组织来源、恶性程度等不同,导致细胞免疫功能也存在一定的差异[16]。这与国内其他研究者的结果略有不同[17-20],可能与入选肿瘤的类别、样本量及地域差异有很大关系。由于肿瘤来源的不同,有些肿瘤细胞如鼻咽癌细胞,其表面特异性受体的结构与其他肿瘤有很大差异,使其自身产生不同于其他肿瘤的免疫逃逸机制,在识别与结合靶点方面,效应性T细胞失去了应有的准确性,反馈抑制了CD4+、CD8+细胞等杀伤性淋巴细胞的增殖[21]。NK细胞比例升高可能是由于T细胞在杀伤肿瘤的过程中不断增殖与进化,NK细胞的非特异性杀伤功能无法识别发生变化的T细胞。因此,在肿瘤的发生、发展过程中,各淋巴细胞亚群的比例会随着免疫微环境的改变而发生变化,若想及时有效地反映机体的完整免疫状态,有必要全面的结合其他因子进行联合检测[22],才能更好地评估患者的病情与预后。
综上所述,外周血中淋巴细胞亚群及NK细胞的变化对早期发现和早期诊断恶性肿瘤具有一定的临床价值。通过检测不同淋巴细胞亚群的变化情况,可以及时了解恶性肿瘤患者的免疫状态。

