放大光学增强内镜在结直肠息肉诊疗决策中的应用
程 星,李 玫,李长锋
(吉林大学中日联谊医院,吉林 长春130033)
结直肠癌是常见的消化道恶性肿瘤。大部分早期结直肠癌预后良好,5年生存率超过90%[1]。腺瘤性息肉与恶性肿瘤的发生发展密切相关。因此,对结直肠息肉等癌前病变尤其是癌变息肉的早期发现与治疗,成为结直肠癌二级预防的关键[2]。近年来,内镜成像技术的发展使早期结直肠癌及癌前病变的准确诊断成为可能。其中,放大、光学增强内镜(OE)因其操作方便、不延长检查时间等优点已应用于临床工作中。我们拟通过对结肠镜检查中发现的息肉行放大OE观察,按照Sano分型标准,提高内镜诊断与病理诊断的符合度,评价息肉恶性进展的危险,提升内镜下诊断水平,从而更好地指导诊疗决策,在患者充分知晓决策风险的情况下减少诊疗费用。
1 材料和方法
1.1 研究对象
选择2016年6月至2018年6月于吉林大学中日联谊医院内镜中心行结肠镜检查发现息肉的患者,排除小于0.4 cm和大于3.0 cm的息肉、炎症性肠病、家族性息肉病、黑斑-息肉综合征及已确诊为进展期结直肠癌的患者。所有息肉行内镜下切除或外科手术切除得到完整标本,均有病理诊断。共选取293名患者,其中男151名、女142名,平均年龄52.4岁。
1.2 研究方法
内镜主机采用PENTAX EPK-i7000;结肠镜活检钳(久虹)钳头张开距离为6.0 mm。i-scan1模式的相关参数参照主机手册调整。普通OE及放大OE均在i-scan1的相同参数下进行观察。
由高年资内镜医师为患者行结肠镜检查并对发现的息肉作出内镜下诊断:发现息肉后冲洗病变表面,充分暴露表面微血管和微结构,使用活检钳估计病变大小,记录位置、形态、颜色、大小等并预测是否肿瘤性息肉;而后切换至OE模式观察,记录NICE分型;再切换至放大OE模式观察,记录Sano分型。观察结束后,依据病变的Sano分型决定内镜下切除或外科手术治疗,病理诊断由高年资病理医师在不被告知内镜诊断的情况下完成。以病理诊断为金标准,使用整体准确度、敏感度、特异性、阴性及阳性预测值来描述白光、OE、放大OE三种模式下的诊断能力,并进行组间比较。
1.3 内镜诊断标准
NICE分型标准[3]:Type1,与周围黏膜颜色相近或更亮,表面缺乏血管结构或仅有孤立的条状血管;Type2,较周围颜色更显棕色,表面可见增粗的棕色血管;Type3,相对背景黏膜呈深棕色,部分区域血管明显扭曲或消失。
Sano分型标准[4]:Ⅰ型,网状毛细血管不可见;Ⅱ型,腺管周围可见直径均一的毛细血管;ⅢA型,网格样毛细血管为分支样,有盲端,分布缺乏均匀性,毛细血管网的密度明显增加;ⅢB型,微血管粗细及毛细血管网分布更不规则,出现疏松血管网甚至无血管区。
1.4 病理诊断标准
依据改良的Vienna标准:非肿瘤性息肉(增生性息肉和炎性息肉)和肿瘤性息肉(管状腺瘤、绒毛管状腺瘤和绒毛状腺瘤),同时参照WHO(2010年版)肿瘤分类标准:轻度、轻-中度以及中度不典型增生归为低级别上皮内瘤变;将中-重度、重度不典型增生以及原位癌归为高级别上皮内瘤变;伴有癌变的病变分为黏膜内癌和黏膜下浸润癌。
1.5 统计学分析
采用SPSS 23.0统计学软件进行数据分析,计数资料采用百分数表示,各组诊断结果与金标准的一致性采用Kappa检验:Kappa系数值越大,一致性越好。组间比较行χ2检验,P<0.05表示组间差异有统计学意义。
2 结果
2.1 319枚息肉的内镜及病理结果
本组研究293名患者共319枚息肉,检出息肉的直径范围为0.4-3.0 cm,平均为0.78±0.54 cm。其中,经活检钳钳除21枚,圈套器圈套电切除154枚,尼龙绳套扎蒂部后圈套电切除12枚,EMR切除77处,ESD切除51处,外科手术4处。 其中非肿瘤性息肉77枚(24.1%),包括增生性息肉49枚(15.4%)、炎性息肉28枚(8.7%);肿瘤性息肉242枚(75.9%),包括腺瘤213枚(66.8%),高级别上皮内瘤变17枚(5.3%),黏膜内癌8枚(2.5%),黏膜下浸润癌4枚(1.2%)。见表1。
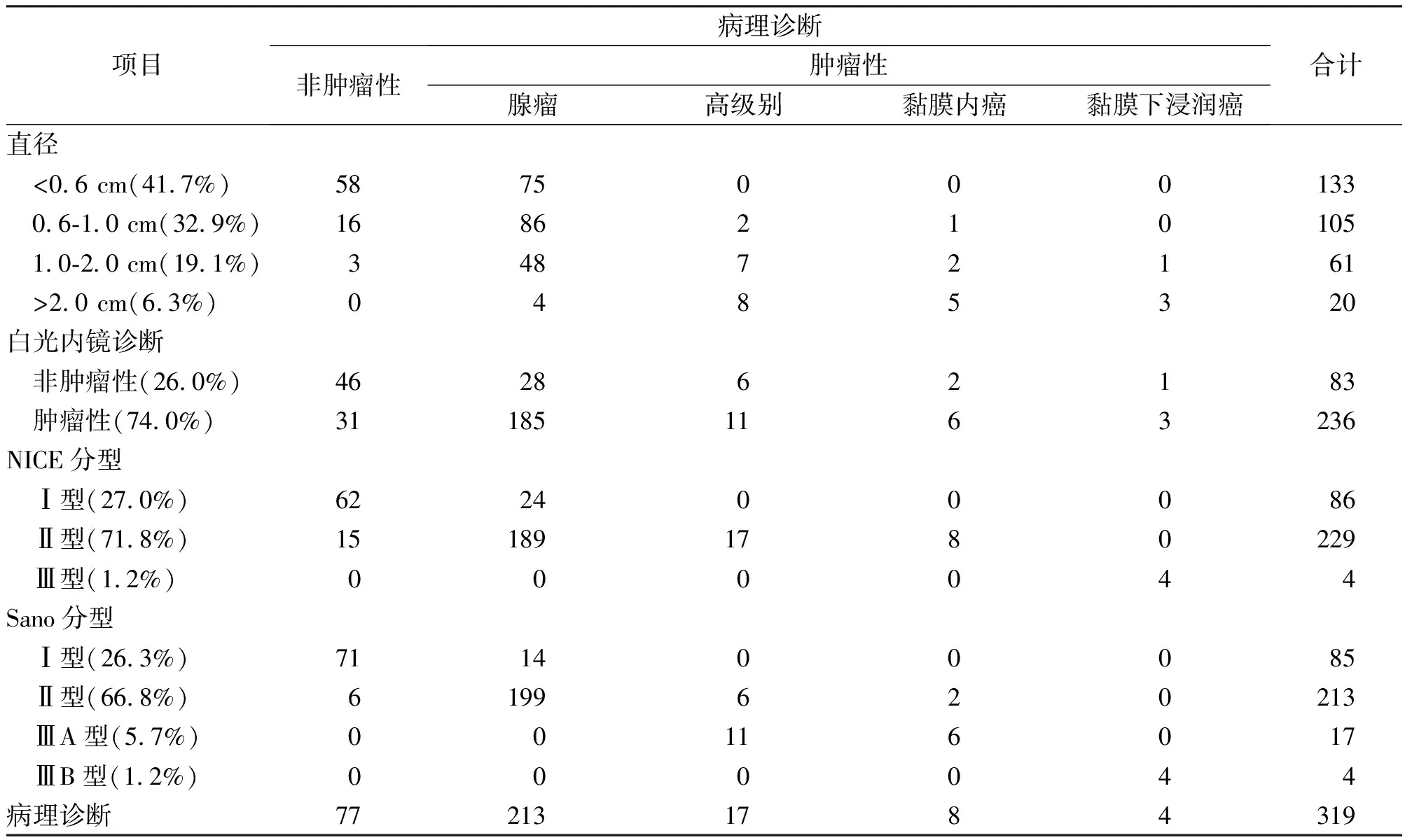
表1 319例结直肠息肉的内镜及病理结果
2.2 内镜诊断与病理诊断的比较
以病理结果为金标准行一致性检验,白光内镜诊断结论Kappa系数为0.433,一致性一般;OE模式诊断结论Kappa系数为0.679,一致性较强;放大OE模式下诊断结论Kappa系数为0.835,一致性强。应用配对资料χ2检验对三组整体准确度进行两两比较,白光与OE模式诊断能力有差异(χ2=9.89,P=0.002)。白光与放大OE诊断能力有差异(χ2=44.46,P<0.001)。OE与放大OE诊断能力有差异(χ2=8.31,P=0.003)。见表2。

表2 内镜诊断与病理诊断的符合率(%)
3 讨论
息肉尤其是腺瘤性息肉是重要的结直肠癌前病变,结直肠癌约80%是由腺瘤恶变而来的[5]。恶性肿瘤有诱导血管生成的能力[6],血流为肿瘤细胞恶性增殖提供营养,准确评估血管情况对于判断肿瘤的生物学侵袭行为至关重要。
普通白光内镜对结直肠息肉肿瘤性的鉴别能力较差,本组研究中白光内镜下诊断的整体准确度仅为78.7%。葛海峰等[7]研究色素内镜对息肉肿瘤性的预测准确率可达 94.9%,但色素内镜操作繁琐复杂,费时费力。本组研究结果显示,对结直肠息肉应用OE模式或放大OE模式进行观察,其判断息肉肿瘤性的敏感度、特异性和整体准确度都明显高于白光内镜,而且,放大OE模式对息肉肿瘤性的病理预测(93.7%)更优于普通OE模式(84.9%)。王沧海等[8]对107枚息肉行NICE分型分析,其诊断病变肿瘤性的敏感性、特异性、整体准确度分别为81.6%、70.0%、74.8%;Ikematsu等[9]应用 Sano 分型对1064处病变进行研究,其诊断病变肿瘤性的敏感性、特异性和整体准确度分别为97.1%、91.8%和96.6%,与本组研究结果基本符合。相较于普通白光内镜的诊断依据仅参照形态、颜色、大小等,OE模式预测息肉肿瘤性的优势在于更强调对病变表面血管改变情况的评估,其结论更可靠。
综上,OE和放大OE观察能更好地满足内镜下诊断的需要,诊断效果与病理结果一致性更好。其中,放大OE模式下Sano分型标准大致与病理结果对应(表3)。结直肠早癌诊治指南指出[10],根据不同内镜和病理诊断,应选择不同的处理方式。“切除和丢弃”策略是结肠小息肉管理的新范例,可降低息肉切除术后病理诊断的成本和工作量。Tsuji S等[11]对接受“切除和丢弃”策略的816处小于1.0 cm的病变患者进行连续随访(12-177个月),未发现局部和(或)远处复发。因此,我们可以根据病理类型评估息肉恶性进展的危险分级,并设定相应的临床决策(表3)。对于低危组,可建议不予切除,但需要规律随访[12],若随访间期病变进展应重新评估后再决策;对于中危组,可行内镜下切除或保留息肉并缩短随访时间,切除后标本无需送检病理学诊断;对高危组,建议限期内镜下切除,同时根据Sano分型决定内镜手术方式及治疗前后患者管理(门诊随访或住院管理),以规避并及时处置术后并发症;对于极高危组,需谨慎评估浸润深度、淋巴结转移风险,以决定进一步行内镜下切除或外科手术切除[10],其术后管理与随访应更严格。另一方面,蒋慈英等[13]应用NBI对1 000例患者活检病理结果符合率进行分析,结果显示NBI组明显提高早期大肠癌及癌前病变的诊断率。因此,我们还可以对Ⅲ型病变精准靶向活检。

表3 病理危险分级与临床决策
RISIO等[14]认为,腺瘤大小是其恶变与否的主要独立危险因素。对病变恶性进展危险度的评估,可以增加患者的依从性。在上述病理危险分级的基础上,结合息肉大小作出内镜下危险分级(表4),从而避免因位置、形态等差异低估了病变的危险度。另外,Tomohiro Iwai 等[15]结合表面发红、毛细血管形态、白点、不均匀的黏膜纹理等资料进行大样本的息肉观察数据分析,结果显示对局部浸润癌有较好的预测,值得我们借鉴学习。

表4 结直肠息肉内镜下危险分级
在内镜检查无法直接获得病理诊断的条件下,如何使内镜诊断更符合病理诊断,是内镜医师追求的目标。现有技术条件下,放大OE内镜可以极大地提高内镜下诊断准确度,同时不延长检查时间、不增加检查风险。因此,我们推荐放大OE模式下观察病变并结合病变大小、形态等信息,准确评估病变恶性进展的危险分级,规范化指导内镜医师的诊疗决策,减少患者诊疗费用。

