枸杞玉米黄素双棕榈酸酯脂质体的 制备及其体外抗氧化活性
, , ,,,
(宁夏农林科学院枸杞工程技术研究所,宁夏银川 750002)
枸杞(LyciumbarbarumL.)是传统的药食两用植物,传统医学认为枸杞具有“滋肝明目,清肺补肾”之功效,现代临床医学证明枸杞具有“抗氧化、抗肿瘤、延缓衰老、增强免疫力、软化血管、降低血脂”等功效[1-3]。类胡萝卜素是枸杞中主要的功效成分之一,枸杞中约含有十种,除少量的玉米黄素和β胡萝卜素外,97%以上的类胡萝卜素都是以酯化形式存在[2],其中仅玉米黄素双棕榈酸酯的含量就达到80%[4]。
玉米黄素双棕榈酸酯(zeaxanthin dipalmitate,以下简称ZDP),玉米黄素的脂肪酸形式,脂溶性的聚异戊二烯类化合物。研究发现,ZDP具有很强的肝脏保护作用,可以缓解由CCl4引起的Kupffer细胞炎症反应、氧化应激损伤和继发性胆汁淤积性肝纤维化损伤[4-7]。但是,人体自身无法合成此类功效物质,必须通过膳食进行补充,并且需要辅以油脂或脂肪代谢提高吸收率,再加上ZDP不溶于水,造成人体细胞很难吸收,生物利用度低。
纳米脂质体(liposome)是两亲分子在水中自发形成的、由双分子膜包裹的球状小囊,粒径在几十到几千毫米之间[8]。报道指出,番茄红素脂质体的相对生物利用率显著高于油溶番茄红素[9]。叶黄素和玉米黄素制成纳米脂质体,不仅其结构性能大大改善,热稳定性以及抗氧化活性都有显著的提高[10-11]。食品级脂质体用于营养因子及功能成分的包埋和运载具有无毒、双亲性和生物可降解等特点,能提高功能性营养物质在贮藏和消化过程中的稳定性和生物利用度;控制被包埋物质的定点、定时释放以及改善食品质构[12-13]。构建合适的输送载体,即纳米脂质体,是解决玉米黄素双棕榈酸酯溶解性、稳定性和生物利用度的有效途径之一。因此,本文采用超声法制备枸杞玉米黄素双棕榈酸酯纳米脂质体,并通过其对DPPH自由基清除力、还原力和抗脂质过氧化能力的影响研究了其体外抗氧化活性。
1 材料与方法
1.1 材料与仪器
枸杞子 宁夏农林科学院园林场基地;甲醇、乙腈、甲基叔丁基醚 色谱纯,Fisher chemical有限公司;二氯甲烷 色谱纯,Mreda technology有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) Sigma-Aldrich有限公司;其他试剂 均为国产分析纯。
TU-1810型紫外-可见分光光度计 北京普析通用仪器有限责任公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;HH·SY21-Ni型电热恒温水浴锅 北京长源实验设备厂;SHZ-D(III)型循环水式多用真空泵 天津华鑫仪器厂;BS224S型电子天平 赛多利斯科学仪器(北京)有限公司;HA220-40-48型超临界萃取装置 南通仪创实验仪器有限公司。
1.2 实验方法
1.2.1 玉米黄素双棕榈酸酯的制备 将枸杞子去除坏果、杂质,取约6~8倍体积的50 ℃水浸泡1 h并沥水,再重复浸泡2次后将枸杞用45 ℃热风烘干,超微粉碎并进行超临界萃取,萃取温度(40±5) ℃、压力为(27±1) MPa、CO2流量(335±35) L/h,萃取开始0.5 h后收集萃取物,萃取时长3 h,所得的提取物用二氯甲烷溶解后经HPLC分析,HPLC分析方法同参考文献[14]。
1.2.2 ZDP纳米脂质体的制备 采用谭晨[15]的方法,称取一定量的卵磷脂、吐温80、ZDP及胆固醇至圆底烧瓶中,加入6 mL CHCl3,50 ℃水浴旋转蒸发至形成均匀的薄膜,加入0.2 mol/L PBS缓冲液旋转水化至完全溶解后超声处理2 min即制成了ZDP脂质体。
1.2.3 单因素实验 采用1.2.2方法制备ZDP纳米脂质体,制备方法为:固定胆固醇∶卵磷脂=1∶4,吐温80∶卵磷脂=3∶10,PBS pH=7.0。考察不同ZDP∶卵磷脂(1∶2、1∶4、1∶5、1∶6、1∶8)对包封率的影响;固定ZDP∶卵磷脂=1∶5,吐温80∶卵磷脂=3∶10,PBS pH=7.0,考察不同胆固醇∶卵磷脂(1∶2、1∶3、1∶4、1∶5、1∶6)对包封率的影响;固定胆固醇∶卵磷脂=1∶4,ZDP∶卵磷脂=1∶5,PBS pH=7.0,考察不同吐温80∶卵磷脂(1∶10、2∶10、3∶10、4∶10、5∶10)对包封率的影响;固定胆固醇∶卵磷脂=1∶4,ZDP∶卵磷脂=1∶5,吐温80∶卵磷脂=3∶10,考察不同PBS缓冲液pH(6.6、6.8、7.0、7.2、7.4)对包封率的影响。进行单因素实验,考察各因素变量对ZDP脂质体包封率的影响。
1.2.4 标准曲线的绘制 称取200.00 mg ZDP,用石油醚溶解配制成不同浓度的ZDP标准液,测A450 nm,制作线性方程为y=0.1027x+0.029,(x为浓度,y为A450 nm)R2=0.9992,浓度范围:0.5~5.0 mg/mL。
1.2.5 包封率的测定 1 mL ZDP纳米脂质体中加3 mL石油醚,混匀后离心并收集上清液(3000 r/min,3 min),重复2次后合并上清液并用石油醚定容至9 mL,测量A450 nm,并根据上述标准曲线计算上清液中ZDP的浓度C(mg/mL),再根据下式计算包封率[16]。
其中,M为ZDP的添加量,mg;V为脂质体悬浮液的总体积,mL。
1.2.6 正交试验 在单因素实验基础上,选用四因素三水平设计正交试验,考察包封率,所采用的因素和水平见表1。

表1 L9(34)正交实验设计因素水平表Table 1 Factors and levels of L9(34)orthogonal experiment list
1.2.7 脂质体抗氧化活性评价
包封率是评价纳米脂质体质量的重要指标之一,为了考察ZDP脂质体的包封率对抗氧化活性的影响,固定胆固醇、ZDP和卵磷脂的用量,改变PBS的pH(6.6、6.8、7.0、7.2、7.4)制成不同包封率的脂质体,并测定其抗氧化活性。
1.2.7.1 DPPH自由基清除力 参考文献[17]方法略作改进,准确吸1 mL 样品(类胡萝卜素脂质体、ZDP-空白脂质体混悬液)加入3 mL DPPH乙醇溶液(0.14 mmol/L)均匀混合,在暗处反应40 min后离心(3000 r/min,40 min),取上清液测其吸光值At(λ=525 nm)。空白样吸光值Ac以PBS缓冲液代替样品测得,以乙醇代替 DPPH测得对照吸光值Ab。
1.2.7.2 还原力 参考文献[18]方法略作改进。取1 mL样品(ZDP脂质体、ZDP-空白脂质体混悬液),加1 mL K3[Fe(CN)6](2.5% w/v),混合后于50 ℃水浴反应20 min。快速冷却后加入5 mL TCA(10% w/v),充分混匀并过滤。取滤出液2 mL,加入2 mL 蒸馏水和0.5 mL FeCl3(0.1% w/v),混匀后静置反应15 min测A700 nm。
1.2.7.3 抗脂质过氧化能力 采用硫代巴比妥酸法(TBARS),通过测定体系中与硫代巴比妥酸(TBA)反应的底物丙二醛(MDA)的变化可以反映测试物的抗脂质过氧化能力[19-20]。TBA-TCA-HCl溶液的配制:取三氯乙酸(TCA)37.5 g、硫代巴比妥酸(TBA)0.925 g、浓HCl 4.45 mL溶于去离子水,80 ℃水浴并不断搅拌使其充分溶解,冷却后用去离子水定容至250 mL,过滤备用。ZDP脂质体抗 Fe3+/VC诱导的脂质体过氧化能力的评价:在样品管中依次加入 1.5 mL样品(ZDP脂质体、类胡萝卜素-空白纳米脂质体混悬液)、0.5 mL三氯化铁溶液(400 μmol/L)和0.5 mL抗坏血酸(400 μmol/L),混匀。于 37 ℃避光水浴 60 min,随后加入1 mL TCA-TBA-HCl混合液,100 ℃沸水浴10 min,迅速冰浴冷却,离心过滤(10000 r/min,3 min),取上清液在535 nm测吸光值As。空白管则以0.5 mL去离子水分别代替三氯化铁溶液和抗坏血酸,操作方法同样品管,测得吸光值Ac。计算公式如下:
1.3 数据处理
用SPSS 21.0软件对数据进行单因素方差分析,对3次平行实验的结果以平均值±标准差的形式表示。
2 结果与分析
2.1 ZDP的HPLC分析结果
图1为ZDP的HPLC分析结果,其中ZDP的峰面积含量占比>80%,说明ZDP具有较高的纯度。
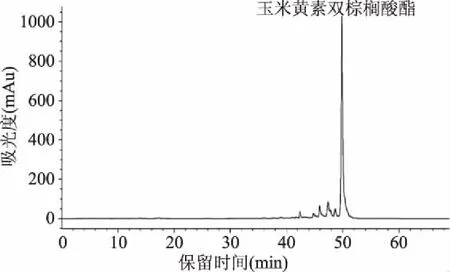
图1 ZDP的HPLC图Fig.1 HPLC chromatogram of ZDP
2.2 单因素实验结果与分析
2.2.1 ZDP与卵磷脂的质量比对脂质体包封率的影响 ZDP与卵磷脂的不同质量比对脂质体包封率的影响如图2所示。

图2 ZDP与卵磷脂的质量比对脂质体包封率的影响Fig.2 Effect of the mass ratio of ZDP to lecithin on the entrapment efficiency of liposomes注:图中不同的小写字母表示数值间的 显著性差异(p<0.05);图2~图8同。
如图2,随着ZDP与卵磷脂的比例从1∶2增至1∶6时,包封率呈现增大的趋势,包封率最大为99.40%。当ZDP与卵磷脂的比例继续增大为1∶8时,包封率急剧下降,仅为75%,这可能是因为一定的磷脂用量形成的脂质体数量有限,对ZDP的包埋具有饱和性。一旦ZDP量超过脂质膜饱和限度,部分ZDP就有可能进入外面胶团中,无法形成稳定的脂质体[21]。因此,该因素选择1∶5,1∶6,1∶7三个水平进行正交试验。
2.2.2 胆固醇与卵磷脂的质量比对脂质体包封率的影响 胆固醇与卵磷脂的不同质量比对脂质体包封率的影响如图3所示。

图3 胆固醇与卵磷脂的质量比对脂质体包封率的影响Fig.3 Effect of mass ratio of cholesterol to lecithin on the entrapment efficiencyof liposomes
由图3可知,随着胆固醇与卵磷脂的比例从1∶2增至1∶5时,包封率呈现增长的趋势,当胆固醇与卵磷脂的比例为1∶5时,包封率最大为95.21%。但当胆固醇与卵磷脂的比例继续增大为1∶6时,包封率显著降低(p<0.05)。这可能是因为胆固醇比例过大时,脂质体双分子层结构刚性增强,形成的脂质体双分子层膜的总表面积减小,破坏了双分子组成,使包封率下降[22]。因此该因素选择1∶4,1∶5,1∶6三个水平进行正交试验考察。
2.2.3 吐温80与卵磷脂的质量比对脂质体包封率的影响 吐温80与卵磷脂的不同质量比对脂质体包封率的影响如图4所示。

图4 吐温80与卵磷脂的质量比对脂质体包封率的影响Fig.4 Effect of mass ratio of tween-80 to cholesterol on the entrapment efficiency of liposomes
由图4可知,当吐温80的使用量占卵磷脂的比例为1∶10时,包封率最低,随着吐温80 用量的增大,包封率也随着升高,但2∶10,3∶10和4∶10的用量对包封率的影响不大,当继续提高吐温80用量为5∶10时,脂质体的包封率有所下降。因此该因素选择2∶10,3∶10,4∶10三个水平进行正交试验考察。
2.2.4 磷酸盐缓冲溶液pH对脂质体包封率的影响 不同缓冲溶液pH对脂质体包封率的影响如图5所示。
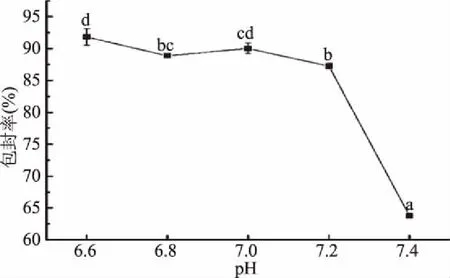
图5 缓冲液pH对脂质体包封率的影响Fig.5 Effect of buffer pH on entrapment efficiency of liposomes
如图5,随着PBS缓冲液pH的增大,包封率呈下降趋势,当缓冲液pH为6.6时,包封率最大为91.81%,当pH增大为7.4时,包封率仅为63.74%,这可能是因为pH改变了脂质体膜表面的电荷性质,进而改变脂质体膜通透性,影响ZDP被包埋的数量[23]。当pH为6.6时包封率最高,因此以pH为6.6时为中点,选择6.4,6.6,6.8三个水平进行正交试验考察。
2.3 正交实验结果分析
结果表明,在本实验方案所取的因素和水平下,最佳工艺组合为A1B2C1D2,各因素的重要指标程度依次为A>D>C>B。即胆固醇∶卵磷脂>缓冲液pH>吐温80∶卵磷脂>ZDP∶卵磷脂。
将推测的最佳工艺组合A1B2C1D2与表2中的包封率最高组合A1B2C2D2最对比分析,实验重复3次,得出方案A1B2C2D2包封率为96.83%±2.76%,方案A1B2C1D2包封率为97.99%±3.29%。结果表明A1B2C1D2为最佳工艺条件。即胆固醇∶卵磷脂为1∶4,ZDP∶卵磷脂为1∶6,吐温80∶卵磷脂为2∶10,PBS缓冲液pH为6.6时,ZDP脂质体的制备工艺条件最为合适。

表2 L9(34)正交实验结果Table 2 Results of L9(34)orthogonal experiments
2.4 脂质体体外抗氧化活性评价
2.4.1 DPPH自由基清除能力 DPPH·的单电子对可与自由基清除剂配对,使其吸收逐渐消失,吸光度减小,颜色由紫色转变成黄色[24]。因此对 DPPH·的清除能力可以有效评价抗氧化剂的活性,如图6所示,当脂质体包封率低时,随着包封率的增大脂质体清除DPPH自由基的能力变化较小,约为5∶10左右,当包封率>98%时,DPPH自由基清除力显著提高(p<0.05),可达75%。

图6 不同脂质体的包封率及DPPH自由基清除力Fig.6 Encapsulation rate and DPPH radical scavenging power of different liposomes
2.4.2 还原能力 还原力大的样品可以提供电子作为还原性物质,使自由基成为较稳定的物质,从而中断自由基的连锁反应,因此,物质的还原能力可以反映其清除活性氧等自由基或发挥抗氧化作用的能力[13]。ZDP脂质体的还原能力如图7所示,随着包封率的增大,还原力没有明显的变化,可见还原能力对包封率没有明显的依赖性。

图7 不同脂质体的包封率及还原力Fig.7 Encapsulation rate and reducing power of different liposomes
2.4.3 抗脂质过氧化能力 ZDP等类胡萝卜素类物质,因为分子结构中含有多烯烃或酚氧基结构,能淬灭单线态氧,避免了单线态氧对不饱和脂质的损伤,清除脂质过氧化自由基,从而有效地抑制脂质过氧化反应[25]。枸杞ZDP脂质体抗脂质过氧化能力如图8所示,当脂质体具有较高的包封率时,抗脂质过氧化作用也随之增高,不同包封率的脂质体对TBARS的抑制率从30%~90%,抗脂质过氧化能力差别较大,可见ZDP的抗脂质过氧化作用与脂质体对其的包埋能力有一定的关联性。

图8 不同脂质体的包封率及对过氧化物TBARS的抑制率Fig.8 Encapsulation rate and TBARS inhibition ratio of different liposomes
3 讨论与结论
使用超声波法制备枸杞ZDP脂质体,当ZDP、胆固醇、吐温80和卵磷脂的比例分别为1∶6,1∶4和2∶10,PBS pH为6.6时,ZDP脂质体的包封率较其他因素水平的脂质体包封率最高。脂质体包封率低,清除DPPH自由基的能力也较小,当包封率>98%时,DPPH自由基清除率可达75%;而还原能力对包封率没有明显的依赖性,即还原力不会随着包封率的增大而提高,还原力与共轭双键的数量以及类胡萝卜素和三价铁di-TPTZ复合物之间的空间位阻有关[26],因此不同包封率的相同脂质体对Fe3+的还原力没有明显的差异。较高的包封率的ZDP脂质体具有较高的抗脂质过氧化作用,说明ZDP的抗脂质过氧化作用与脂质体对其的包埋能力有一定的关联性,脂质体的过氧化常伴随双分子层的破坏,其对包埋芯材的保护作用也降低,而ZDP对脂质过氧化反应的抑制作用保持了脂质体结构的完整性,进而脂质双分子层又对被包埋的ZDP产生了良好的保护作用[27],因此高包封率的脂质体其抗脂质过氧化能力也较高。

