白及花脂溶性成分提取工艺优化 及其生物活性分析
,,,,*,,
(1.陕西理工大学,陕西省食药用菌工程技术研究中心,陕西汉中 723001; 2.陕西理工大学,生物科学与工程学院,陕西汉中 723001)
白及(Bletillastriata),兰科白及属,是多年生草本,主产于贵州、四川、湖南、湖北等省。《日华子本草》中记载,“白及止惊邪、血邪,刀箭疮扑损,温热疟疾,血痢,汤火疮,生肌止痛,风痹”[1]。研究表明,白及中含有甾类、萜类、多糖、联菲、联苄类以及酯类等上百种活性化合物[2]。
目前对白及的研究主要集中于其组培技术[3]、中药配伍与炮制[4]、块茎中多糖胶的活性和药物开发[5],而对白及花的研究主要集中于其花青素、多糖、黄酮类等活性物质,而对其脂溶性成分的研究鲜见报道。黄进等[6]研究了6种不同干燥方法对白及花中花青素、多糖、总黄酮和总酚的含量和抗氧化活性的影响。吕婉婉等[7]研究了白及花中花青素的含量及其抗氧化活性,为制作白及花饮品奠定了基础。研究发现多种药用植物中脂溶性成分具有抗菌、抗肿瘤、抗氧化和降血糖等生物活性。Liang[8]研究发现巨大蒲公英根中脂溶性成分具有抑菌和体外抗氧活性,Wang等[9]研究发现从无花果脂溶性成分中分离的β-谷甾醇具有较高的抗肿瘤活性。脂溶性成分作为白及花中一类重要化合物,优化其提取工艺,研究其生物活性对充分开发利用其药用资源有重要意义。
本研究采用索氏提取法对白及花中脂溶性成分进行提取,采用Box-Behnken设计分析对脂溶性成分提取工艺影响较大的三个因素即提取时间、提取次数和料液比进行优化,确定最优方案并验证,拟获得经济、科学的提取条件。采用滤纸片扩散法对脂溶性成分抑菌活性进行研究,采用CCK-8法对脂溶性成分抗肿瘤活性进行研究,并采用DPPH法、ABTS法和Fenton法考察其抗氧化活性,以期通过本研究为白及花的深入研究和综合开发提供参考。
1 材料与方法
1.1 材料与仪器
白及(Bletillastriata)花 采自陕西省汉中市汉台区汉王镇(北纬N33°04′10″ 东经E107°01′38″),将其晒干后备用;人肺腺癌细胞株A549中国科学院上海细胞生物学研究所;枯草芽孢杆菌(Bacillussubtilis,批号CMCC63501)、金黄色葡萄球菌(Staphyloccocusaureus,批号ATCC25925)、大肠埃希菌(Escherichiacoli,批号ATCC25922)、白色念珠菌(Candidaalbicans,批号CMCC85021) 以上菌株由陕西理工大学陕西省资源生物重点实验室菌种保藏中心提供,-80 ℃低温冰箱冻存;DPPH(1,1-二苯基-2-苦肼基) Sigma公司;ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐) 上海生物工程有限公司;正己烷、石油醚(60~90 ℃)等 均为国产分析纯。
EYELA N100 O型旋转蒸发仪 上海爱郎仪器有限公司;SW-CJ-1D型单人超净工作台 上海苏净实业有限公司;YXQ-LS-50S型高压灭菌锅 上海博讯实业有限公司医疗设备厂;超声波清洗器 昆山市超声仪器有限公司;UV2550型紫外分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 初始提取条件下白及花脂溶性成分的提取 将白及花在烘箱中40 ℃恒温干燥48 h,干燥至恒重,研磨过40目筛,称取8 g(M)白及花粉末,用石油醚80 ℃索氏提取,初始提取条件为2.5 h,连续提取3次,料液比为1∶20 g/mL,减压回收石油醚,得脂溶性成分样品,烘箱中40 ℃恒温干燥至恒重后称重,记作m,加入正己烷溶解后配成5 mg/mL的白及花脂溶性成分母液(LCBS)备用。利用下列公式计算脂溶性成分得率。
脂溶性成分得率(%)=m×100/M
1.2.2 单因素实验
1.2.2.1 提取时间对脂溶性成分得率的影响 固定反应条件为料液比为1∶20 g/mL,提取次数为3次,考察不同提取时间(1.5、2.5、3.5、4.5、5.5 h)对得率的影响。
1.2.2.2 提取次数对脂溶性成分得率的影响 固定反应条件为料液比为1∶20 g/mL,提取时间为3.5 h,考察不同提取次数(1、2、3、4、5次)对得率的影响。
1.2.2.3 料液比对脂溶性成分得率的影响 固定反应条件为提取时间为3.5 h,提取次数为3次,考察不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50 g/mL)对得率的影响。
1.2.3 响应面法试验 在单因素实验的基础上,根据Box-Behnken的中心组合试验设计原理[10],选取提取时间(A)、提取次数(B)、料液比(C)为变量,以脂溶性成分得率为响应值,每个变量按低、中、高3个水平分别以-1、0、+1进行编码[11]。试验因素及水平见表1。

表1 响应面分析因素和水平Table 1 Factors and levels of response surface analysis
1.2.4 白及花脂溶性成分的抗菌活性研究 采用滤纸片扩散法[12]研究白及花脂溶性成分对致病菌的抑菌效果,以含20%二甲基亚砜100 μL的纸片作为溶剂阴性对照,以含25 μg/mL青霉素100 μL的纸片作为阳性对照,以0.96%生理盐水100 μL的纸片为空白对照。利用十字交叉法测量抑菌圈直径D,抑菌效果(E)按下列公式计算:
E=(D样品组-D阴性对照组)/(D阳性对照组-D空白对照组)
1.2.5 白及花脂溶性成分的抗肿瘤活性研究 实验分成阴性对照组、空白组和给药组,每组设4个复孔[13];阴性对照组、给药组加入浓度为5×104cfu/mL人肺腺癌细胞株A549细胞悬液于96孔板中,每孔90 μL细胞悬液;空白组不加细胞加等量培养基;以上各组置于37 ℃,5% CO2培养箱中培养24 h。取10 μL用正己烷配制的1.0、2.0、3.0、4.0、5.0 mg/mL的LCBS溶液加在各给药组孔板内,对照组孔板内加入正己烷,空白组内加入培养基,于37 ℃继续培养,分别于24、48、72 h时测定1次[14]。测定时向每孔加入10 μL CCK-8试剂和90 μL无血清培养基,于37 ℃培养1 h,用酶标仪测定各孔OD450值。利用公式计算抑制率:
抑制率(%)=[1-(OD给药组-OD空白组)/(OD对照组-OD空白组)]×100
1.2.6 白及花脂溶性成分的抗氧化活性分析
1.2.6.1 还原能力测定 参考文献[15],稍作修改,用DMSO将白及花样品配成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL不同浓度的样品溶液,取1 mL样品,加入1 mL pH6.6磷酸缓冲液,1 mL 1%铁氰化钾溶液,混匀后于50 ℃水浴中反应20 min然后加入1 mL 10%三氯乙酸,混匀后取上清液2 mL,加超纯水2 mL与200 μL 0.1%三氯化铁,静置10 min后,测定OD700,同时将样品替换成1 mL二甲基亚砜作为空白组,将铁氰化钾溶液替换成1 mL去离子水作为对照组,重复3次,取平均值。
1.2.6.2 DPPH自由基清除能力的测定 参考文献[16],稍作修改,用DMSO将白及花样品配制成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL不同浓度的样品溶液,取2 mL样品溶液加入1 mL 0.2 mmol/L DPPH-99.9%乙醇溶液,混匀,放置在室温暗处10 min后测定517 nm处吸光值,每样重复3次,取平均值,并按下列公式计算DPPH自由基去除率。
清除率(%)=[1-(AS-ASB)/(AC-ACB)]×100
式中:AS为2 mL样品液+1 mL DPPH-乙醇溶液的样品吸光值;ASB为2 mL样品液+1 mL 99.9%乙醇溶液的样品对照组吸光值;AC为2 mL二甲基亚砜+1 mL DPPH-99.9%乙醇溶液的空白组吸光值;ACB为2 mL二甲基亚砜+1 mL 99.9%乙醇溶液的空白对照组吸光值。
1.2.6.3 ABTS自由基清除能力的测定 参考文献[17],稍作修改,将7 mmol/L的ABTS溶液和2.45 mmol/L的过硫酸钾溶液等体积混合,在室温、避光条件下静置过夜,形成ABTS储备液。使用前将ABTS储备液用99.9%乙醇稀释(约稀释50倍),即OD734为0.7±0.02。用DMSO将白及花样品配制成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL不同浓度的样品溶液,取50 μL样品溶入1000 μL ABTS工作液,振荡混合,放置于暗处5 min后测定OD734,每样重复3次,取平均值,并按下列公式计算 ABTS自由基清除率:
式中:AS为1 mL样品液+2 mL ABTS工作液的样品吸光值;ASB为1 mL样品+2 mL 99.9%乙醇溶液的样品对照组吸收值;AC为1 mL二甲基亚砜+2 mL ABTS工作液的空白组吸光值;ACB为1 mL二甲基亚砜+2 mL 99.9%乙醇溶液的空白对照组吸光值。
1.2.6.4 羟自由基清除作用 参考文献[18],稍作修改,用DMSO将白及花样品配制成0.1、0.2、0.4、0.6、0.8、1.0 mg/mL溶液,分别加入9 mmol/L FeSO4和9 mmol/L水杨酸-乙醇溶液各2 mL,最后加1.2 mmol/L H2O22 mL启动反应,于37 ℃反应30 min,以去离子水调零在波长510 nm测定样品浓度吸光度A1;另外,去离子水代替H2O2重复上述操作,测白及样品本身的吸光值A2,同时以水代替白及花样品溶液,测定吸光度A0。
羟自由基清除率(%)=[1-(A1-A2)/A0]×100
1.3 数据处理
数据计算和绘图用Origin 8.5软件进行,方差分析和数据变异采用Design-Expert 8.0.6、SPSS 21.0软件进行,比较不同处理间差异采用单因素方差分析。
2 结果与分析
2.1 初始提取条件下白及花脂溶性成分得率
由脂溶性成分得率公式可得,在初始提取条件下,白及花脂溶性成分得率为1.102%±0.105%。
2.2 单因素实验结果
2.2.1 提取时间对脂溶性成分得率的影响 由图1可知,白及花脂溶性成分得率随提取时间的增加而增加,提取时间较短时,脂溶性物质无法完全溶解出来,得率较低。当提取时间到3.5 h时脂溶性成分得率迅速增加,得率为1.232%,3.5 h后脂溶性成分得率上升趋势趋于平缓,说明脂溶性物质基本溶解完全,故选取最佳提取时间为3.5 h。

图1 提取时间对白及花脂溶性成分得率的影响Fig.1 Effect of extract time on the yield of liposoluble constituents of B. striata flower
2.2.2 提取次数对脂溶性成分得率的影响 由图2可见,白及花的脂溶性成分得率随次数的增加呈现出逐渐增加的趋势,当提取次数少于3次时,脂溶性成分得率增加较为明显,当提取次数达到第3次时得率为1.458%,第3次提取后的得率已经基本平稳,这可能是脂溶性物质以充分溶解与溶剂中的缘故,继续增加次数也不会增加得率,故提取次数选择最佳为3次。
给夏小凡拍的这张相片,是高志明的最后一张流动摄影作品。1981年初秋,因为未婚妻父亲的关系,高志明终于成为城区春风照相馆的一名正式职工。那些活泼的湖村姑娘,以及他悄悄注目过的少女,夏小凡,如醉湖上的波光,在之后的日子里,随崭新的生活和忙碌的工作,渐渐淡去。

图2 提取次数对白及花脂溶性成分得率的影响Fig.2 Effect of frequencies on the yield of liposoluble constituents of B. striata flower
2.2.3 料液比对脂溶性成分得率的影响 由图3可见,随着溶剂用量的逐渐增大,白及花脂溶性成分得率也随着上升,料液比达到1∶30 g/mL后,白及花脂溶性成分得率上升速度渐趋缓慢。这主要是由于随着溶剂用量增加,传质动力增加,白及花脂溶性成分更容易溶出。但在实际实验过程中,溶剂用量过小时,提取液过少,不利于后续的过滤分离工作;而溶剂用量过大时,会使后续的浓缩工艺耗时长、耗能多。故选取料液比1∶30 g/mL为宜。

图3 料液比对白及花脂溶性成分得率的影响Fig.3 Effect of solid-liquid ratio on the yield of liposoluble constituents of B. striata flower
2.3 响应面试验数据分析
2.3.1 试验设计方案及结果 根据单因素实验结果,由Design-Expert 8.0.6统计分析软件设计出的实验方案及实验结果如表2所示,以脂溶性成分得率为响应值(Y),以提取时间(A)、提取次数(B)、料液比(C)为自变量,建立3因素3水平中心组合实验设计共包括15个实验方案,其中有3个中心实验点,用以计算实验误差。
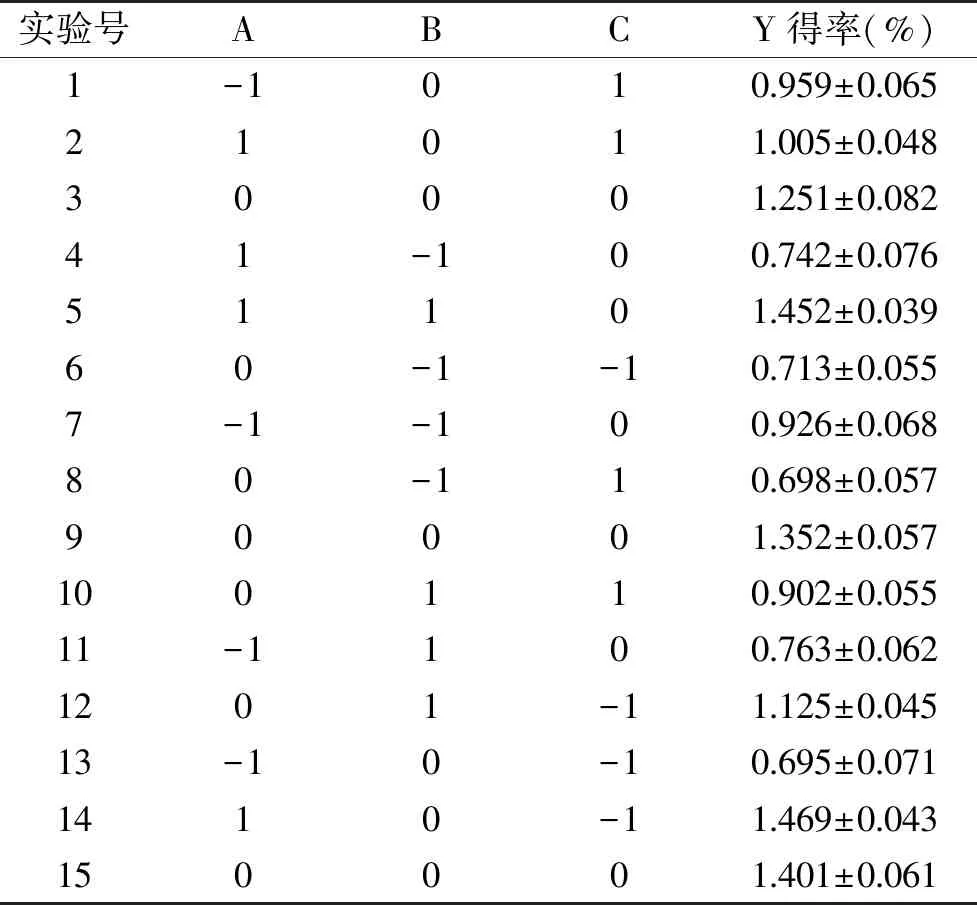
表2 响应面分析试验方案及结果Table 2 Response surface analysis design and result data
2.3.2 回归方程拟合及方差分析 采用Design-Expert8.0.6软件对所得数据进行二次回归分析,分析结果见表3,对各因素回归拟合后,得到二次回归方程如下:
Y=1.35+0.17A+0.15B-0.055C+0.22AB-0.18AC-0.052BC-0.10A2-0.27B2-0.21C2

2.3.3 响应面图分析 根据回归方程绘制白及花脂溶性成分得率随各因素变化的响应曲面图[19]。每个响应曲面分别代表着两个独立因素间的相互作用,另一个因素保持在编码水平的0水平[20]。等高线的形状可以反映出各因素间交互作用的强弱,若等高线为鞍型或椭圆形,表示两者交互作用显著;若等高线为圆形,表示两者交互作用不显著。
图4结果显示,交互项提取时间和提取次数的等高线为椭圆形说明两者交互作用对白及花脂溶性成分得率影响显著(p<0.05),这与表3方差分析中回归模型系数显著性检验结果一致。提取时间的曲面相对于提取次数较陡,说明提取时间对白及花脂溶性成分得率的影响比提取时间大。
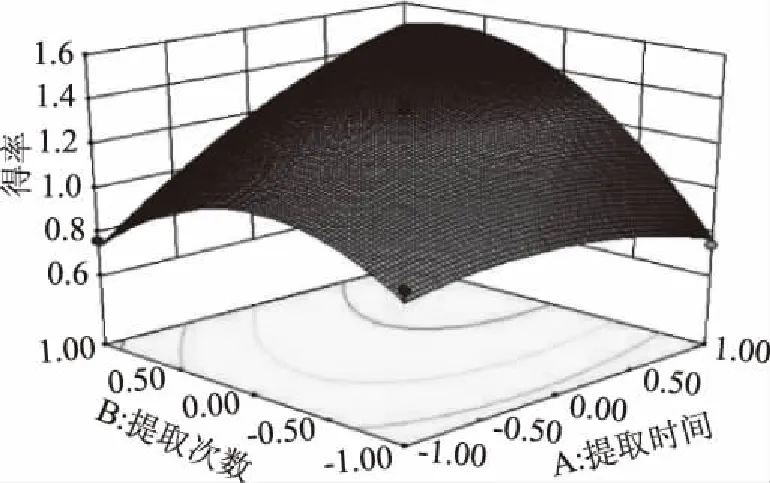
图4 Y=f(AB)响应面Fig.4 Response surface of Y=f(AB)

表3 回归方程的方差分析结果Table 3 Regression analysis data
图5结果显示,交互项提取时间和料液比的等高线为鞍形说明两者交互作用对白及花脂溶性成分得率影响显著(p<0.05),这与表3方差分析中回归模型系数显著性检验结果一致。提取时间的曲面相对于料液比较陡,说明提取时间对白及花脂溶性成分得率的影响比料液比大。
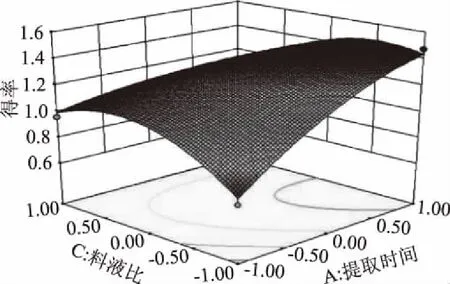
图5 Y=f(AC)响应面Fig.5 Response surface of Y=f(AC)
图6结果显示,交互项提取次数和料液比的等高线为圆形说明两者交互作用对白及花脂溶性成分得率影响不显著(p>0.05),这与表3方差分析中回归模型系数显著性检验结果一致。提取次数的曲面相对于料液比较陡,说明提取次数对白及花脂溶性成分得率的影响比料液比大。
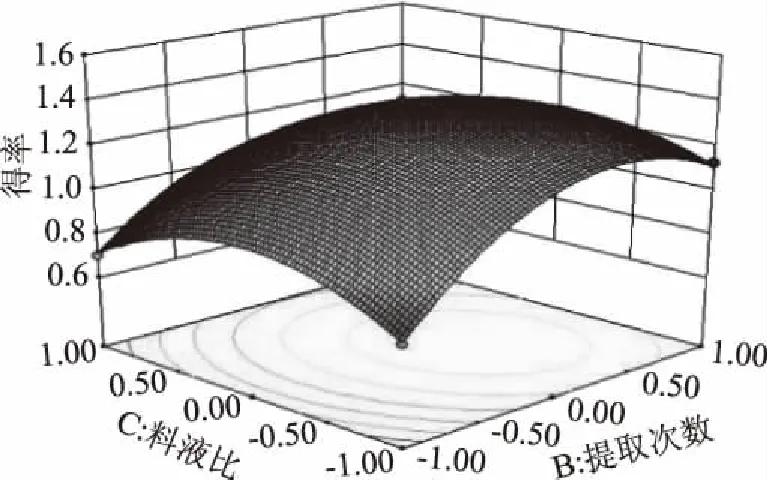
图6 Y=f(BC)响应面Fig.6 Response surface of Y=f(BC)
图4~图6直观地反映了各因素对响应值的影响,在选取的各因素范围内,通过Design-Expert 8.0.6对回归模型分析得出,白及花脂溶性成分的最佳提取工艺条件为:提取时间2.94 h,提取次数2次,料液比为1∶40 g/mL。
2.3.4 验证试验 在响应面分析得到最佳工艺此条件下,白及花脂溶性成分得率的理论值可达到1.416%。为了验证响应面分析的可靠性,采用上述最佳工艺参数进行验证试验,用该参数对样品进行3次平行实验,优化后白及花脂溶性成分得率的平均值为1.401%±0.112%,相对于初始提取条件下得率提高了28.49%,表明响应回归方程拟合出的理论值与实际值相吻合,证明了该回归方程的可靠性,为后续的实验提供了优化条件。
2.4 白及花脂溶性成分生物活性研究结果分析
2.4.1 白及花脂溶性成分抗菌活性分析 白及花脂溶性成分对Bacillussubtilis、Staphyloccocusaureus、Escherichiacoli和Candidaalbicans均有抑制作用,抑菌圈的大小为13~20 mm(见表4)。上述研究表明,白及花脂溶性成分对大肠埃希菌的抑制作用最强,其次为枯草芽孢杆菌和金黄色葡萄球菌,对铜绿假单胞菌无抑制作用,说明白及花脂溶性成分具有潜在的药用价值。

表4 白及花脂溶性成分抗菌活性分析Table 4 Antibacterial activity analysis of liposoluble constituents of B. striata flower
2.4.2 白及花脂溶性成分的抗肿瘤活性分析 如图7所示,当LCBS的浓度小于1.0 mg/mL时,细胞抑制率小于5%,而当大于1.0 mg/mL时,抑制率迅速变大,当浓度为5 mg/mL时,最高抑制率为32.115%,且随着时间的延长抑制率也在变大。可见在加入不同浓度LCBS溶液后,A549细胞抑制率均随着LCBS浓度增大而逐渐变大,而在同一浓度水平随着给药时间的延长,抑制率也随着增加。可见LCBS对A549细胞增殖的抑制作用呈现出明显的剂量效应和时间效应关系。

图7 白及花脂溶性成分对A549细胞增殖的抑制率Fig.7 Inhibitory effects of liposoluble constituents of B. striata flower on proliferation of A549 cells
2.4.3 白及花脂溶性成分的抗氧化活性分析
2.4.3.1 还原能力测定 由图8可知,白及花脂溶性成分具有一定的还原能力,且随质量浓度的升高而逐渐增大,但整体数值变化范围较小,浓度为1.0 mg/mL时,OD700吸光值为0.15,这可能是因为所提取的白及花脂溶性成分为混合物,纯度低,杂质较多,影响了其活性。
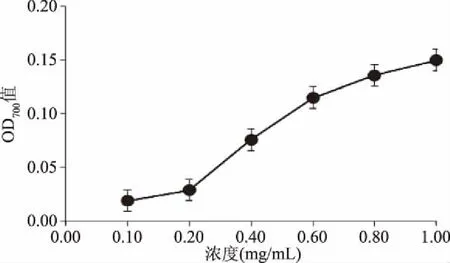
图8 白及花脂溶性成分的还原能力Fig.8 Reducing power of liposoluble constituents of B. striata flower
2.4.3.2 DPPH自由基清除能力的测定 由图9可知,白及花脂溶性成分具有一定的DPPH自由基清除能力,0.1~1.0 mg/mL内,随着质量浓度的增加,DPPH自由基清除能力不断增强,呈现良好的剂量效应关系。白及花脂溶性成分的DPPH自由基清除率回归方程为y=29.679x+1.5061(R2=0.9973),EC50为1.63 mg/mL,一般认为某种物质的EC50值低于10 mg/mL,表明其具有较好的抗氧化性[21],因此白及花中的脂溶性成分具有较强的DPPH自由基清除能力。
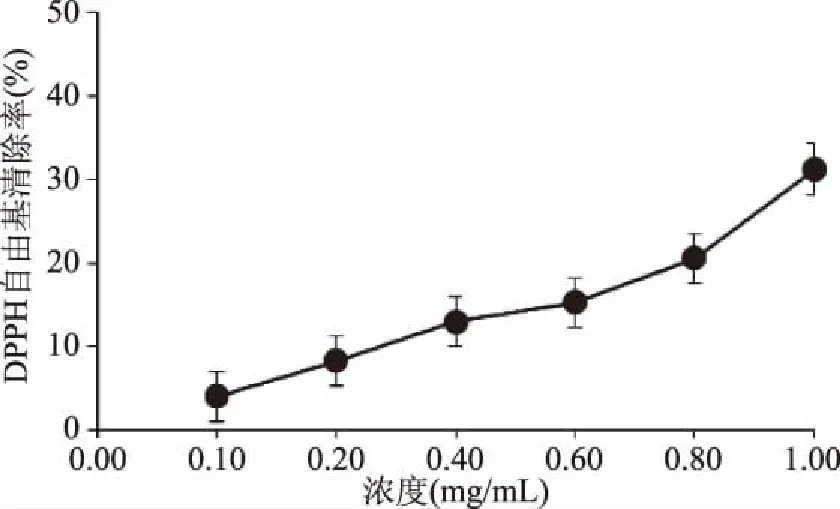
图9 白及花脂溶性成分对DPPH自由基的清除率Fig.9 Scavenging rate of liposoluble constituents of B. striata flower on DPPH free radical
2.4.3.3 ABTS自由基清除能力的测定 由图10可知,白及花脂溶性成分具有较强的ABTS自由基清除能力,脂溶性成分对ABTS 自由基清除率随着其质量浓度的增加而随之增加,成正比例关系。白及花脂溶性成分的ABTS自由基清除率回归方程为y=78.493x+12.846(R2=0.9965),EC50为0.47 mg/mL说明白及花脂溶性成分具有较强的ABTS自由基清除能力。
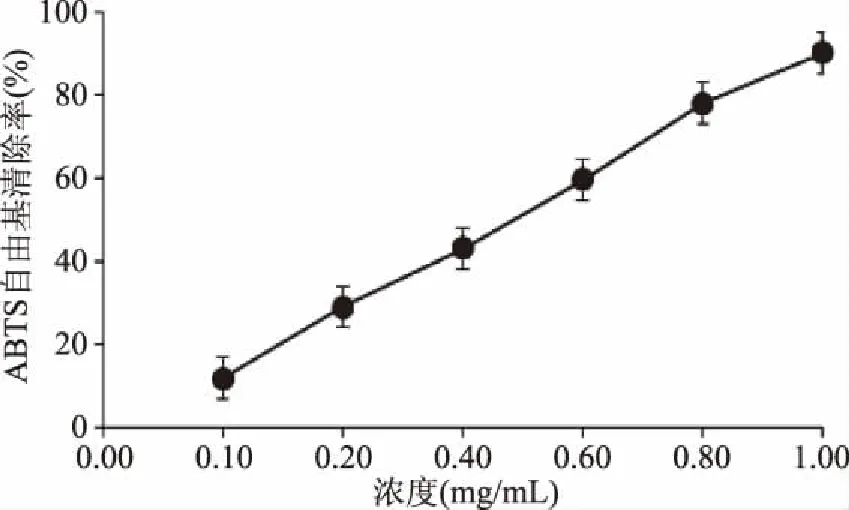
图10 白及花脂溶性成分对ABTS自由基在清除作用 Fig.10 Scavenging rate of liposoluble constituents of B. striata flower on ABTS free radical
2.4.3.4 羟自由基清除作用 由图11可知,白及花脂溶性成分具有明显的清除羟自由基作用且随着质量浓度的增加,对羟自由基的清除能力也逐渐增强。当浓度小于0.2 mg/mL时,白及花脂溶性成分羟自由基清除能力较小,当大于0.2 mg/mL时表现出较强的羟自由基清除能力,羟自由基清除率回归方程为y=41.76x-2.4184(R2=0.9922),EC50为1.25 mg/mL,表明低浓度的白及花脂溶性成分羟自由基清除作用较小,而高浓度的脂溶性成分对羟自由基有较强的清除作用,在0.2~1.0 mg/mL范围内具有剂量效应关系。
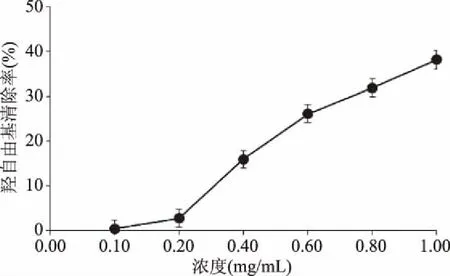
图11 白及花脂溶性成分对羟自由基的清除率Fig.11 Scavenging activity against hydroxyl free radical of liposoluble constituents of flower of B. striata
3 结论
采用Box-Behnken设计对白及花脂溶性成分得率的提取工艺进行优化,建立了脂溶性成分得率回归模型,由该模型优化的提取条件为:提取时间2.94 h,提取次数2次,料液比为1∶40 (g/mL),脂溶性成分得率的理论值可达到1.416%。在此条件下,通过验证试验测得最佳提取工艺条件下脂溶性成分得率为1.401%±0.112%,相对于初始提取条件下得率提高了28.49%,与模型预测结果相近,进一步验证了模型的可靠性,证明本实验优化的结果,具有实际意义。
对白及花脂溶性成分生物活性的研究结果表明,白及花脂溶性成分对Bacillussubtilis、Staphyloccocusaureus、Escherichiacoli和Candidaalbicans均有明显抑制作用,并且对A549细胞增殖的抑制作用呈现出明显的剂量效应和时间效应关系。白及花脂溶性成分具有一定的还原能力和DPPH、ABTS、羟自由基清除能力,EC50分别为1.63、0.47和1.25 mg/mL,且随质量浓度的升高而逐渐增大,说明白及花脂溶性成分对ABTS自由基的清除率大于对DPPH自由基和羟自由基的清除率。由此可见,白及花脂溶性成分具有抑菌、抗肿瘤和抗氧化活性,证明其具有潜在的药用价值。

