利用斑马鱼模型研究 琼胶寡糖抗氧化机制
,,*,,, ,
(1.中国海洋大学食品科学与工程学院,山东青岛 266003; 2.中国科学院海洋研究所,山东青岛 266071; 3.福建环海生物科技股份有限公司,福建诏安 363502)
琼胶(Agar)作为海洋红藻植物细胞壁中的多糖成分,多从石花菜属(Gelidium)或江蓠属(Gracilaria)藻类提取获得,常作为食品添加剂、微生物培养基等广泛应用于食品工业和生物技术领域[1-2]。琼胶虽无毒无害,但其粘度高、溶解性差,且作为生物大分子难以被人体吸收利用。这极大限制了其在医药、保健食品和化妆品中的高值化应用[3]。通过酶法、酸法水解琼胶获得的琼胶寡糖,分子量减小、水溶性好且易被人体吸收,其生物活性和应用价值得到显著提高[1]。
琼胶寡糖(Agaro-oligosaccharide,AOS)多为1~10个琼二糖重复结构单位连接形成的低聚糖,根据碳链还原性末端结构差异可划分为琼寡糖(3,6-内醚-α-L-半乳糖残基)和新琼寡糖(β-D-半乳糖残基)两大系列[4]。作为新型的功能性海洋低聚糖,AOS可由酸法或酶法制得,且有多种生物活性,包括抗氧化[5]、抗炎[6-7]、抗肿瘤[8-9]、抗糖尿病[10]和益生元[4]等。Chen等[11-12]曾研究不同酸对琼胶的降解产物的影响,结果表明盐酸在一定条件下可将琼胶降解为聚合度在2~10偶数琼寡糖,且表现出一定的体外抗氧化活性。此外,许多研究证实AOS具有体外抗氧化活性[12-15],单一聚合度AOS在鼠类哺乳动物中的抗氧化活性鲜有报道[12-16],未见多聚合度AOS混合物的体内抗氧化活性报道。
利用小鼠等哺乳动物模型研究天然物质的抗氧化活性已较为普遍,但这一方法也存在成本高、周期长、操作复杂等问题。斑马鱼(Daniorerio),一种小型热带观赏鱼,属鲤科淡水脊椎动物,由于其体型小、养殖成本低、繁殖周期短、产卵数目多、胚胎发育透明可见等优势已成为国际标准化组织推荐的模式生物[17]。此外,斑马鱼全基因组测序结果表明了其与人类基因组有87%的同源性,使其成为研究人类疾病的模式动物[18]。近年来,斑马鱼作为模式动物广泛应用于毒理评价、药物筛选和生物活性评价等诸多领域[17],现已有利用斑马鱼模型评价海洋褐藻中多糖、多酚等物质生物活性[19-20],但未见利用斑马鱼模型研究海洋红藻AOS抗氧化活性的报道。
研究表明,一定浓度的2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)可刺激早期斑马鱼胚胎诱发其体内的氧化应激过程,机体产生过量且无法清除的活性氧(ROS),ROS又可造成一系列细胞损伤,引起细胞死亡[21-23]。荧光探针染料2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)本身无荧光,但可穿过生物体细胞膜进入其细胞内,被胞内酯酶水解成不能透过细胞膜的DCFH,从而使探针装载到细胞内。细胞内活性氧在过氧化物酶存在下氧化无荧光的DCFH生成有荧光的二氯荧光素(DCF)[24],因此,DCF的荧光强度可显示机体细胞内活性氧相对水平。吖啶橙,一种核酸特异性的异染染料,通过嵌入或静电吸引与DNA和RNA相互作用,可染色坏死或非常晚期的凋亡细胞[22,25]。由于斑马鱼胚胎、幼鱼早期透明可见,因此可通过荧光染料DCFH-DA、吖啶橙等特异性的检测其体内活性氧生成率和细胞死亡率,进一步说明其机体氧化应激水平。
本实验利用优化的斑马鱼氧化模型,研究了不同浓度的AOS基本毒性和抗氧化活性,为AOS在功能性食品和化妆品中的应用奠定了理论基础。
1 材料和方法
1.1 材料与仪器
成年野生AB系斑马鱼 中国海洋大学医药学院分子医学生物学实验室提供;琼胶(提取原料为江蓠属龙须菜) 福建环球海洋生物科技有限公司;AAPH、DCFH-DA、吖啶橙、三卡因 美国sigma公司;氯化钠、氯化钾、氯化钙、硫酸镁、亚甲基蓝、盐酸 分析纯,上海国药集团化学试剂有限公司;琼二糖、琼四糖、琼六糖 日本Takara Bio Inc公司。
Agilent 1260 II液相色谱仪 美国安捷伦公司;Thermo BioBasic SEC-120色谱柱(300 mm×7.8 mm) 美国Thermo公司;SPX-100B-Z型生化培养箱 上海博讯实业有限公司;SZ61体式显微镜 日本奥林巴斯;DMI 6000B倒置荧光显微镜 德国Leica公司;FA2004B电子天平 上海天美天平仪器有限公司;Milli Q纯水机 默克密理博实验室设备(上海)有限公司;FD5-2.5冷冻干燥机 北京金西盟仪器有限公司;斑马鱼全自动循环养殖系统 北京爱生科技发展有限公司。
1.2 实验方法
1.2.1 AOS的制备 AOS的制备方法参考陈海敏等[26]的研究。将5 g琼胶粉末加入100 mL 0.5 mol/L的盐酸中搅拌均匀,加热至100 ℃条件下反应3 h后,再加入5 g琼胶粉末继续在100 ℃水解反应3 h。反应结束后,将水解产物冷却至室温后过滤、冻干(温度:-55 ℃;时间:48 h;压强:<1.33 Pa)。
1.2.2 AOS成分测定 称量0.05 g冻干粉末用1 mL去离子水溶解后,用高效液相色谱法测定其比例和组成,色谱柱为 Thermo BioBasic SEC-120色谱柱,检测器为示差检测仪检测,流速为0.5 mL/min,流动相为40%甲醇。使用商品化的琼二糖、琼四糖和琼六糖(均为5 mg/mL)作标准品对制备的AOS进行定性分析,根据出峰时间和峰面积计算各聚合度AOS的组成比例。
1.2.3 斑马鱼喂养及胚胎收集 斑马鱼饲养于全自动循环系统中,参照Westerfield[27]的方法养殖、培育,(26±1) ℃水环境,光周期为照明14 h/黑暗10 h 交替进行,每日以一定量的丰年虾(卤虫)于早晚固定时间各饲喂一次。实验用胚胎由健康雌雄斑马鱼自然交配获得。收集300~400枚胚胎于干净培养皿中并移除排泄物、杂质及未受精胚胎,加入胚胎培养液(10% NaCl,0.3% KCl,0.3% CaCl2,0.79% MgSO4,0.1%亚甲基蓝),转移于(28.5±1) ℃恒温培养箱中培养7~9 h。
1.2.4 胚胎给药 筛选受精且发育至7~9 hpf(hours post fertilization,受精小时)同时期的斑马鱼胚胎,移入24孔细胞培养板中,每孔15枚胚胎,除去残留培养液后,根据实验设计,每孔分别加入用胚胎培养液稀释的AOS活性物(25、50、100、150、200、400 μg/mL)或AAPH诱导物(10、15、20、25、30 mmol/L),纯胚胎培养液作空白对照,每个浓度3个孔(平行)[21]。活性物和诱导物给药后,将24孔板转移于(28.5±1) ℃恒温培养箱中继续培养待后续观察及检测。
1.2.5 AAPH诱导斑马鱼氧化模型优化 根据文献[21-23],选择不同浓度(10、15、20、25、30 mmol/L)AAPH,进行单因素的氧化应激造模优化。8~9 hpf给药,3 dpf统计幼鱼存活率、正常发育率,并检测幼鱼体内活性氧生成率和细胞死亡率。
1.2.6 AOS毒性评价 根据预实验结果,选择50、100、200、400 μg/mL AOS在7~8 hpf给药,3 dpf时期进行幼鱼存活率统计、幼鱼体内活性氧生成率和细胞死亡率的检测。
1.2.7 AOS抗氧化活性评价 选择无过氧化毒性的AOS安全浓度于7~8 hpf进行胚胎给药,在(28.5±1) ℃恒温培养箱中预孵育,1 hpf后选用得到的最优AAPH诱导浓度进行氧化应激诱导,3 dpf时期进行幼鱼存活率统计、幼鱼体内活性氧生成率和细胞死亡率检测。
1.2.8 指标测定
1.2.8.1 斑马鱼表型观察及存活率统计 每天于体式显微镜下观察胚胎发育状况,记录并及时移除死亡胚胎(死亡胚胎发白,死亡幼鱼无心跳,且尾部弯折),统计胚胎发育至3 dpf时期各孔幼鱼存活率情况及发育状况(存活率=3 dpf存活个数/总个数,正常发育个数=3 dpf正常个数/总个数)。
1.2.8.2 体内活性氧生成率和细胞死亡率检测 3 dpf时期,加入吖啶橙或DCFH-DA 等荧光试剂,于28 ℃培养箱中避光孵育。后用三卡因麻醉剂麻醉幼鱼,于荧光显微镜下捕获荧光图片,并用Image J软件分析、统计相对荧光强度。体内细胞死亡率以吖啶橙染色后给药组荧光强度与空白组荧光强度之比进行统计,体内活性氧的产生以DCFH-DA染色给药组荧光强度与空白组荧光强度之比进行统计。
1.3 数据分析
所有的实验至少重复三次,结果以M±SD表示,通过one-way ANOVA对实验结果进行统计学分析,运用多重比较Turkey检验分析实验数据间的差异性。所示结果中,p<0.05判断为具有显著性差异。
2 结果与分析
2.1 AOS的组成
自制AOS的高效液相色谱见图1。结果表明,制备的AOS为不同聚合度琼寡糖混合物,主要是琼二糖、琼四糖和琼六糖,占比分别为51.60%、28.40%、14.50%。课题组前期对琼二糖、琼四糖、琼六糖分离纯化后,分别测定了其细胞水平的抗氧化活性,结果表明,相同浓度下混合物的活性大于单一组分活性。因此,本论文以未经纯化的AOS混合样品作为研究对象,探究其在斑马鱼体内的抗氧化活性。
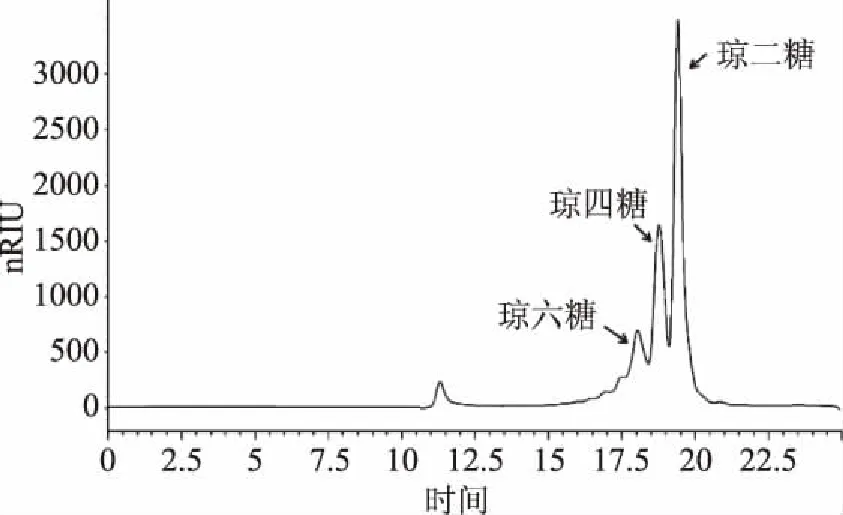
图1 自制AOS的液相色谱图Fig.1 HPLC spectrogram of the prepared AOS
2.2 AAPH诱导斑马鱼氧化模型优化
2.2.1 AAPH诱导浓度对斑马鱼胚胎存活发育的影响 如图2A所示,各实验浓度下的AAPH均导致了一定数量的胚胎死亡现象,且胚胎存活率与AAPH诱导浓度呈剂量依赖性下降,
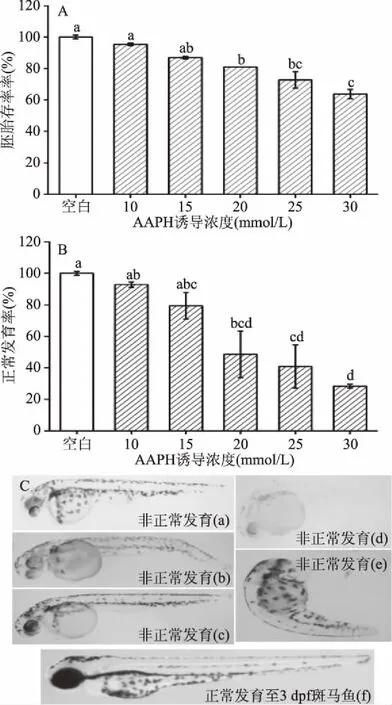
图2 AAPH诱导浓度对斑马鱼胚胎存活发育的影响Fig.2 Effect of AAPH-induced concentration on the survival and development of zebrafish embryo注:柱形图上方不同字母代表 差异性显著,p<0.05,图4~图10同。
但存活率都在50%以上,未达到半数致死剂量,均可供进一步实验。但通过胚胎发育情况图2B结果表明,高浓度(25、30 mmol/L)AAPH对斑马鱼胚胎发育造成严重损伤,正常发育率过低(40.77%、28.32%),且结合图2C可知,3 dpf斑马鱼正常发育状态如图2C(f)所示,非正常发育状态则如图2C(a)~图2C(e)所示,表现出发育迟缓、着色浅、卵黄囊肿大、尾部弯折、畸形等形态,因此,较低的正常发育率不利于后续体内荧光指标检测,而低、中浓度(10、15、20 mmol/L)AAPH对斑马鱼胚胎损伤较为适宜,均可满足后续检测。
2.2.2 AAPH诱导浓度对斑马鱼幼鱼体内氧化应激水平的影响 斑马鱼幼鱼在低、中浓度AAPH诱导后的荧光检测结果如图3和图4。结果表明,15 mmol/L AAPH诱导斑马鱼胚胎可显著提高其幼鱼体内过氧化应激水平(p<0.05),与空白组相比,其活性氧产生率能达109.37%,细胞死亡率可达121.43%,高于10、20 mmol/L AAPH诱导引起的过氧化应激水平。因此,后续实验选择最优15 mmol/L AAPH诱导浓度进行造模诱导。此最优浓度与Kim等[22]、Lee等[28]的AAPH诱导浓度相同,实验结果可取。

图3 AAPH诱导浓度对斑马鱼体内活性氧生成率的影响Fig.3 Effect of AAPH-induced concentration on the reactive oxygen species production rate in vivo

图4 AAPH诱导浓度对斑马鱼体内细胞死亡率的影响Fig.4 Effect of AAPH-induced concentration on the cell death rate in vivo
2.3 AOS毒性评价
2.3.1 不同浓度AOS对斑马鱼胚胎存活发育的影响 选择较大浓度梯度(50、100、200、400 μg/mL)AOS进行毒性评价的结果如图5所示。50、100、200 μg/mL AOS对斑马鱼胚胎均无致畸、致死毒性,而高浓度400 μg/mL AOS对斑马鱼胚胎有较低的毒性,与空白对照组相比差异显著(p<0.05),其存活率降低至93.33%。

图5 AOS浓度对斑马鱼胚胎的存活率的影响Fig.5 Effect of AOS concentration on survival rate of zebrafish embryos
2.3.2 不同浓度AOS对斑马鱼幼鱼体内氧化应激水平的影响 如图6、图7,与空白组以及低浓度AOS组(≤200 μg/mL)相比,400 μg/mL AOS显著提高了斑马鱼幼鱼体内的细胞死亡率(113.94%)和活性氧自由基产率(123.09%,p<0.05)。此外,200 μg/mL AOS对斑马鱼胚胎虽无致畸、致死作用(图5),但与空白组相比(图6),该浓度下斑马鱼幼鱼体内活性氧自由基水平表现出非显著性的升高(103.93%),表现出极弱的氧化刺激作用。因此可推测,低于200 μg/mL浓度的AOS对斑马鱼无胚胎损伤和氧化刺激,可作为活性评价的安全浓度。
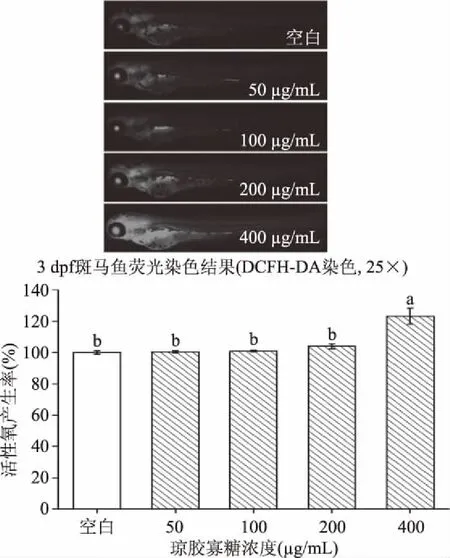
图6 AOS浓度对斑马鱼幼鱼体内活性氧生成率的影响Fig.6 Effect of AOS concentration on the reactive oxygen species production rate in vivo

图7 AOS浓度对斑马鱼幼鱼体内细胞死亡率的影响Fig.7 Effect of AOS concentration on the cell death rate in vivo
Wijesinghe等[29]发现红藻江蓠属(Laurenciasnackeyi)藻中活性物质5-Hydroxypalisadin B对斑马鱼幼鱼的氧化应激毒性,研究表明浓度为5 μg/mL时时可显著提高斑马鱼幼鱼体内的细胞死亡率,发生过氧化应激反应,而本实验中400 μg/mL AOS才显著提高幼鱼体内的细胞死亡率(p<0.05),表明AOS的氧化应激毒性较弱,应用前景更广。
2.4 AOS活性评价
2.4.1 不同浓度AOS对AAPH诱导的斑马鱼胚胎存活率的影响 由图8可知,与对照组相比,各浓度组AOS对AAPH诱导的斑马鱼氧化损伤均表现出显著保活作用(p<0.05),其中25、50、100 μg/mL AOS预孵育后,斑马鱼存活率由70%剂量依赖性地分别提高至80.00%、90.00%、96.88%。其最优AOS浓度为100 μg/mL,经该浓度AOS预孵育后,斑马鱼存活率与空白组无显著差异(p>0.05)。

图8 AOS对AAPH诱导的斑马鱼胚胎的存活率的影响Fig.8 Effect of AOS on survival rate of AAPH-induced zebrafish embryos 注:+即前期给药;-即前期未给药,图9~图10同。
2.4.2 不同浓度AOS对AAPH诱导的斑马鱼幼鱼体内氧化应激水平的影响 前期15 mmol/L AAPH给药刺激斑马鱼胚胎,使斑马鱼氧化损伤死亡率达30%左右。由图9知,受AAPH诱导刺激存活的胚胎发育到3 dpf幼鱼出膜时期,其体内的活性氧自由基产生率较未受AAPH诱导的空白组而言显著升高(108.87%,p<0.05);而预孵育AOS(25、50、100 μg/mL)后,其体内的活性氧自由基生成率剂量依赖性的下降(106.62%、102.81%、100.53%),且当AOS浓度为100 μg/mL时,其体内的活性氧自由基生成率同空白组无显著性差异(100.53%,p>0.05)。预孵育150 μg/mL AOS时,不能降低AAPH诱导引起产生的过多活性氧,且此情况下斑马鱼幼鱼体内活性氧生成率为109.28%,略高于仅AAPH诱导组,为108.87%。由此可见,100 μg/mL AOS为最优抗氧化浓度。
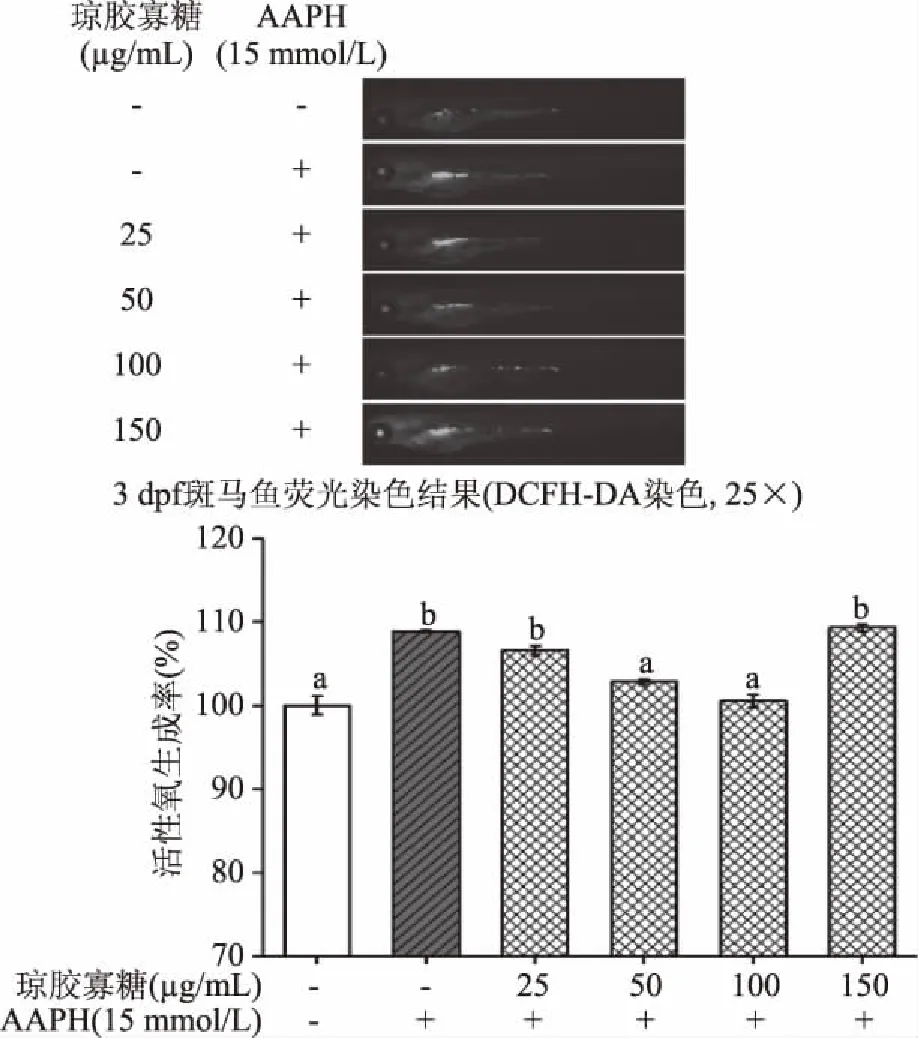
图9 AOS对AAPH诱导的斑马鱼 幼鱼体内活性氧生成率的影响Fig.9 Effect of AOS on the reactive oxygen species production rate of AAPH-induced zebrafish in vivo
斑马鱼3 dpf时期用吖啶橙对存活幼鱼进行细胞死亡特异性染色如图10。与空白组相比,仅AAPH诱导组其细胞死亡率显著性升高(120.37%,p<0.05),实验中预孵育各浓度AOS(25、50、100、150 μg/mL)均降低了由AAPH氧化损伤引起的细胞死亡率。此外,用25、50、100 μg/mLAOS预孵育斑马鱼胚胎,能剂量依赖性地降低由AAPH引起的高细胞死亡率,且预孵育浓度为100 μg/mL时斑马鱼幼鱼体内死亡率与空白组无显著性差异(p>0.05)。而预孵育150 μg/mL AOS时,斑马鱼幼鱼体内细胞死亡率较100 μg/mL浓度组(101.69%)非显著性的升高(107.94%)。此实验结果进一步表明100 μg/mL AOS为最优抗氧化浓度。
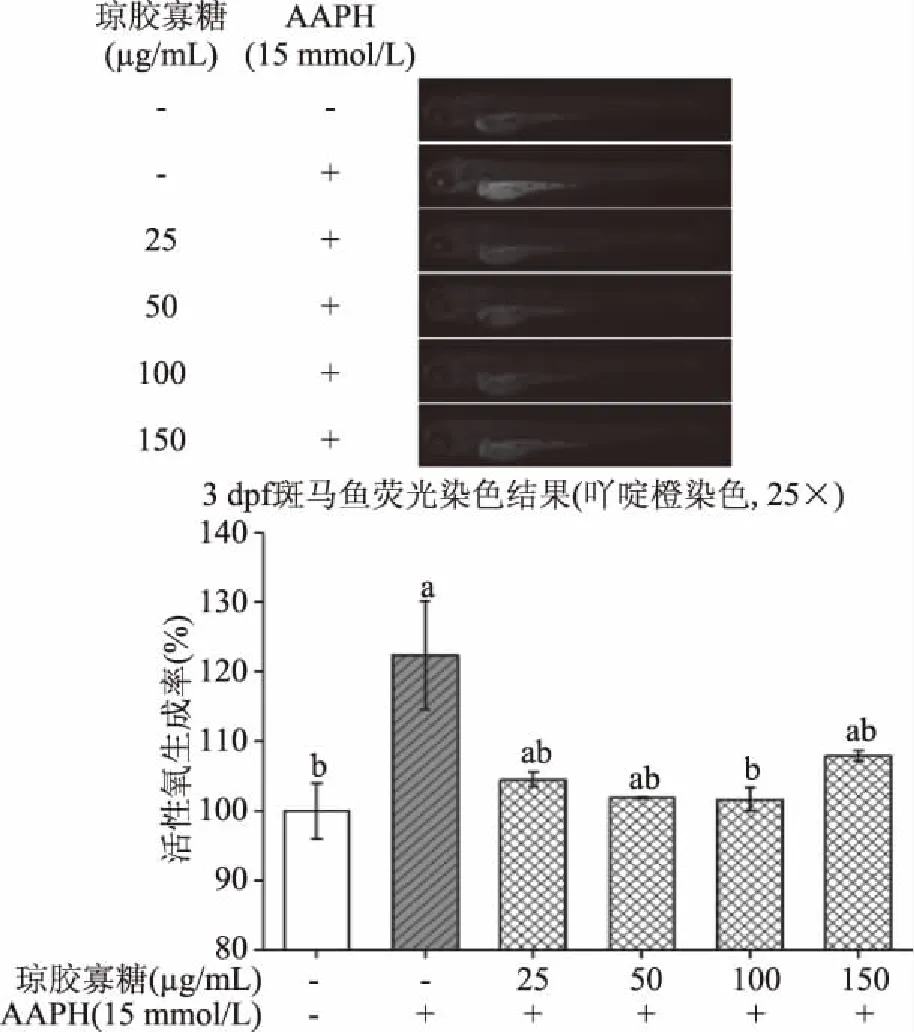
图10 AOS对AAPH诱导的斑马鱼 幼鱼体内细胞死亡率的影响Fig.10 Effect of AOS on cell death rate of AAPH-induced zebrafish in vivo
以上实验结果均表明了一定浓度的AOS具有良好的抗氧化活性,且其最优抗氧化浓度为100 μg/mL,这一结果优于Kim等[23]利用同一模型研究的褐藻糖胶的最优抗氧化浓度(200 μg/mL)。由此可见,AOS的抗氧化活性较高,具有极大的利用价值和市场前景。
3 结论与讨论
本研究优化了AAPH诱导斑马鱼氧化应激模型,并利用该模型首次评价了AOS的抗氧化活性。实验结果显示,在最优AAPH诱导浓度(15 mmol/L)下,斑马鱼幼鱼体内氧化应激达到最高水平,低于200 μg/mL浓度琼胶寡糖对斑马鱼胚胎无明显氧化损伤。一定浓度琼胶寡糖(25、50、100 μg/mL)剂量依赖性的减小斑马鱼体内氧化应激水平,100 μg/mL琼胶寡糖不仅显著提高AAPH诱导引起的低存活率(p<0.05),而且显著降低AAPH诱导引起的斑马鱼幼鱼体内高活性氧生成率和细胞死亡率(p<0.05),且实验中使用的琼胶寡糖抗氧化效果优于已报道的褐藻糖胶[23]。
已报道的AOS抗氧化作用机理有多种,宋香凝等[5]的体外自由基清除实验已证明AOS对自由基清除能力强弱为:羟自由基的清除能力>ABTS自由基清除能力>DPPH自由基清除能力;Chen等[12,16]利用H2O2诱导损伤的人肝脏细胞氧化模型研究了不同聚合度AOS通过清除胞内活性氧自由基(ROS)表现出不同的抗氧化活性;薛长湖等[14]、陈海敏[15]通过对肝损伤的鼠氧化模型灌胃AOS的研究表明,AOS可以提高小鼠体内超氧化物歧化酶(SOD)和谷胱甘肽酶(GSH)等抗氧化酶的活性清除多余自由基,最终达到抗氧化的目的。本研究结果则表明了AOS的又一抗氧化机理,即一定浓度AOS(25、50、100 μg/mL)可通过直接清除AAPH诱导的斑马鱼幼鱼体内ROS,和减少细胞死亡率实现其抗氧化活性,不仅佐证了AOS的潜在抗氧化活性,而且为AOS作为天然抗氧化资源的开发利用提供了又一理论依据。而琼二糖、琼四糖和琼六糖的混合物,其混合协同作用及在机体内的作用机制还需进一步研究。

