玫瑰茄花色苷的降解动力学及抗氧化性
,,
(华南理工大学食品科学与工程学院,广东广州 510640)
花色苷广泛存在于植物的花、果实、种子和叶片中,赋予了植物万紫千红的颜色变化。食品中常见的花色苷主要包括6种(天竺葵色素、芍药色素、矢车菊色素、飞燕草色素、锦葵色素和牵牛色素)[1-2]。花色苷易发生降解,其稳定性除了受本身结构的影响外,还与外界因素如温度、pH、光照、抗坏血酸、氧气和金属离子等有关[3]。花色苷降解的途径可能有两种,一是花色苷的C3糖苷键先发生水解,然后其苷元发生水合反应生成花色苷假碱形式,再异构化生成查耳酮及其同分异构体α-二酮;二是花色苷先通过生成假碱葡萄糖苷,然后开环生成查耳酮糖苷,再脱去糖苷生成查耳酮及α-二酮,最后彻底降解成为醛类和酚酸[4-5]。此外,在不同的pH下,花色苷也会发生结构上的转换。在pH<2时,花色苷主要以红色的花色烊阳离子形式存在,当pH为3~6时主要以无色的甲醇假碱和查尔酮假碱的形式存在,而在中性偏碱时,则主要以紫蓝色的醌式碱形式存在[4,6]。随着对花色苷降解机制研究的深入,蛋白质、羧甲基纤维素(Carboxymethylcellulose,CMC)、海藻酸钠和β-环糊精等稳定剂不断被运用到食品药品工业中,为改善花色苷的稳定性提供了新的方法[7]。
玫瑰茄(HibiscussabdariffaL.)原产于西非和印度,是锦葵科本槿属一年生直立草本植物,主要分布于我国广东、福建和台湾等地区。玫瑰茄花萼中含有丰富的花色苷,是制备花色苷的重要原料。据报道,玫瑰茄色素的主要成分是飞燕草素-3-接骨木二糖苷、矢车菊素-3-接骨木二糖苷、飞燕草素-3-葡萄糖苷、矢车菊素-3-葡萄糖苷[8-9]。玫瑰茄花色苷不仅颜色艳丽、无毒副作用,而且具有降血压[10-11]、降血脂[12-13]和抗氧化[14]等功效,因此具有很高的药用价值。
热处理在食品加工中是一种非常普遍和有效的保存饮料的手段,在热加工的过程中可能会导致花色苷发生降解[15]。海藻酸钠和CMC具有良好的食用安全性及生物相容性,是食品工业中应用极其广泛的稳定剂。这些稳定剂能有效地减缓光、热等外界不利因素对花色苷的破坏。本试验对不同pH、温度和添加稳定剂条件下玫瑰茄花色苷热稳定性和抗氧化性进行研究,建立其热降解动力学模型并探究热加工过程中花色苷清除DPPH(1,1-二苯基-2-三硝基苯肼)自由基和ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)自由基能力的变化,为有效控制玫瑰茄花色苷在加热过程中的降解提供理论依据。
1 材料与方法
1.1 材料与仪器
玫瑰茄 采自于湖南高产奇和医药合富农业有限公司,冷冻干燥后备用;AB-8型大孔树脂 天津波鸿树脂科技有限公司;DPPH、ABTS、乙酸钠、氯化钾、无水乙醇、盐酸和氢氧化钠等 分析纯,广州化学试剂批发公司;海藻酸钠、CMC 化学纯,广州卯林仪器有限公司。
DFY-500型中药粉碎机 上海新诺仪器设备有限公司;7110型酸度计 德国WTW;分析天平 欧洲RADWAG;2L-AREI旋转蒸发器 上海皓庄仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市予华仪器有限责任公司;SpectraMax i3x多功能酶标仪 Molecular Devices;层析柱(1.8 cm×30 cm) 上海亚荣生化仪器厂;6000LDI恒流泵 美国康诺(CoMetro);SCIENTZ-10N型真空冷冻干燥机 北京松源华兴生物技术有限公司。
1.2 实验方法
1.2.1 玫瑰茄花色苷冻干粉制备 根据预实验,将玫瑰茄粉碎后过20目筛,按料液比1∶30加入60%乙醇并用磁力搅拌子以200 r/min的速率搅拌30 min,再置于4 ℃冰箱过夜(12 h)。真空抽滤后,用60%乙醇冲洗滤渣至发白,合并两次滤液。40 ℃下旋转蒸发至无乙醇,得到玫瑰茄花色苷浓缩液,冷冻干燥后得到花色苷粗提物。采用AB-8大孔树脂纯化玫瑰茄花色苷,上样浓度和体积分别为600 mg/L和183 mL,进样完全后平衡3 h,再用5倍柱体积的蒸馏水冲洗树脂,后用60%的乙醇洗脱花色苷并收集洗脱液,洗脱流速为1 mL/min。经冻干后得到暗红色的玫瑰茄花色苷纯化物,-20 ℃贮存备用。实验前用蒸馏水将其复溶为玫瑰茄花色苷溶液。
1.2.1.1 花色苷浓度测定 色素浓度的测定采用pH示差法[19],含量由等量矢车菊素-3-葡萄糖苷(Cyd-3-G)表示,计算公式如下:
C=(A×MW×DF×1000)/(ε×1)
式(1)
式中:C为花色苷浓度(mg/L);A为pH1.0时花色苷在520 nm与700 nm的吸光值之差减去pH4.5时花色苷在520 nm与700 nm的吸光值之差;MW为Cyd-3-G的分子量449.2 g/mol;DF为稀释倍数;1000为将单位由g转化为mg的倍数;ε为摩尔消光系数26900 L/(mol·cm);1为比色皿宽度(cm)。
1.2.1.2 色价测定 参考文献[8]并稍作修改,具体为:称取花色苷纯化物0.1 g,用pH1.0氯化钾缓冲液稀释至100 mL,再吸取10 mL,用氯化钾缓冲液稀释至100 mL,在最大吸收波长处测定其吸光值,计算公式为:
色价=A×r/W
式中:A为吸光度;W为样品的质量(g);r为测定吸光度时所吸取样品的稀释倍数。
1.2.1.3 花色苷回收率测定 参考文献[8],花色苷回收率的计算公式如下:
回收率(%)=实际回收花色苷质量/理论回收花色苷质量
1.2.2 pH和温度对花色苷稳定性的影响 参考文献[16]并稍作修改,具体为:称取一定量纯化后的玫瑰茄花色苷冻干粉,用0.2 mol/L Na2HPO4和0.1 mol/L柠檬酸缓冲液配制母液并用氢氧化钠和盐酸调节pH,最终配制成pH分别为1.0、2.0、3.0、4.0、5.0的花色苷溶液(花色苷含量为216.50 mg/L),分装于5个具塞试管中,每个试管中的花色苷溶液体积均为20 mL,分别在80、90、100 ℃下避光加热150 min,每隔30 min测定5组花色苷含量的变化,每个实验重复3次,取平均值。其中为避免溶液在加热过程中水分蒸发而引起浓度变化,每次取样后,标记好水位线,下次取样测量前用相同温度的蒸馏水将花色苷溶液补充至前一次取样后的水位线。
1.2.3 稳定剂对花色苷的影响 分别在烧杯中加入花色苷冻干粉末、CMC或海藻酸钠(稳定剂),加少量蒸馏水并在室温下磁力搅拌20 min,继续加水至固体完全溶解并转移至250 mL容量瓶中进行定容,分别配成0.5%、1.0%和1.5%稳定剂的花色苷胶体溶液(花色苷含量为216.50 mg/L)。各取20 mL于具塞比色管中,分别在80、90和100 ℃下加热150 min。
1.2.4 玫瑰茄花色苷抗氧化性测定
1.2.4.1 DPPH抗氧化能力 根据参考文献[17],具体操作如下:花色苷溶液或Trolox(100 μL)加入到100 μL DPPH(6×10-5mol/L)储备液中,在室温下避光反应30 min。反应结束后,使用酶标仪在517 nm处测量混合物的吸光度值。自由基清除率(%)=(A0-A1)/A0×100,A1为样品溶液吸光度值,A0为空白溶液吸光度值。根据标准曲线计算DPPH自由基清除能力。结果表示为Trolox当量(Trolox equivalent,TE)mg Trolox/mL样品。对照指的是对应pH条件下初始的、未经过加热时溶液的DPPH抗氧化能力。
1.2.4.2 ABTS抗氧化能力 根据参考文献[18],具体操作如下:将7 mmol/L的ABTS+·溶液与2.45 mmol/L的过硫酸钾水溶液混合,制为ABTS+·母液,低温避光保存过夜(12~16 h),使用前用无水乙醇稀释直至在734 nm下吸光度值为0.7±0.02,得到ABTS+·工作液(现用现配)。
花色苷溶液或Trolox(100 μL)加入到100 μL ABTS+·(6×10-5mol/L)工作液中,在室温下避光反应6 min。反应结束后,使用酶标仪在734 nm处测量混合物的吸光度值。自由基清除率(%)=(A0-A1)/A0×100,A1为样品溶液吸光度值,A0为空白溶液吸光度值。根据标准曲线计算ABTS自由基清除能力。结果表示为Trolox当量(Trolox equivalent,TE)mg Trolox/mL样品。对照指的是对应pH条件下初始的、未经过加热时溶液的ABTS抗氧化能力。
1.2.5 降解动力学参数测定 应用一级动力学模拟不同条件下花色苷的降解[20]。动力学公式如下:
一级动力学方程:ln(Ct/C0)=-kt
式(2)
其中:C0为花色苷的初始浓度(mg/mL),t为加热时间(h),Ct为t时刻花色苷的浓度(mg/mL),k为速率常数。
玫瑰茄花色苷半衰期 t1/2(h)计算公式如下:
t1/2=ln0.5/k
式(3)
其中k为速率常数。
利用Arrhenius方程计算活化能如下:
lnk=lnK0-(Ea/RT)
式(4)
其中:Ea是活化能(kJ/mol),R为气体常数8.314 J/mol·K,T为绝对温度(K),K0是频率因子。
花色苷的温度系数Q10计算如下:
Q10=(k1/k2)10/(T1-T2)
式(5)
其中:T为温度(℃),k为T ℃下的降解速率。
1.3 数据处理
2 结果与讨论
2.1 纯化效果分析
如表1所示,纯化后的玫瑰茄花色苷为红色粉末,其色价为43.10±2.17,回收率为83.62%±5.72%,用pH示差法测得冻干粉花色苷含量为(216.50±1.83) mg/g。

表1 花色苷纯化前后品质对比Table 1 Comparison of the quality of anthocyanins before and after purification
2.2 温度对花色苷稳定性的影响
在80~100 ℃温度和不同pH条件下花色苷的降解实验结果见图1。不同pH下花色苷的降解动力学参数见表2。由图1可知,玫瑰茄花色苷在80、90和100 ℃三个温度条件下的降解均符合一级动力学方程,其降解属于裂解反应,即花色苷被裂解为糖基和花色素基元两部分[21]。这与报道文献中黑米[21]、蓝莓[22]花色苷热降解动力学过程研究结果相吻合。花色苷热降解机制为:花色苷首先发生水解或去糖基开环反应,然后形成查耳酮或其同分异构体α-二酮,最后降解为酚酸和醛类[5]。
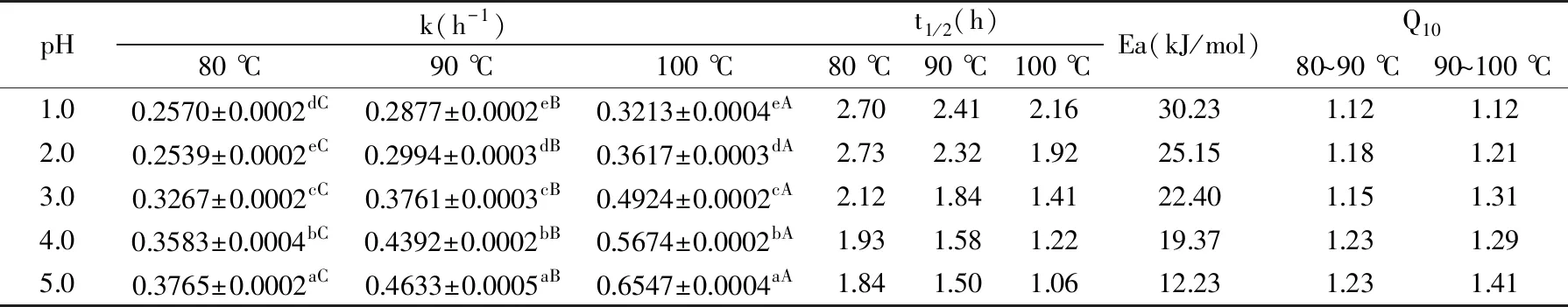
表2 不同pH和温度下花色苷的降解动力学参数Table 2 Degradation kinetics of anthocyanins at different pH values
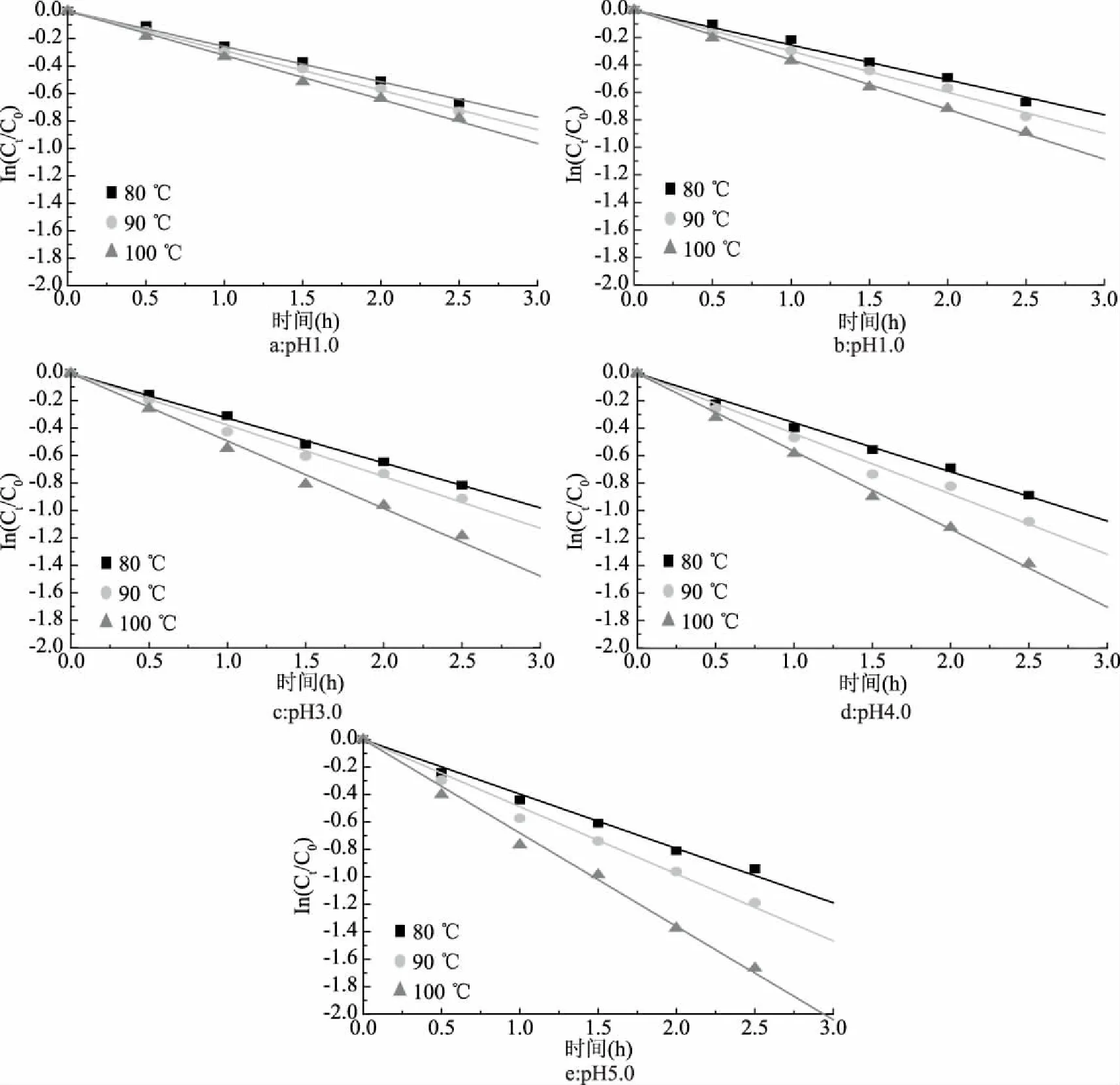
图1 不同pH和温度下花色苷降解动力学Fig.1 Degradation kinetics of anthocyanins under different pH values and temperatures
从图1和表2可知,在所有的pH条件下,玫瑰茄花色苷的降解速率常数均随着温度的升高而增大,半衰期随着温度的升高而减小。从表2可知,在pH2.0、80 ℃和pH5.0、100 ℃时,花色苷分别有最低的降解速率常数(0.2539 h-1)和最高的降解速率常数(0.6547 h-1)。花色苷的温度系数Q10表示温度每升高10 ℃反应速率增大的比例,Q10越大说明温度对降解的影响也越大。pH大于1.0时,在相同pH条件和80~90 ℃条件下,Q10均比90~100 ℃条件下的Q10要小,表明随着温度的升高,玫瑰茄花色苷降解速率增加。在pH1.0时,80~100 ℃条件下花色苷降解速率相同。
2.3 pH对花色苷稳定性的影响
如表2所示,玫瑰茄花色苷降解速率常数随着pH的增加而增加,花色苷的半衰期则呈现减少的趋势。这是由于花色苷可随溶液pH变化而发生结构上的转化。当pH<2时,花色苷主要以红色的2-苯基苯并吡喃阳离子形式存在;pH为3~6时,以无色的甲醇假碱或查尔酮形式存在;pH>8 时,以蓝色的离子化醌式碱形式存在[4,6,23]。在酸性水溶液中,花色苷同时存在酸碱平衡、水和平衡和环-链异构化三种化学平衡。一般而言,在相同的外界条件下,pH越大,花色苷的降解速度越快[6,24]。在本试验中,随着pH增加,花色苷的Q10均逐渐增大(pH2.0例外),表明温度对花色苷的影响随着pH的增加而增加。同时由表2可知,pH1.0和pH2.0 的Q10明显小于pH3.0、pH4.0和pH5.0(pH3.0,80~90 ℃条件下的Q10除外)。这表明pH1.0和pH2.0时温度对花色苷的降解速率影响小于其他pH对其降解的影响。这与文献[25]对桑葚花色苷降解的研究结果相吻合。随着pH从1.0上升到5.0的过程中,玫瑰茄花色苷的Ea逐渐降低,同时pH<3时玫瑰茄花色苷降解速率常数要比pH≥3时要低,表明花色苷在pH<3时稳定,在pH≥3时不稳定。这与前人报道一致,Wang等[26]的研究结果也表明低pH时更有利于蓝莓花色苷的稳定。在不同的pH和温度组合下,花色苷在稳定性方面表现出不同的结果(表2)。pH和温度的综合影响既不是简单的个别效应的累加,也不是它们的线性组合。pH在热处理下稳定花色苷中起着重要的作用。较低的pH有助于降低花色苷的热损伤,特别是在高温处理过程中。然而与pH相比,温度对两种花色苷的稳定性影响较大,由温度升高引起的花色苷的损失比由pH增加引起的损失更大。如在80 ℃条件下,当pH从1.0上升到5.0,玫瑰茄花色苷的解速率常数由0.2570 h-1逐渐增加到0.3765 h-1。而在100 ℃条件下,随着pH从1.0增加到5.0,玫瑰茄花色苷的解速率常数由0.3213 h-1逐渐增加到0.6547 h-1。试验结果表明,温度对花色苷的稳定性的影响大于pH。因此,在食品热加工过程中,应首先考虑将热损失降到最低,然后降低食品的pH。
2.4 稳定剂对花色苷稳定性的影响
图2~图4分别是添加0.5%、1.0%和1.5%稳定剂对花色苷在不同温度下降解的影响,表3为添加海藻酸钠/羧甲基纤维素条件下花色苷的降解动力学参数。从表3可知,在添加了CMC的样品中,花色苷最高的降解速率常数(0.3699 h-1)和最低的降解速率常数(0.0944 h-1)分别在100 ℃和80 ℃时出现,此时CMC的添加量也分别为最低浓度的0.5%和最高浓度的1.5%,说明CMC能提高花色苷溶液的热稳定性。这是由于CMC属于水溶性高分子,在水溶液中CMC分子互相缠绕,其长链分子及数量庞大的支链分子形成无规则线团状态。当与水溶液中其他小分子相遇时能迅速在其表面形成一层致密的包裹层。同时,CMC分子结构产生的空间位阻作用和静电排斥作用使其分子间不能靠近,从而提高了溶液的稳定性[27-28]。李炜[29]发现,在水溶液中添加CMC能有效减轻栀子黄色素的氧化降解反应,CMC分子可在栀子黄色素分子表面形成包裹层,栀子黄色素分子所处的微观环境被改变,氧化离子对栀子黄色素分子的碰撞也大大减少。同样地,海藻酸钠也能提高花色苷溶液的热稳定性。在添加了海藻酸钠的样品中,花色苷的最高的降解速率常数(0.3447 h-1)和最低的降解速率常数(0.0988 h-1)分别在100 ℃和80 ℃时出现,此时海藻酸钠的添加量分别为0.5%和1.5%。因为海藻酸钠属于聚糖醛酸盐,其羧基可与花色苷黄嘌呤阳离子通过静电作用发生缔合,从而提高花色苷的稳定性[30]。在添加同一浓度稳定剂条件下,花色苷的降解速率常数均随着温度的增大而增大。当温度为80~90 ℃时,添加稳定剂组的Q10比空白组大,表明在此温度区间,温度对添加稳定剂组花色苷降解的影响要大于空白组。而当温度为90~100 ℃时,空白组的Q10均比添加稳定剂组大,表明在此温度区间,温度对空白组花色苷降解的影响要大于添加稳定剂组。

表3 添加稳定剂条件下花色苷的降解动力学参数Table 3 Degradation kinetic parameters of anthocyanins added with stabilizers

图2 稳定剂对花色苷在80 ℃时降解的影响Fig.2 Effect of stabilizers on the degradation of anthocyanins at 80 ℃
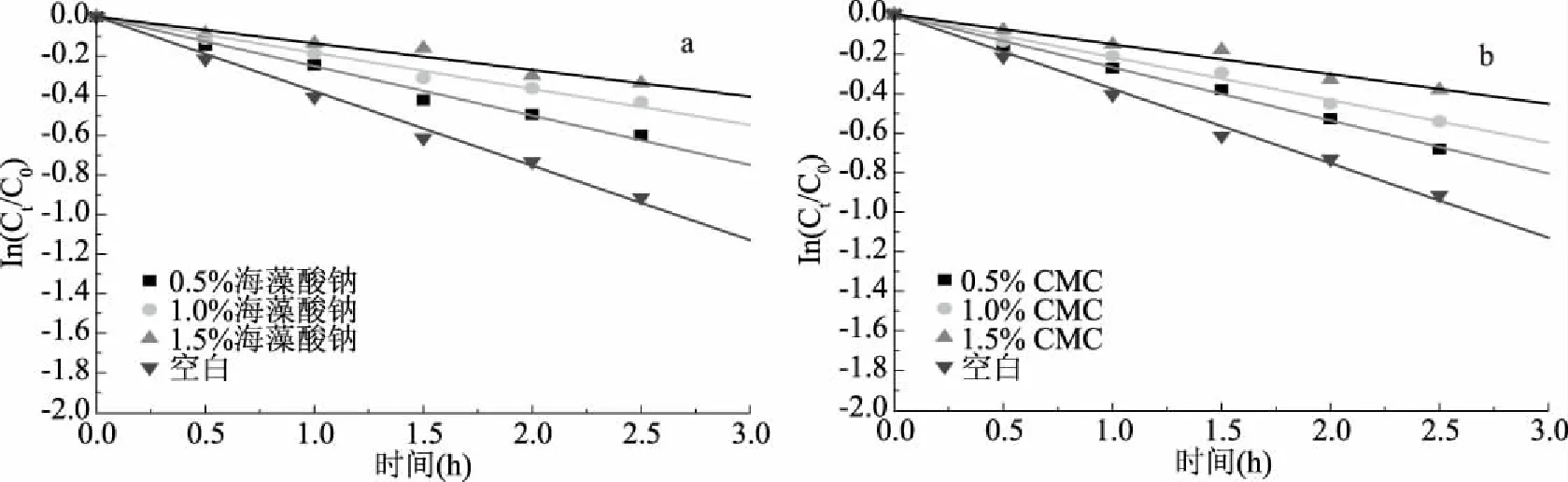
图3 稳定剂对花色苷在90 ℃时降解的影响Fig.3 Effect of stabilizers on the degradation of anthocyanins at 90 ℃

图4 稳定剂对花色苷在100 ℃时降解的影响Fig.4 Effect of stabilizers on the degradation of anthocyanins at 100 ℃
2.5 抗氧化性研究
2.5.1 pH和温度对花色苷溶液抗氧化性的影响 表4和表5分别代表了80、90和100 ℃下花色苷溶液的DPPH和ABTS抗氧化能力。从表4和表5可知,对照花色苷DPPH抗氧化能力为0.453~0.721 mg Trolox/mL,其ABTS抗氧化能力为0.786~0.973 mg Trolox/mL。

表4 不同温度下花色苷溶液的DPPH抗氧化能力(mg Trolox/mL)Table 4 DPPH antioxidant activity of anthocyanin solutions at different temperatures(mg Trolox/mL)
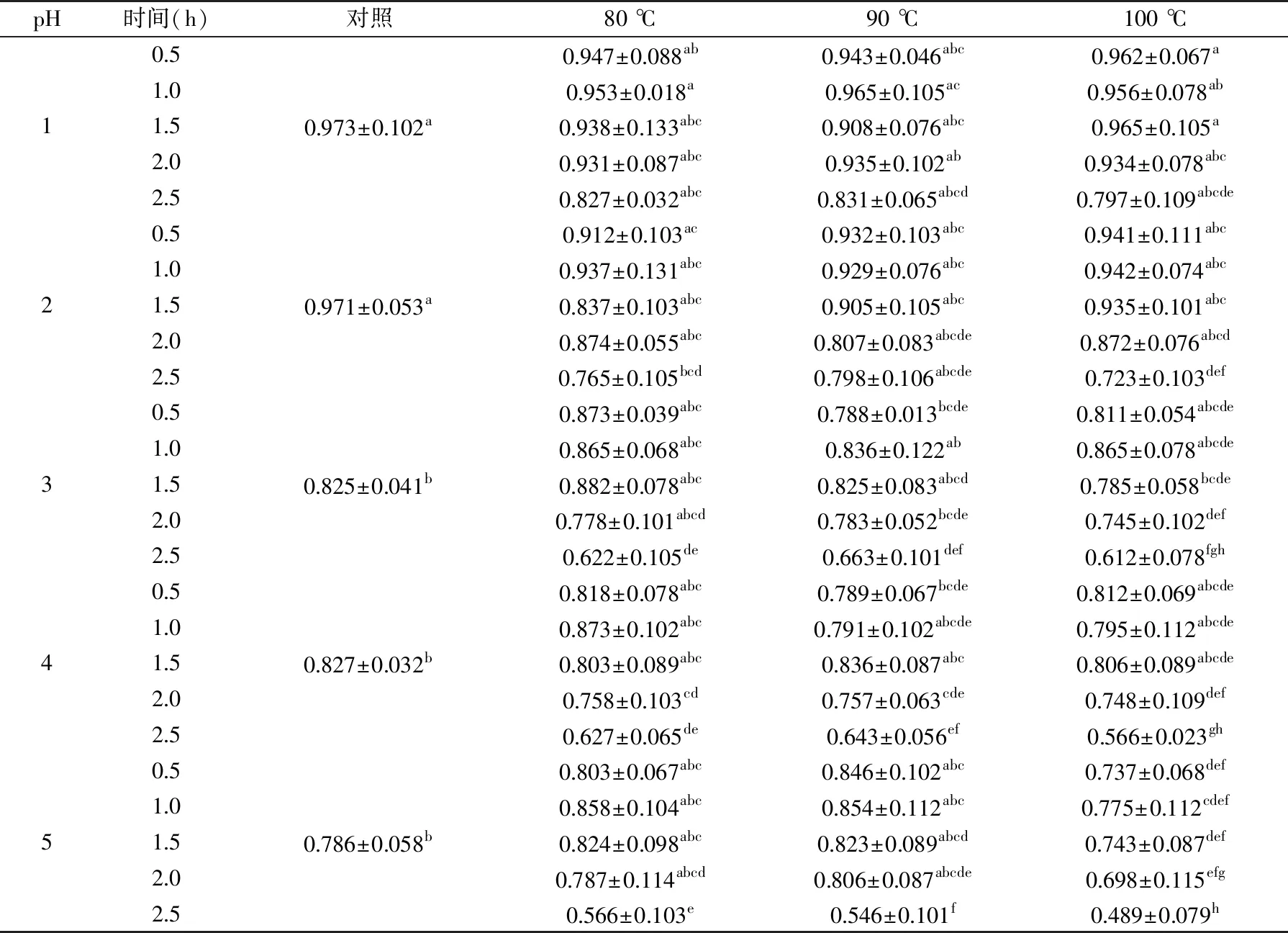
表5 不同温度下花色苷溶液的ABTS抗氧化能力(mg Trolox/mL)Table 5 ABTS antioxidant activity of anthocyanin solutions at different temperatures(mg Trolox/mL)
虽然玫瑰茄花色苷的抗氧化能力在热处理前1.5 h不断波动,但是经过热处理2.5 h后,其体外抗氧化能力相比于对照组样品显著下降(p<0.05)。对于前期抗氧化性的波动起伏,本实验有以下解释。花色苷的一些降解产物,如原儿茶酸(procatechuic acid)、2,4,6-三羟基苯甲醛(phloroglucinaldehyde)和4-羟基苯甲酸(4-hydroxybenzoic acid),可能对维持热处理过程中花色苷的抗氧化能力起到很大的作用[32]。类似研究表明,从紫色马铃薯提取的花色苷在经过100~150 ℃热处理1 h后,其抗氧化能力也没有表现出显著的下降趋势[33]。即在加热的前期过程中,花色苷抗氧化能力的波动有可能是由于其降解产物对其总体抗氧化能力的影响所致。经过热处理2.5 h后,随着花色苷的降解以及温度对降解物一定程度的破坏,花色苷体系的整体抗氧化能力有所下降,因此花色苷的加工过程中要避免长时间的热处理。
pH对玫瑰茄花色苷溶液的抗氧化能力有很强的影响。在本实验中,随着pH的升高,花色苷抗氧化能力呈下降趋势。pH1.0和pH2.0条件下的花色苷溶液具有最高的抗氧化能力,其DPPH和ABTS抗氧化能力分别为(0.703±0.013)、(0.973±0.102) mg Trolox/mL和(0.721±0.034)、(0.971±0.053) mg Trolox/mL。然而在pH5.0时观察到花色苷溶液具有较低的抗氧化能力,其DPPH和ABTS抗氧化能力分别为(0.453±0.037) mg Trolox/mL和(0.786±0.058) mg Trolox/mL。这可能是由于花色苷在不同的pH条件下具有不同的结构所致,对于玫瑰茄花色苷来说,在更低的pH条件下花色苷的形式在清除自由基方面可能更有效。
因此需要通过进一步研究将不同形式的花色苷的含量与总抗氧化能力联系起来。然而,Sui等[16]发现随着pH的升高,黑米花色苷溶液的抗氧化能力呈上升趋势,而且当溶液pH=2.2时,所有温度条件下(100、121、135、145、165 ℃)均具有最低的抗氧化能力。这可能是由于不同的花色苷的性质导致的差异。
2.5.2 稳定剂对花色苷溶液抗氧化性的影响 表6和表7分别代表了80、90和100 ℃下花色苷溶液的DPPH和ABTS抗氧化能力。从表6和表7可知,添加稳定剂能减缓高温对玫瑰茄花色苷的总抗氧化能力的影响。添加了海藻酸钠和CMC的溶液中,经过2.5 h的加热后,其DPPH和ABTS抗氧化能力均比空白组高。同时,随着稳定剂浓度的逐渐加大,花色苷溶液的抗氧化能力有增大的趋势。同样添加量下,海藻酸钠对花色苷溶液抗氧化性的稳定效果较CMC好。这与Mourtzinos等[31]的研究相似,该研究表明,β-环糊精能与花色苷通过络合而改善了玫瑰茄花色苷的热稳定性以及更好地保留了花色苷的抗氧化性。

表6 不同温度下添加稳定剂花色苷溶液的DPPH抗氧化能力(mg Trolox/mL)Table 6 DPPH antioxidant activity of anthocyanin solutions added with stabilizers at different temperatures(mg Trolox/mL)
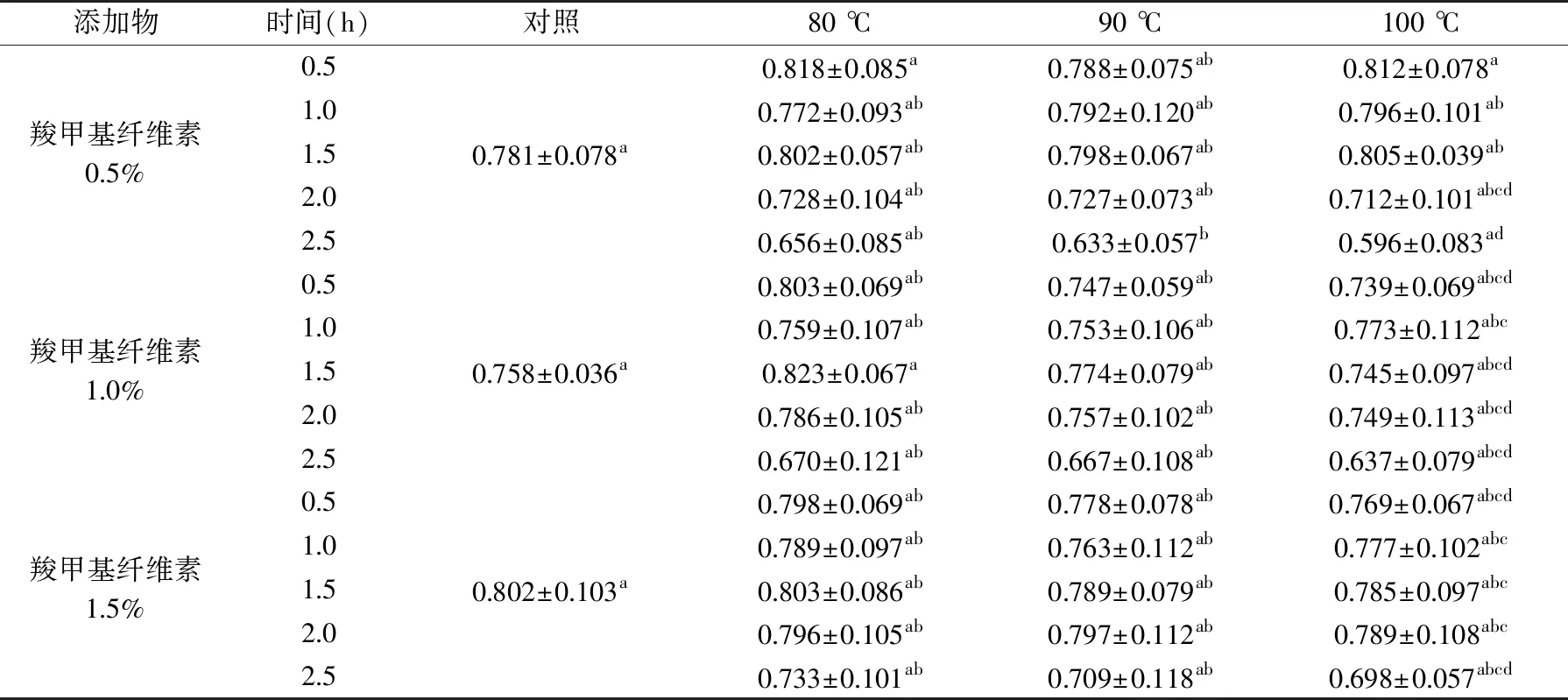
续表

表7 不同温度下添加稳定剂花色苷溶液的ABTS抗氧化能力(mg Trolox/mL)Table 7 ABTS antioxidant activity of anthocyanin solutions added with stabilizers at different temperatures(mg Trolox/mL)
3 结论
温度和pH均影响着玫瑰茄花色苷的稳定性,且温度对花色苷的稳定性的影响更大。总体而言,玫瑰茄花色苷在pH1.0和pH2.0的条件下,其热稳定性更强。在80、90和100 ℃条件下,玫瑰茄花色苷热降解均符合一级动力学模型,在同一pH下,其降解速率随着温度的升高而增大,半衰期随着温度的升高而减小。80、90和100 ℃下加热2.5 h后,花色苷的抗氧化能力均出现下降。同一温度下,在添加了稳定剂的溶液体系中,花色苷的降解速率随着稳定剂添加量的增加而减小,海藻酸钠和CMC能有效保护花色苷不被热分解,相比于CMC,海藻酸钠对花色苷的保护效果更好。以上结果提示,在食品工业生产中,为减少热杀菌过程中玫瑰茄花色苷的降解,可采用巴氏杀菌来对玫瑰茄花色苷溶液进行灭菌处理,并尽量将其pH调控在pH3.0以内。当灭菌温度高于80 ℃,灭菌时间应适当缩短。此外,还可考虑在花色苷溶液中添加适量海藻酸钠来提高其热稳定性。

