猪miR-149靶基因预测及生物信息学分析
张家庆,武松霞,任巧玲,王献伟,陈俊峰,王 璟,白献晓,邢宝松
(1.河南省农业科学院 畜牧兽医研究所,河南 郑州 450002; 2.河南省标准化研究院,河南 郑州 450008; 3.河南省畜牧总站,河南 郑州450008)
猪的繁殖力是养猪生产中一项重要的经济指标,直接影响养猪成本和经济效益的高低。而产仔数是繁殖性状中最重要的性状,也是决定猪场经济效益的关键因素。据著名动物数量遗传学家Chris计算,如果产仔数每胎提高1头,英国养猪业每年就可多获纯利7亿英镑,相应地计算,在我国则每年将增收上百亿元的纯利[1]。因此,找到影响产仔数的基因具有重要的经济及科研价值。但是猪繁殖性状属于限性表达的低遗传力性状,运用常规育种方法很难取得理想的遗传进展[2]。从生殖的角度来看,猪窝产仔数的高低主要取决于排卵数和胚胎成活率,而排卵率是窝产仔数的第1个限制因素,决定了窝产仔数的上限。因此,增加排卵数量是提高窝产仔数的有效途径。
猪是多胎动物,在正常发情周期中每次募集的卵泡数超过50个,但仅有10~25个卵泡可发育至成熟并排卵,约有50%的中等卵泡(3~6 mm)在选择过程中发生闭锁[3-4]。目前的研究表明,卵泡闭锁的实质是颗粒细胞的凋亡,已发现许多基因对颗粒细胞凋亡具有直接或间接的调控作用[5]。MicroRNA(miRNA)是一类长度为21~23 bp的非编码RNA,可通过抑制靶基因的翻译或降解目的基因mRNA来反向调节目的基因的表达[6]。近年来,众多研究表明,miRNA在卵泡发育和闭锁中起着重要的调控作用[7]。例如,研究人员发现,小鼠中的miR-21作为一种抗凋亡因子,能抑制排卵期颗粒细胞的凋亡[8];雄激素可上调miR-125b的表达,进而抑制促凋亡蛋白表达并促进卵泡发育[9];miR-133b可靶向插头转录因子12(Forkhead box12,Fox12)促进颗粒细胞中雌二醇的合成[10]。在猪颗粒细胞凋亡中,LIU等[11]研究表明,过表达胞浆内信号级联分子SMAD4(Similar to mothers against decapentaplegic homologue-4)可促进颗粒细胞增殖,敲减SMAD4基因则可促进颗粒细胞凋亡,而过表达或抑制miR-26b能显著抑制或促进颗粒细胞中SMAD4基因的表达,表明miR-26b可通过靶向SMAD4基因发挥促凋亡的调控作用;WANG等[12]研究表明,FOXO3(Forkhead box O3,FOXO3)转录因子在猪颗粒细胞凋亡中发挥关键作用,而miR-34c可靶向FOXO3来调控猪颗粒细胞的功能[13]。近年来,大量人类疾病相关miRNA的研究表明,miR-149参与了炎症、凋亡、肺纤维化等关键过程[14],并具有抵御外界应激和抗凋亡的功能[15]。而炎症、凋亡相关因子是诱发卵泡闭锁的重要因素。目前,有关miR-149对猪颗粒细胞凋亡的影响机制尚不清楚,因此,利用生物信息学的方法对ssc-miR-149进行转录因子结合位点预测、物种间保守性分析、靶基因预测、靶基因GO和KEGG信号通路富集分析,揭示其可能存在的转录因子,以及靶基因参与调控的生物过程和信号通路,进而对其在猪颗粒细胞凋亡中的功能进行探索,为ssc-miR-149在猪卵泡闭锁中的研究提供理论指导。
1 材料和方法
1.1 主要试剂和仪器
反转录酶M-MLV、荧光定量PCR Mix(TaKaRa生产);miRNA提取试剂盒、TaqMan miRNA反转录试剂盒、反转录引物、定量PCR引物和U6SnRNA(哈尔滨新海基因检测有限公司);miRNA拟似物、抑制物(上海吉玛制药技术有限公司合成);MTT试剂盒(南京建成生物工程研究所生产);TRIZOL、Lipofectamine2000(Invitrogen生产);F12培养基、抗生素(GIBCO生产);mRNA 定量PCR引物(上海生工公司合成);实时荧光定量PCR仪(Roche生产);核酸蛋白检测仪(NANODROP生产)。
1.2 猪颗粒细胞分离与培养
供试卵巢采自于郑州市惠济区屠宰场体质量约为(115±5)kg的商品母猪。选择屠宰后处于卵泡期且发育良好的卵巢,取下后立刻放入含有双抗(青霉素100 IU/L、链霉素50 mg/L)的37 ℃生理盐水中,暂存于保温瓶,并于1~2 h内进行后续操作。用含有双抗的生理盐水清洗卵巢3次后,用10 mL注射器选择直径为3~5 mm的卵泡进行颗粒细胞采集,并将其置于15 mL离心管中,1 000 r/min离心5 min以去除卵泡液。所得颗粒细胞沉淀用PBS洗涤2次,每次洗涤后以1 000 r/min离心5 min,然后弃除PBS。用1 mL含有胎牛血清和双抗体积分数为10%的DMEM/F12完全培养基重悬颗粒细胞,将1 mL的颗粒细胞悬液接种于T25培养瓶中(已提前放置培养箱内预热),于37 ℃、5%CO2培养箱中培养。
1.3 miR-149 mimic转染及H2O2氧化损伤处理猪颗粒细胞
将生长对数期的猪颗粒细胞消化混匀成1×106~1.5×106个/mL的细胞悬液,取0.2 mL接种至96孔板内,培养6~12 h后进行转染(此时所用培养基不含双抗),按照Lipofectamine2000转染说明书进行。转染分组如下:空白对照组(Blank),即未转染组;阴性对照组(NC),即miR-149-NC空载体转染组;转染miR-149 mimic组。转染48 h后,所有组别均用150 μmol/L H2O2处理6 h。qPCR检测中ssc-miR-149引物序列为:正向5′-UCUGGCUCCGUGUCUUCACUCCC-3′,反向5′-GAGUGAAGACACGGAGCCAGAUU-3′;NC引物序列为:正向5′-UUCUCCGAACGUGUCACGUTT-3′,反向5′-ACGUGA
CACGUUCGGAGAATT-3′。
1.4 MTT分析
按照1.2和1.3中方法进行细胞培养与转染,然后按照MTT试剂盒操作说明书对细胞进行处理,利用全波长酶标仪测定570 nm处的吸光度。
1.5 荧光定量PCR检测
按照miRNA 提取试剂盒提取miRNA,并用核酸蛋白检测仪检测纯度和浓度,符合要求的miRNA进行qRT-PCR检测。采用TRIZOL法提取猪颗粒细胞的总RNA,通过1%琼脂糖凝胶电泳检测RNA,核酸蛋白检测仪检测相应纯度和浓度,将符合要求的RNA使用反转录酶M-MLV进行反转录,然后进行qPCR检测。扩增体系为20 μL:cDNA 2 μL,上下游引物(10 μmol/L)各0.8 μL,2×SYBR ExTaqⅡ 10 μL,dH2O 6.4 μL;扩增程序为:94 ℃ 3 min;95 ℃ 10 s,60 ℃ 30 s,40个循环。本研究采用相对定量qPCR法,miRNA的内参基因为U6SnRNA,mRNA内参基因为GAPDH。PUMA基因扩增引物序列为F:5′-GGATGGCTGACGATCTCA-3′;R:5′-TGGGTAAGGGCAGAAGTC-3′,产物大小为120 bp,其他引物序列参照已发表文献[16-17]。
1.6 ssc-miR-149生物信息学分析
1.6.1 ssc-miR-149转录因子结合位点(TFBS)预测 利用Ensembl和NCBI数据库分别检索ssc-miR-149基因前体,然后取其上游2 000 bp的序列,分别应用JASPAR(http://jaspardev.genereg.net/)和PROMO(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)2个在线预测软件对ssc-miR-149进行TFBS预测。
1.6.2 ssc-miR-149物种间保守性分析 从miRBase(http://www.mirbase.org/search.shtml)中检索出野猪(Susscrofa)、人(Homosapiens)、小鼠(Musmusculus)、黑猩猩(Pantroglodytes)、牛(Bostaurus)、猕猴(Macacamulatta)、狗(Canisfamiliaris)的ssc-miR-149序列,分析其保守性。
1.6.3 ssc-miR-149靶基因预测 为了探索ssc-miR-149的生物学功能,选择TargetScan(http://www.targetscan.org/vert_71/)、miRanda(http://www.microrna.org/microrna/getGeneForm.do)和RNAhybrid(http://bibiserv.cebitec.uni-bielefeld.de/rnahybrid/)3个软件对ssc-miR-149进行靶基因预测。最后取3个软件的交集,并结合miR-149的靶基因,共同组成ssc-miR-149的靶基因集合,用于下一步的研究分析。
1.6.4 靶基因GO富集性分析 利用DAVID工具[18](https://david-d.ncifcrf.gov/)对ssc-miR-149预测的靶基因集合进行分子功能(Molecular function,MF)、所处的细胞位置(Cellular component,CC)、参与的生物过程(Biological process,BP)3个层面的GO注释层次分类及富集分析,通过Fisher’s exact test计算得到P值,以P<0.05为阈值,获得显著富集的靶基因GO条目。
1.6.5 靶基因KEGG信号通路富集性分析 在DAVID网站中选择“Pathways”下的“KEGG_PATHWAY”对ssc-miR-149预测的靶基因集合进行生物学通路富集分析,通过Fisher’s exact test计算得到P值,以P<0.05为阈值,获得显著富集的KEGG信号通路。
1.7 数据处理
利用2-ΔΔCt方法计算各目的基因的相对表达量,计算方法参照文献[19]。采用SPSS 17.0软件one-way ANOVA方法进行差异显著性检验,以平均值±标准误表示。
2 结果与分析
2.1 过表达ssc-miR-149对H2O2诱导猪颗粒细胞氧化损伤的保护作用
如图1A所示,与对照组相比,猪颗粒细胞经H2O2(150 μmol/L)处理6 h,ssc-miR-149的表达量极显著降低。由图1B可知,与Blank(未转染组)相比,猪颗粒细胞经H2O2(150 μmol/L)处理6 h,其细胞活性极显著下降;与NC(空载体转染组)相比,ssc-miR-149过表达组能极显著提高细胞活性。根据图1C可知,与Blank(未转染组)相比,H2O2处理组中凋亡相关基因(Caspase-3、FAS和PUMA等)表达水平极显著升高;而与NC(空载体转染组)相比,ssc-miR-149过表达组的凋亡相关基因(Caspase-3、FAS和PUMA)表达水平极显著或显著降低。这表明过表达ssc-miR-149可部分抑制H2O2诱导的凋亡相关基因的表达,从而对氧化应激诱发的猪颗粒细胞凋亡具有保护作用。
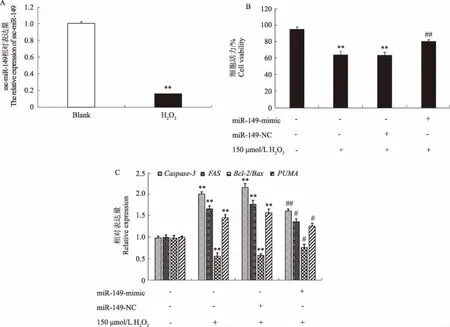
A.H2O2处理对猪颗粒细胞中ssc-miR-149表达量的影响;B.过表达ssc-miR-149对H2O2处理下猪颗粒细胞活力的影响;C.过表达ssc-miR-149对H2O2诱导猪颗粒细胞凋亡相关基因表达的影响。与Blank对照组相比,**表示差异极显著(P<0.01);与NC对照组相比,##表示差异极显著(P<0.01),#表示差异显著(P<0.05)A.Effects of GC treated with H2O2 on expression of ssc-miR-149; B.Effects of the viability of ssc-miR-149 overexpressing on H2O2-induced porcine granulosa cells; C.Effects of ssc-miR-149 overexpressing on porcine granulosa cell apoptotic genes wich induced by H2O2.**.Very significant difference (P<0.01) compared with Blank control group; ##.Very significant difference (P<0.01) compared with NC control group; #.Significant difference (P<0.05) compared with NC control group图1 过表达ssc-miR-149对H2O2诱导猪颗粒细胞氧化损伤的影响Fig.1 Effects of the ssc-miR-149 overexpressing on porcine granulosa cells apoptosis induced by H2O2
2.2 ssc-miR-149转录因子结合位点
利用2种在线软件分别对ssc-miR-149的前体(表1)上游2 000 bp区域进行转录因子结合位点预测分析,发现它们的启动子区域具有转录因子SP1、转录因子p53、核因子kappa B(Nuclear factor kappa B,NFκB)、肌分化因子(Myogenic differentiation,MyoD)、增强子激活结合蛋白2(Activating enhancer binding protein 2,AP-2)、伤害性信息与即刻早期基因c-fos、低氧诱导因子-1(Hypoxia inducible factor-1,HIF-1)、原癌基因C-Jun、转录共激活因子p300、信号传导及转录激活因子(Signal transducers and activators of transcription,STAT)、CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein alpha,C/EBPα)等多个转录因子结合位点,其中SP1、p53、NFκB、c-fos、HIF-1等均参与了细胞凋亡的调控。

表1 ssc-miR-l49的前体信息Tab.1 Information of ssc-miR-149 precursor
2.3 ssc-miR-149物种间保守性
利用miRBase对7个哺乳动物成熟的miR-149搜索发现,不同动物的miR-149具有共同的“种子区”(CUGGCUC)(表2),其碱基序列在各物种中呈现高度保守性。
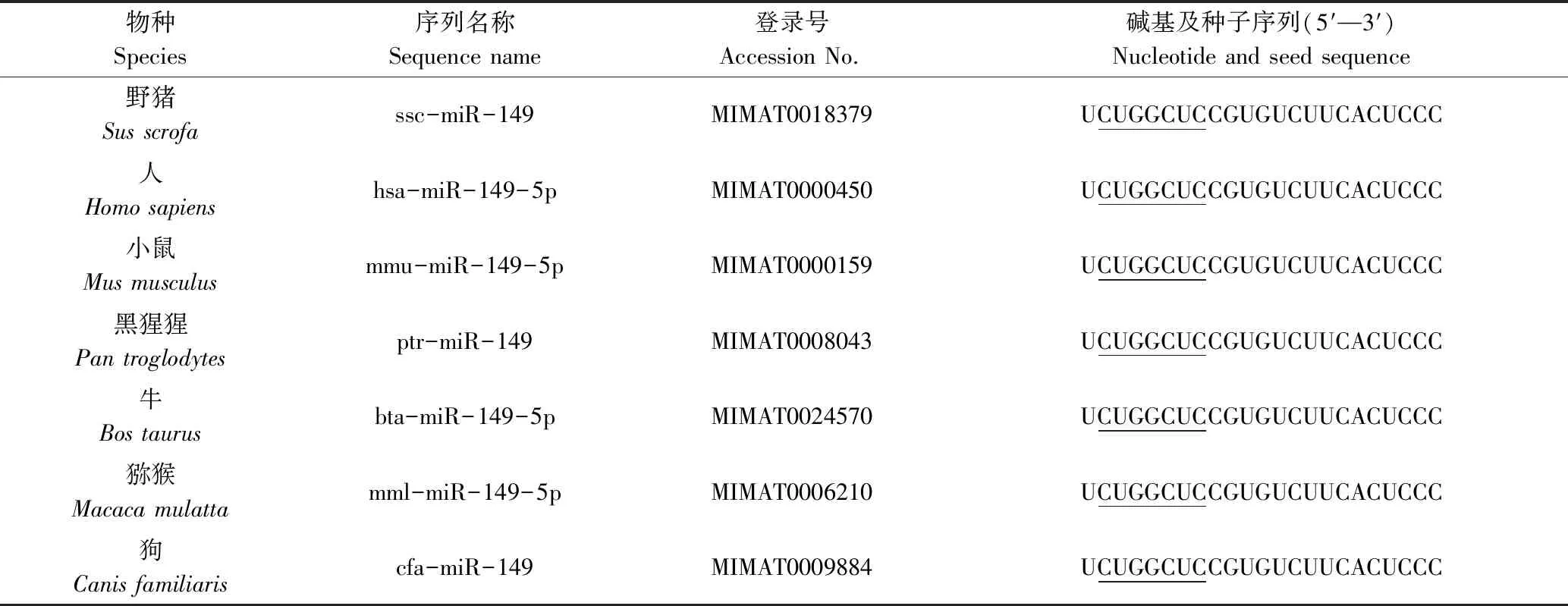
表2 不同物种成熟的miR-149及种子序列 Tab.2 Mature sequences of miR-149 and seed sequences from different species
注:划线部分表示共同的碱基序列。
Note:The underlined portion indicates a common base sequence.
2.4 ssc-miR-149的靶基因
选择TargetScan、miRanda和RNAhybrid 3种计算方法预测ssc-miR-149的靶基因,取预测结果交集,同时结合文献中报道的靶基因,总共获得793个基因,作为后续GO和KEGG分析的靶基因集合,部分靶基因见表3。同时,从中筛选出了ssc-miR-149与细胞凋亡相关的靶基因PUMA/BBC3(p53 upregulated modulator of apoptosis)、FAF1(Fas associated factor 1)和Caspase-9(Cysteine-containing aspartate-specific proteases 9),具体的结合位点见图2。
表3 ssc-miR-149的部分靶基因统计Tab.3 Statistics on some target genes of ssc-miR-149

图2 ssc-miR-149与PUMA、FAF1、Caspase-9基因在3′UTR的结合位点预测Fig.2 The prediction of binding sites betweenssc-miR-149 and PUMA,FAF1,Caspase-9 at 3′UTR
2.5 GO靶基因富集分析结果
针对上述793个相应靶基因进行GO注释分类和富集分析,结果如表4—6所示。在生物学过程(BP)层面,ssc-miR-149靶基因主要富集于细胞黏附调控、雌二醇分泌正调控、细胞迁移负调控等相关GO条目中(P<0.05);在分子功能(MF)层面,靶基因主要富集于锌离子结合、ATP结合、泛素蛋白连接酶活性等相关的GO条目中(P<0.05);在细胞组分(CC)层面,靶基因显著富集于胞液、溶酶体膜、细胞间连接、突触体等相关的GO条目中(P<0.05)。
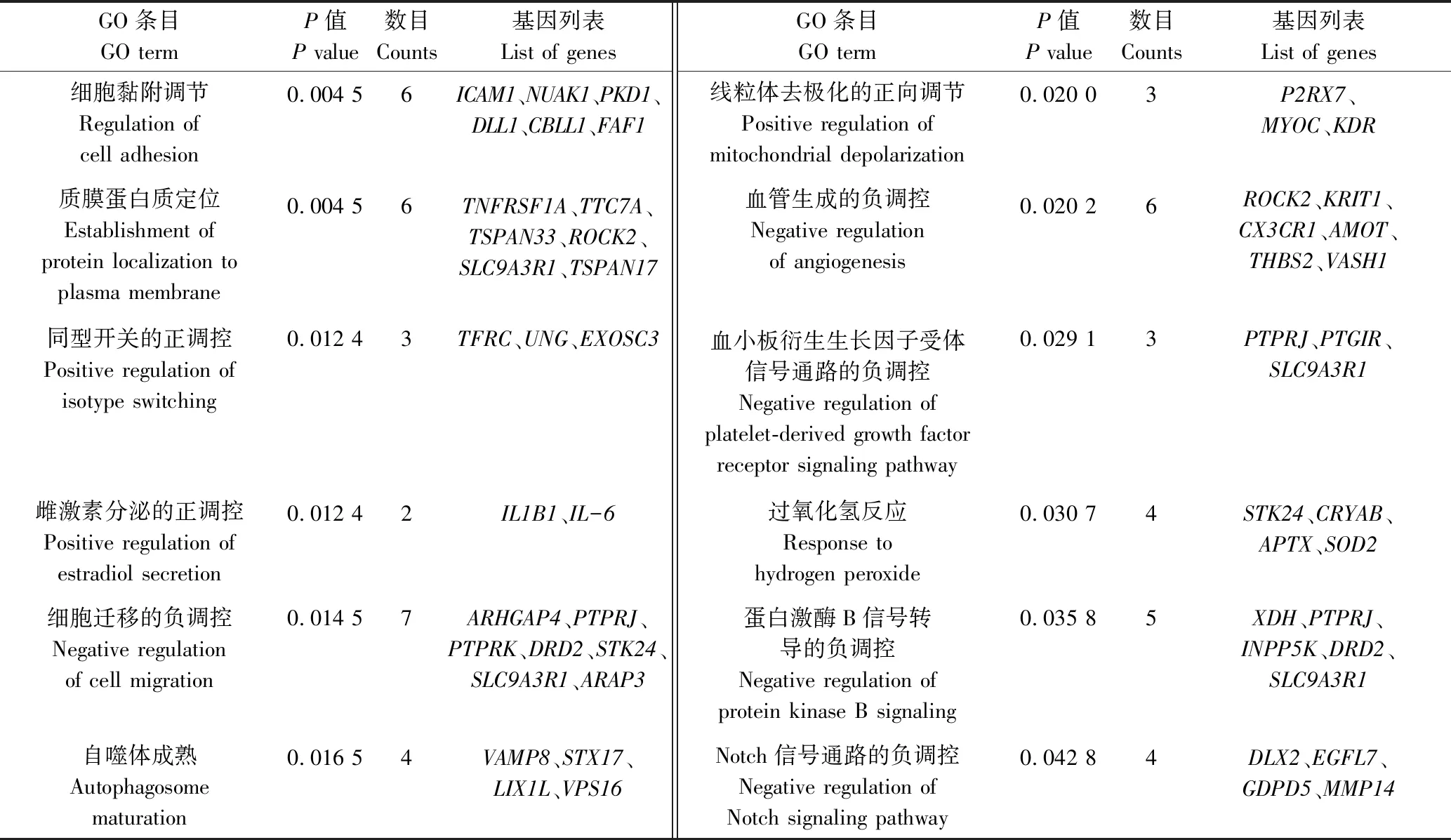
表4 ssc-miR-149靶基因在生物学过程(BP)层面富集结果(前12个)Tab.4 Enrichment results of ssc-miR-149 target genes in BP level (top 12)
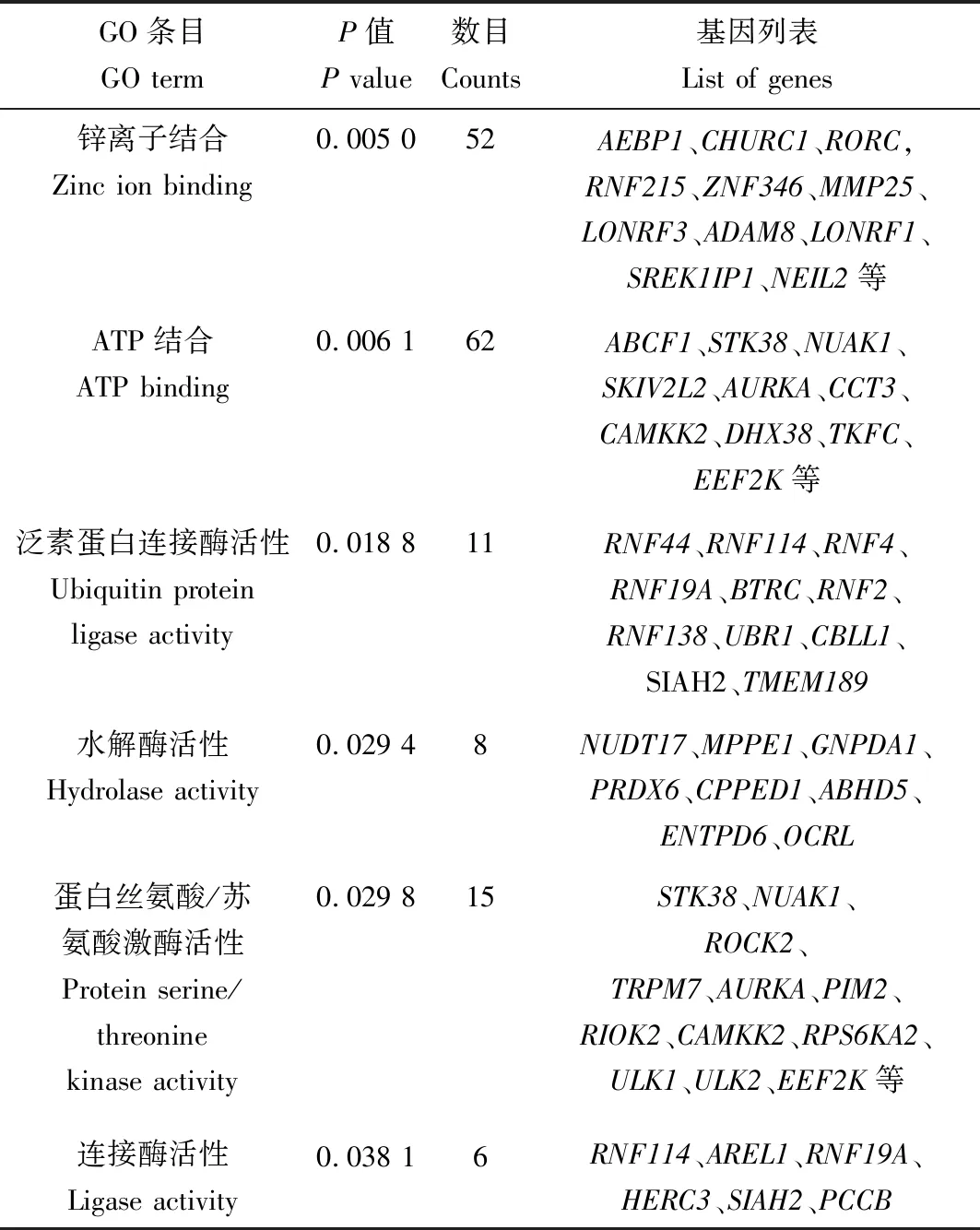
表5 ssc-miR-149靶基因在分子功能(MF)层面富集结果Tab.5 Enrichment results of ssc-miR-149target genes in MF level
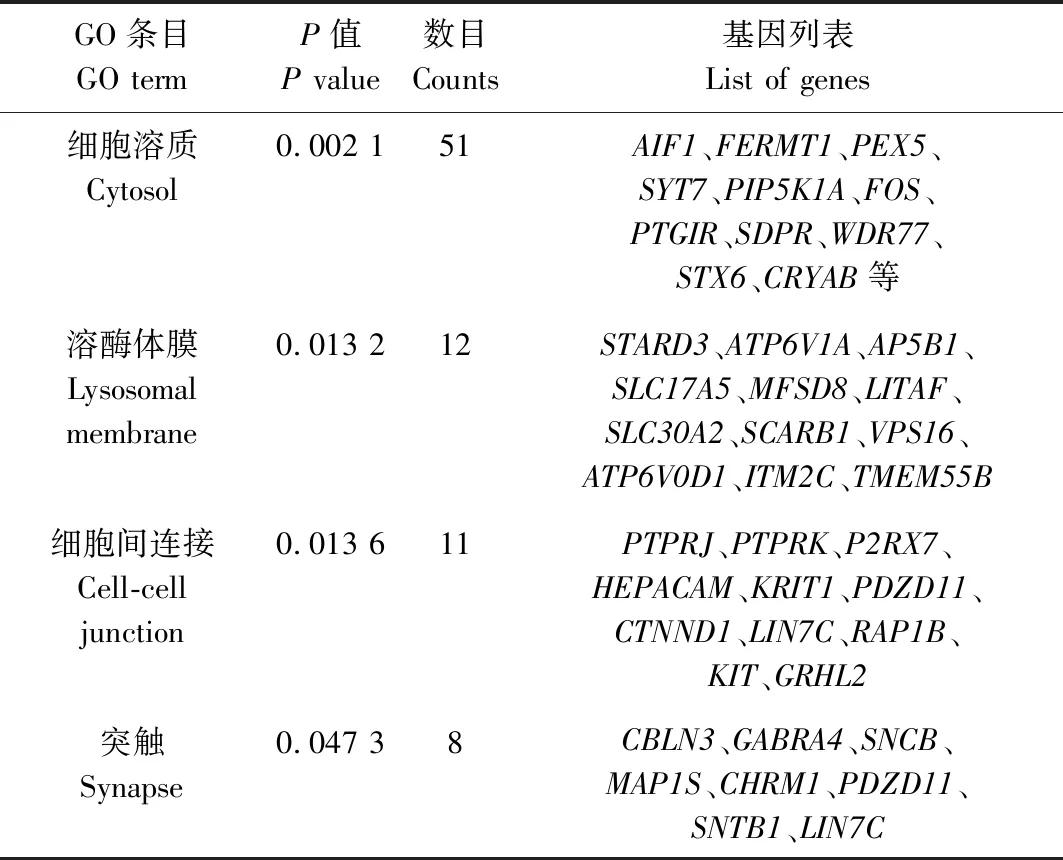
表6 ssc-miR-149 靶基因在细胞组分(CC)层面富集结果Tab.6 Enrichment results of ssc-miR-149target genes in CC level
2.6 KEGG信号通路富集结果
为进一步探索ssc-miR-149的功能,在GO注释基础之上,利用DAVID中“Pathways”下的“KEGG_PATHWAY”对ssc-miR-149预测的靶基因集合进行生物学通路富集分析发现,ssc-miR-149靶基因显著富集于TNF信号通路、磷脂酰肌醇信号系统、Rap1信号通路、RNA降解、卵子减数分裂、NOD样受体信号通路等(P<0.05)(表7)。其中,TNF信号通路、Rap1信号通路和NOD样受体信号通路是与凋亡和炎症相关的通路,故推测ssc-miR-149可能参与了凋亡和炎症的调控。

表7 ssc-miR-149预测靶基因的KEGG信号通路数据库富集分析结果(前10个)Tab.7 KEGG enrichment results of ssc-miR-149predicted target genes (top 10)
3 结论与讨论
本研究通过对ssc-miR-149在猪颗粒细胞凋亡中的功能进行探索,挖掘出Caspase-9、PUMA/BBC3、FAF1、IL-6、ULK1、ULK2、ATG4C、CCNI等关键靶基因以及TNF信号通路、Rap1信号通路、NOD样受体信号通路等。通过初步研究并结合相关研究报道,推测ssc-miR-149可能通过靶向Caspase-9、PUMA/BBC3、FAF1对猪颗粒细胞凋亡发挥重要作用,这为今后有关ssc-miR-149的后续研究提供了一定的数据支持和理论指导。
miRNA广泛存在于动物组织和细胞内,在转录组水平上大约有60%的基因被调控修饰过,因此,miRNA的作用相当广泛且重要,它与众多生理学过程密切相关,如分化、增殖、凋亡与发育等[20]。目前,关于miR-149的功能研究多集中在癌症方面。WANG等[21]研究发现,在胃癌中miR-149靶向调控锌指蛋白437(Zinc finger and BTB domain-containing protein 2,ZBTB2),可阻断细胞周期来抑制癌细胞的增殖;PAN等[22]研究证实,miR-149可通过阻断蛋白激酶B(Protein kinase B,AKT1)信号通路来抑制胶质瘤细胞的增殖和侵袭;在乳腺癌中,miR-149亦可通过靶向调控G蛋白偶联受体激酶相互作用蛋白1(G protein-coupled receptor kinase-interactor 1,GIT1)来抑制整合素信号通路,从而影响乳腺癌的转移[23];miR-149还可调控转录因子叉头盆蛋白质M1(Forkhead box protein M1,FOXM1)来抑制结直肠癌细胞迁移和侵袭[24];在卵巢癌细胞中,miR-149能靶向作用于X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)来抑制癌细胞增殖和提高其对铂化合物的敏感性[25]。通过这些研究可知,miR-149是调控癌症细胞增殖和凋亡的关键因子,因此,推测它可能在猪颗粒细胞的增殖和凋亡中也起到了重要作用。
利用miRBase在线数据库检索了野猪、人、小鼠、黑猩猩、牛、猕猴、狗共7个哺乳动物中成熟的miR-149序列发现,这7个物种均具有相同且高度保守的种子序列(CUGGCUC),提示此miRNA可能具有重要的生物学功能。通过整合Targetscan、miRanda和RNAhybrid靶标预测软件结果的交集,ssc-miR-149调控着凋亡、炎症、自噬、细胞周期相关基因的表达,如Caspase-9、PUMA/BBC3、FAF1、IL-6、ULK1、ULK2、ATG4C、CCNI等。生物学通路富集分析显示,ssc-miR-149调控着炎症、凋亡、增殖等相关信号通路,包括TNF信号通路、Rap1信号通路、NOD样受体信号通路等,由此推测ssc-miR-149可能在氧化应激或脂多糖(Lipopolysaccharide,LPS)所致的猪颗粒细胞凋亡及炎症中发挥着非常重要的作用。ssc-miR-149对猪颗粒细胞凋亡的负调控作用是通过靶基因如Caspase-9、PUMA/BBC3、FAF1等的抑制作用来实现的。PUMA/BBC3是近年来发现的促凋亡作用最强的BH3-only蛋白家族成员之一,在细胞凋亡中发挥着重要作用[26-27]。众多研究表明,PUMA是细胞凋亡途径的重要分子,也是应激导致细胞凋亡的重要靶点[28-29]。LIU等[30]研究发现,氧化应激诱导小鼠颗粒细胞凋亡时,可显著上调PUMA蛋白的表达量。DING等[15]研究证实,在氧化应激诱导体外培养的小鼠心肌细胞发生凋亡时,PUMA表达量显著上调,而过表达miR-149能促进小鼠心肌细胞的存活,敲减miR-149能使其对凋亡刺激更为敏感。因此,进一步探明调控PUMA表达的上游因子及其在猪颗粒细胞凋亡过程中的分子机制,很可能成为一种新的研究方向或突破点。FAS也称CD95或Apo-l,是肿瘤坏死因子和神经生长因子受体(TNF/NGF-R)家族的细胞表面分子,是FASL的受体;FAS/FASL的结合能够诱导细胞凋亡的发生。FASL是肿瘤坏死因子家族(TNF superfamily)的一员,也FAS的天然配体,并且FAS与FASL的交联激活是导致细胞凋亡的重要途径之一[31]。FAF1是近年来新发现的一种能够增强FAS诱导凋亡作用的蛋白质,而XIAP是新发现的一个IAP家族中的成员,是最强的凋亡抑制因子,CABALLERO-LPEZ等[32]研究发现,XIAP可通过抑制Caspase活性从而抑制FAF1介导的凋亡。Caspase-9作为Caspase家族中最重要的起始因子,在线粒体通路凋亡的启动中发挥重要作用,在猪颗粒细胞中,MATSUI等[33]研究表明,Caspase-9的表达及活性在猪卵泡闭锁中起着关键的调控作用。IL-6是一种炎症因子,是炎症介质网络的关键成分,在炎症反应中起重要作用[34],在FAN等[35]构建的SiO2粉尘诱导小鼠肺纤维化模型中,miR-149可负调控细胞中IL-6的表达水平。TIAN等[36]研究发现,miR-149可靶向FASLG,而抑制miR-149可诱导急性骨髓白血病细胞系凋亡。根据这些研究报道,可推测在猪颗粒细胞中,ssc-miR-149通过对TNF信号通路、Rap1信号通路、NOD样受体信号通路中相关靶基因的靶向抑制,影响这些通路信号的传递,从而影响猪颗粒细胞的增殖和凋亡过程。
近年来众多研究表明,卵泡中颗粒细胞凋亡是导致卵泡闭锁的主要原因,而氧化应激是诱发颗粒细胞凋亡的重要因素[37]。miR-149具有抵御外界应激和抗凋亡的功能,也是调控PUMA表达的关键miRNA,这在小鼠研究中已得到证实[15]。H2O2是一种常用的氧化剂,已被广泛用于诱导颗粒细胞凋亡[38-39]。本研究采用H2O2诱导猪颗粒细胞凋亡,探究过表达ssc-miR-149对其诱导猪颗粒细胞氧化损伤的保护作用。研究发现,猪颗粒细胞经氧化应激处理后活性显著降低,但通过在猪颗粒细胞内过表达ssc-miR-149,能够显著提高颗粒细胞的存活率,可以有效抑制H2O2诱导的凋亡相关基因的表达。因此,ssc-miR-149在H2O2诱导的颗粒细胞凋亡中起着抗凋亡作用。由此推测,ssc-miR-149在猪颗粒细胞的凋亡以及卵泡闭锁过程中发挥重要的作用。

