两种除草剂在燕麦田土壤中的残留与消解动态
闫车太,赵桂琴,2,3,4,柴继宽,苟智强,许兴泽
(1. 甘肃农业大学草业学院,甘肃 兰州 730070;2. 草业生态系统教育部重点实验室,甘肃 兰州 730070;3. 甘肃省草业工程实验室,甘肃 兰州 730070;4. 中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
燕麦(Avena sativa)作为粮饲兼用的一年生禾本科作物,在世界各地广泛种植,我国西北和华北地区燕麦种植面积大[1-2]。其富含维生素、蛋白质、脂肪、β-葡聚糖、不饱和脂肪酸、可溶性纤维素等[3-4]。是我国重要的小杂粮之一,也是主要的栽培饲草。
燕麦田如果杂草危害严重,对燕麦产量、干草和种子品质、机械化收获等均有不良影响。人工除草成本高,一直是燕麦田投产比低的原因之一[5],喷施除草剂进行化学防治是燕麦田草害控制的重要手段。但是随着农药的广泛使用,其对生态环境、食品安全和人类健康带来了直接或潜在的负面作用和威胁,其中最突出的就是农药残留问题。农药施用后,会在作物、土壤、水体等环境中残留富集,通过食物链传递或对直接接触的生物产生危害。如有机氯农药理化性质稳定,易在生物和人体内积累,造成各种急慢性毒性、内分泌干扰效应、三致效应(致癌、致畸、致突变)等危害[6-7],虽然我国在1983年起就宣布停止生产滴滴涕、六六六等有机氯农药,然而直到现在在稻米、土壤等各个环境介质中仍有一定的残留物[8-9]。磺酰脲类除草剂甲磺隆、氯磺隆等在小麦(Triticum aestivum)田常规施用,可在土壤中残留数月甚至几年,对后茬作物玉米(Zea mays)、油菜(Brassica napus)、 棉 花 (Gossypium hirsutum)及 某 些 豆 科(Leguminosae)作物产生不同程度的药害,甚至死亡[10]。苏旺苍等[11]研究表明苄嘧磺隆(Bensulfuronmethyl)残留会使玉米幼苗的株高、地上鲜重、根长和干重显著降低,并会抑制玉米幼苗的光合作用。陈泽鹏等[12]根据二氯喹啉酸 (Quinclorac) 在土壤中的消解动态,结合二氯喹啉酸对烟草(Nicotiana tabacum)叶宽和根长的影响,认为在推荐田间施用量 150 g a.i.·hm-2(表示每公顷以克为单位的有效成分含量)下,偏酸性的土壤需经过269 d后,土壤中残留的二氯喹啉酸才可消解到对烟草叶宽没有显著影响的范围,经过342 d后,才可消解到对烟草根长没有显著影响的范围。
二氯喹啉酸化学名称为3,7-二氯-8-喹啉羧酸,商品名称有快杀稗、杀稗净,属激素型喹啉羧酸类选择性除草剂。1983年由德国巴斯夫公司首先开发,具有用量少、残效期长、对稗草(Echinochloa crusgalli)特效、施用期宽等优点。苄嘧磺隆,化学名称为2-{((4,6-二甲氧基嘧啶-2-基)氨基碳基)氨基磺基甲基}苯甲酸甲酯,商品名为农得时。由美国杜邦公司于20世纪80年代中期开发,属磺酰脲类除草剂,具有高效、广谱、低毒及低用量等优点,主要用于防除田间阔叶杂草和某些莎草(Cyperaceae)。该类除草剂的问世标志着除草剂进入超高效时代[13]。
二氯喹啉酸和苄嘧磺隆单独使用或与其他除草剂复配对燕麦田杂草的防治有良好的效果。谷雪菲[14]研究表明,50%二氯喹啉酸可溶性粉剂750 g·hm-2苗期茎叶喷施,对燕科1号燕麦田药后20 d的总体株防效达86.21%,尤其对禾本科(Gramineae)杂草的株防效达到98.68%,药后50 d总体株防效为60.88%;10%苄嘧磺隆可湿性粉剂 300 g·hm-2茎叶处理,对燕科1号燕麦田药后20 d的总体株防效达77.19%,对禾本科杂草和阔叶杂草的株防效为82.12%、73.89%,药后50 d总体株防效为55.98%。冷延瑞等[15]发现50%二氯喹啉酸可湿性粉剂5 g·100 m-2+48% 苯达松水剂 20 mL·100 m-2混配后茎叶喷施,对白燕1号、白燕2号、白燕8号燕麦田中阔叶杂草的鲜重防效分别达到了100%、92.21%和76.13%;32%苄嘧磺隆可湿性粉剂 0.02 g·m-2土壤处理,对3个品种田中阔叶杂草的鲜重防效分别达到了97.92%、92.21%和94.04%,白燕8号增产达158.5%。但这两种除草剂施用后也有造成燕麦减产、发生田间药害等的报道。宋旭东等[16]发现50%二氯喹啉酸825 g·hm-2茎叶喷施后白燕2号种子产量较喷清水对照减产62.3%。刘欢等[17]研究发现40%苄嘧磺隆粉剂450 g·hm-2茎叶处理后,燕麦田有药害发生。
除草剂残留对土壤环境以及后茬作物的生长有很大的影响,据报道,农药使用后有80%~90%的量最终将进入土壤[18]。燕麦多种植于高寒冷凉地区,这些地区目前生态环境较好,但除草剂已经大范围使用多年,而国内对这两种除草剂在燕麦田土壤中的残留降解情况尚无报道。因此,本研究拟以二氯喹啉酸和苄嘧磺隆这两种燕麦田常用的除草剂为研究对象,探讨其在燕麦田土壤中残留降解情况,对燕麦及后茬作物的生长以及评估这两种除草剂对土壤环境的影响都有重要意义。
1 材料与方法
1.1 试验地自然概况
试验地位于甘肃中部兰州市榆中县良种繁殖场 (104°9′ E,35°52′ N),海拔 1 930 m,年平均气温6.7 ℃,年降水量350 mm左右,无霜期120 d左右。0-10 cm 土层土壤有机质含量 8.67 g·kg-1,土壤pH 7.72,土壤类型为黄绵土,前茬作物为胡麻(Linum usitatissimum)。试验地两年内未施用过二氯喹啉酸和苄嘧磺隆。
1.2 试验设计及采样
降解动态试验于2016年进行,供试燕麦品种为白燕2号,3月29日播种,播种量为180 kg·hm-2,播种机条播,播种深度3~5 cm,行距20 cm。小区面积 20 m2(5 m × 4 m),随机区组排列,小区之间设隔离带,带宽1 m。除草剂选用50%二氯喹啉酸粉剂和10%苄嘧磺隆粉剂(除草剂性质及用量如表1所列),于燕麦3~4叶期施药,设计用量兑水450 kg·hm-2,用 YS-16C 型背负式手动喷雾器 (上下双孔雾化喷雾,台州市鹏盛农林机械有限公司生产)均匀喷雾。每个处理3次重复,同时设喷施清水空白对照。于施药后0、1、3、5、7、15、22、30、45和60 d,采0-10 cm土层土样,各小区采用棋盘式取样法取9个点,原始土样不少于1 kg。土样除去植物残渣、石块等分装后带回实验室过2 mm筛,四分法缩分保留250 g左右土样,放至-20 ℃冰箱低温保存。同时预留平行样品,以备水分测定,用于校正为干土的残留量。田间试验设计参照《农药残留试验准则》[19]进行。

表 1 除草剂种类及用量Table 1 Herbicide type and dosage
1.3 仪器与试剂
仪器设备:Agilent1260型高效液相色谱仪,配紫外检测器(美国安捷伦科技公司);SKY-211C型恒温培养振荡器(上海苏坤实业有限公司);旋转真空离心浓缩仪(北京五洲东方科技发展有限公司);氮吹仪;KQ-2000VDE型超声波清洗仪(昆山市超声仪器有限公司);PHS-3C型pH计(上海佑科仪器仪表有限公司);SBC22十万分之一电子天平(德国SCALTEC公司);JA2003型千分之一电子天平(上海越平科学仪器有限公司);AK-RO-UP-250型超纯水仪(成都唐氏康宁科技发展有限公司)。
标样及试剂:二氯喹啉酸标准品(北京麦瑞博生物科技有限公司);苄嘧磺隆标准品(阿拉丁试剂(上海)有限公司);流动相用甲醇(山东禹王实业有限公司化工分公司,色谱纯)、冰乙酸(天津市光复科技发展有限公司,色谱纯);乙腈、甲醇、二氯甲烷、硼砂、氯化钠、无水硫酸钠(用前于130 ℃下烘烤5 h以上)、98%浓硫酸(以上均为分析纯);超纯水;0.22 μm有机滤膜。
1.4 分析方法
1.4.1 样品前处理
1)二氯喹啉酸:称取20 g新鲜土壤样品于恒重的铝盒中,105 ℃下烘干恒重,测定水分含量(用于折算农药在干土中的含量)。同时称取含二氯喹啉酸土样50.0 g,置于具塞三角瓶中,加入0.05 mol·L-1硼砂缓冲溶液 30 mL 和甲醇 60 mL,振荡提取 60 min,后一并转移至 50 mL 离心管中,4 000 r·min-1离心 5 min,过滤,将滤液转移至 250 mL 分液漏斗中,加5%氯化钠水溶液10 mL,用浓硫酸调节pH至1~2,分别用二氯甲烷50、40、30 mL
萃取3次,合并二氯甲烷至250 mL三角瓶中,溶液经无水硫酸钠漏斗过滤至试管中,于旋转真空离心浓缩仪浓缩至近干,氮气吹干,色谱甲醇定容至5 mL,过0.22 μm有机滤膜,上机待测。
2)苄嘧磺隆:称取20 g新鲜土壤样品于恒重的铝盒中,105 ℃下烘干恒重,测定水分含量(用于折算农药在干土中的含量)。同时称取含苄嘧磺隆土样30 g,放入具塞三角瓶中,加入70 mL乙腈和15 mL去离子水,机械振荡提取2 h,抽滤至装有5 g氯化钠的200 mL具塞量筒中,剧烈振荡1 min。在室温下静置 10 min 分层,准确吸取 45 mL上清液,于旋转真空浓缩仪上浓缩近干,然后氮气吹干。色谱纯甲醇定容至2.5 mL,过0.22 μm有机滤膜,上机待测。
1.4.2 色谱条件的建立
1)二氯喹啉酸:色谱柱,Agilent TC-C18(4.6 mm × 250 mm,5 μm);柱温度,30 ℃;流动相,甲醇∶1%乙酸水溶液(55∶45,V∶V);流动相流速,1.0 mL·min-1;检测波长,238 nm;进样量,10 μL。
2)苄嘧磺隆:色谱柱,ZORRAX Eclipse XDBC18(4.6 mm × 150 mm,5 μm);柱温度,30 ℃;流动相,甲醇∶水∶冰乙酸(70∶29.5∶0.5,V∶V∶V);流动相流速,0.8 mL·min-1;检测波长,250 nm;进样量,10 μL。
1.4.3 标准曲线的绘制
准确称取二氯喹啉酸和苄嘧磺隆标准品各0.01 g(精确至 0.000 02 g),用甲醇分别定容至 100 mL,配成100 mg·L-1的标准母液,采用系列稀释法将二氯喹啉酸和苄嘧磺隆的标准液稀释至各所需的质量分数为 0.05、0.5、1.0、5.0、10.0 mg·L-1的系列标准溶液,按1.4.2所述色谱条件分别测定,外标法定量,以各农药标样进样质量浓度(mg·L-1)为横坐标,对应的峰面积为纵坐标,绘制标准曲线,得回归方程和相关系数。
1.4.4 添加回收率试验
用空白对照土样进行添加回收率试验。称取空白对照土样50和30 g,分别添加不同浓度的二氯喹啉酸和苄嘧磺隆标准品溶液,使两种除草剂在土壤中的质量浓度分别达到 0.05、0.5、1.0 mg·kg-1,每浓度进行5次重复,按上述方法进行前处理及分析测定,计算回收率和相对标准偏差(RSD)。
1.5 最小检出量和最低检测质量分数
以基线噪音的3倍水平(S/N= 3)作为所设定条件下仪器的最小检出量。最低检测质量分数的计算公式为[20]:

1.6 残留量计算
残留量计算公式[20]如下:

式中:R为样品中对应除草剂的残留量(mg·kg-1);C为从标准曲线上查得的相应除草剂残留浓度(mg·L-1);V终为最终定容体积(mL);W为土样质量(g)。
1.7 数据分析
采用Excel 2007录入数据与作图,Spss19.0对同一采样时间下两剂量除草剂的残留量进行独立样本t检验。
2 结果与分析
2.1 两种除草剂的线性范围
两种除草剂标准曲线的线性关系和相关系数(R2)如表2所列,可以看出,两种除草剂在0.05~10.0 mg·L-1范围内线性关系良好,相关系数(R2)均在0.99以上,可以满足定量分析要求。
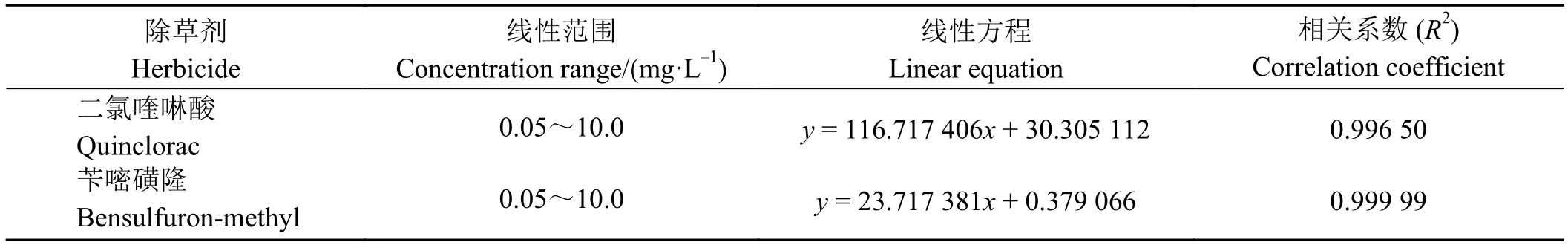
表 2 两种除草剂的线性标准曲线Table 2 Linearity of the two herbicides
2.2 两种除草剂的最小检出量和最低检测质量分数
测得土壤中二氯喹啉酸的最小检出量为4 × 10-10g,最低检测质量分数为 0.004 mg·kg-1。土壤中苄嘧磺隆的最小检出量为 1 × 10-10g,最低检测质量分数为 0.001 mg·kg-1。
2.3 添加回收率与相对标准偏差
从两种除草剂在3个添加水平有回收率及相对标准偏差(表3)可看出,二氯喹啉酸的添加回收率为85.63%~89.27%,相对标准偏差为2.17%~6.33%;苄嘧磺隆的添加回收率为80.26%~91.61%,相对标准偏差为3.28%~6.52%。两种除草剂的添加回收率及相对标准偏差均能满足农药残留分析的相关要求,所用方法的准确度和精密度良好。二氯喹啉酸和苄嘧磺隆标样及土壤样品色谱图如图1和图2所示。二氯喹啉酸和苄嘧磺隆出峰时间分别为 6.5 min 和 4.1 min 左右。

表 3 除草剂在土壤中的添加回收率 (n = 5)Table 3 Recoveries of quincloracs and bensulfuron-methyl in soil (n = 5)
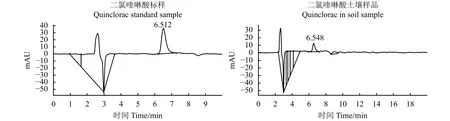
图 1 二氯喹啉酸色谱图Figure 1 Liquid chromatograms of quinclorac
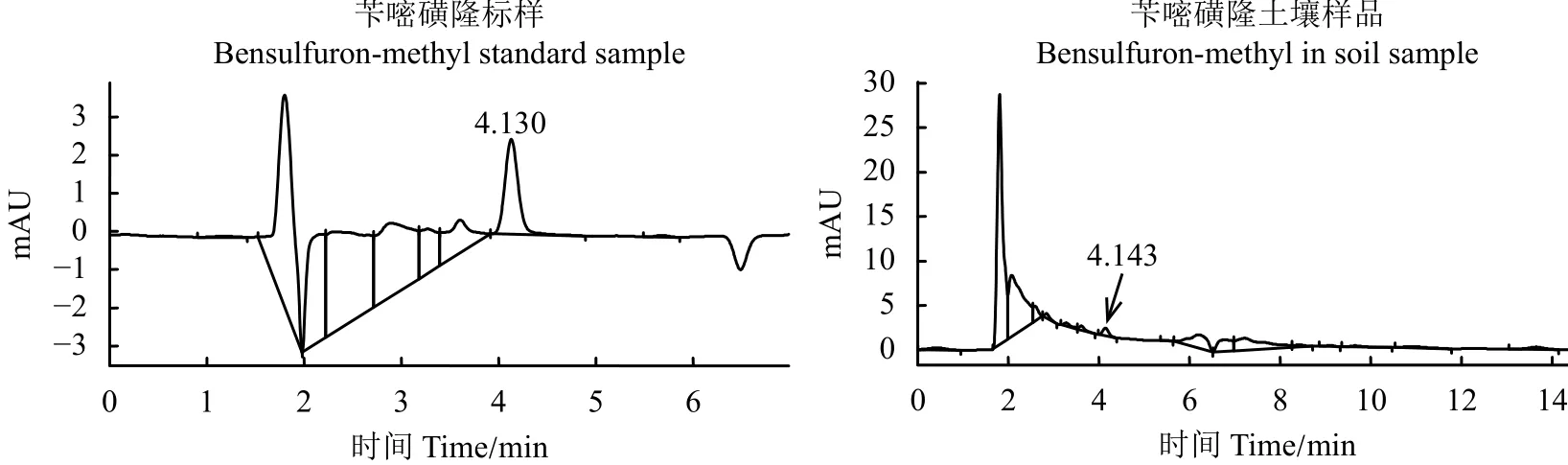
图 2 苄嘧磺隆色谱图Figure 2 Liquid chromatograms of bensulfuron-methyl
2.4 两种除草剂的消解动态
2.4.1 二氯喹啉酸在燕麦田土壤中的消解动态
50% 二氯喹啉酸粉剂按推荐剂量 225 g a.i.·hm-2与高剂量 (1.5 倍推荐剂量)337.5 g a.i.·hm-2,于燕麦3~4叶期一次施药,不同时间采样测定,其在土壤中的残留量及消解动态如表4、图3所示。
二氯喹啉酸推荐剂量和高剂量在土壤中0 d的原始沉积量分别为 0.173 7 和 0.251 4 mg·kg-1,其后残留量随着时间的延长而逐渐下降。3 d时推荐剂量的二氯喹啉酸在土壤中的残留量为 0.084 7 mg·kg-1,消解率为 51.24%,60 d 时其残留量为 0.028 6 mg·kg-1,消解率为83.53%;高剂量二氯喹啉酸5 d时残留量 为 0.128 9 mg·kg-1,消解率为 48.73%,60 d 时残留量为 0.037 9 mg·kg-1,消解率达到 84.92%。但两种剂量的二氯喹啉酸在降解至15 d时残留量有所上升。药后 0、1、5、15、60 d两剂量二氯喹啉酸残留量间差异显著(P<0.05)。从其消解动态曲线(图3)可以看出,二氯喹啉酸降解分为两个阶段,0~7 d时降解较快,7 d以后消解曲线相对比较平缓,其在土壤中的降解符合一级动力学特征,降解方程分别拟合为Ct= 0.108 6e-0.026 0t和Ct= 0.178 9e-0.029 4t,相关系数 (R2)分别为 0.738 2 和 0.811 5,半衰期分别为 26.7 和 23.6 d。
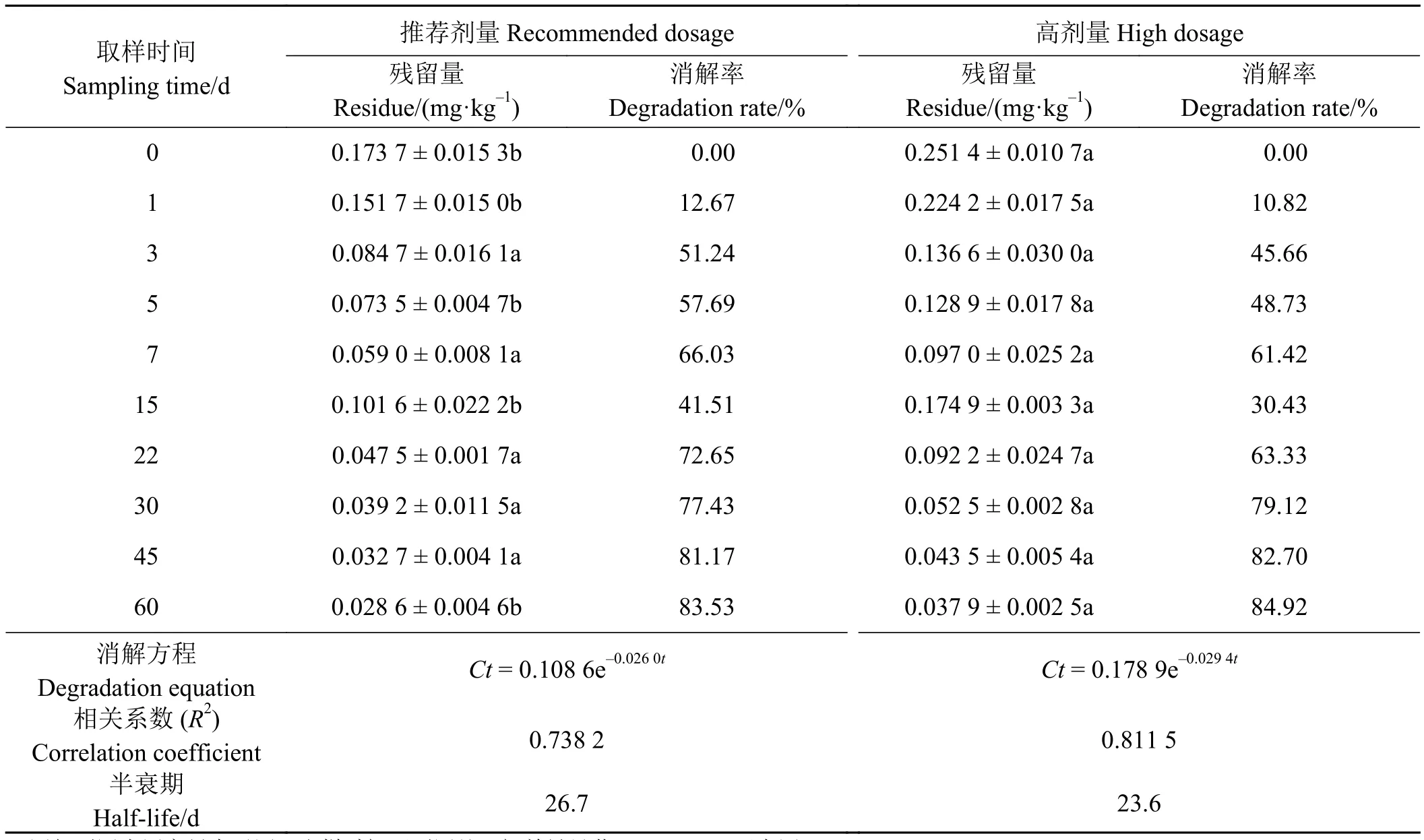
表 4 二氯喹啉酸在土壤中的消解动态Table 4 Degradation dynamic of quinclorac in soil

图 3 二氯喹啉酸在土壤中的消解动态曲线Figure 3 Degradation curve of quinclorac in soil
2.4.2 苄嘧磺隆在燕麦田土壤中的消解动态
10% 苄嘧磺隆粉剂按推荐剂量 34 g a.i.·hm-2与高 剂 量 (1.5 倍 推 荐 剂 量 )51 g a.i.·hm-2, 于 燕 麦3-4叶期一次施药,不同时间采样测定,其在土壤中的残留量及消解动态如表5、图4所示。
苄嘧磺隆推荐剂量和高剂量在土壤中0 d的原始沉积量分别为 0.026 2 和 0.044 5 mg·kg-1,其后残留量随着时间的延长而逐渐下降。3 d时苄嘧磺隆推荐剂量在土壤中的残留量为 0.015 4 mg·kg-1,消解率达到 41.22%,高剂量残留量为 0.020 4 mg·kg-1,消解率达到54.16%;60 d时两种剂量的残留量分别为 0.001 3 和 0.003 5 mg·kg-1,消解率分别为 95.04%和92.13%。降解至22 d苄嘧磺隆两种剂量在土壤中的残留量上升。施药后的0、1、5、7、15、30和60 d两剂量苄嘧磺隆残留量间差异显著(P<0.05)(表5)。从其降解动态曲线可以看出,苄嘧磺隆降解分为两个阶段,0~5 d时降解较快,5 d以后降解曲线相对比较平缓,其在土壤中的降解符合一级动力学特征,降解方程分别为Ct= 0.011 5e-0.038 8t和Ct= 0.022 1e-0.034 4t,相关系数 (R2)分别为 0.514 2和 0.654 7,半衰期分别为 17.9 和 20.1 d(图 4)。
3 讨论与结论
3.1 二氯喹啉酸在燕麦田土壤中的降解动态
曾飞等[21]认为土壤微生物通过矿化作用、共代谢作用、种间协同作用与活化作用等成为土壤中的二氯喹啉酸降解的主要途径。李子木[22]通过GC-MS检测到3种可能的二氯喹啉酸中间代谢产物,结合降解过程中的关键酶推测,细菌先通过脱羧作用将3,7-二氯喹琳酸转化为3,7-二氯哇琳,然后经氧化裂解打开含氮的环,再经过基团转移等作用转化为2-甲酸-5-氯苯胺,在转氨作用后形成氯化邻苯二甲酸,然后经过邻苯二甲酸双加氧酶和氯邻苯二酚1,2-双加氧酶作用后最终进入三羧酸循环,完成降解过程。此外,二氯喹啉酸在土壤中的降解还受湿度、温度、土壤pH、土壤类型等的影响[23-24]。宋稳成等[25]认为土壤湿度影响二氯喹啉酸在土壤中的可溶性及活性,进而影响其降解速度。土壤pH影响二氯喹啉酸在土壤中的存在状态,二氯喹啉酸是一种弱酸(pH为4.35),pH较高的情况下,在土壤中的解离度较大,易被降解[26]。张倩等[23]探讨了土壤pH、土壤含水量、温度对植烟土壤中二氯喹啉酸降解的影响,结果表明,土壤pH在5~9范围内与土壤中二氯喹啉酸的半衰期呈明显的负相关关系 ;土壤含水量与降解速率呈正相关关系,随含水量的增加,半衰期明显缩短;温度与二氯喹啉酸的降解呈正相关关系。二氯喹啉酸在不同地区不同环境条件下降解速度不同。陈泽鹏等[12]室内模拟研究了二氯喹啉酸施用后在土壤中的降解,结果表明,在pH 5.84的广东烟区土壤中添加浓度为1.6和0.8 mg·kg-1的二氯喹啉酸,其半衰期分别为22.04和23.30 d。李欣[27]对湖南长沙植烟田土壤中二氯喹啉酸的残留降解分析结果表明,二氯喹啉酸在当季水稻(Oryza sativa)田施药起,至第2年植烟田土壤里降解的半衰期为43.12 d。苑学霞等[28]对两年(2008、2009年)三地(浙江杭州、山东济南、黑龙江铁力)稻田土壤中二氯喹啉酸降解动态研究结果表明,二氯喹啉酸在土壤中消解较快,半衰期较短,为16.6~21.9 d。本试验条件下测得二氯喹啉酸的降解半衰期为23.6~26.7 d。环境条件、土壤性质、施用剂量等的差异是造成与他人结果不同的主要原因。另外本研究还发现,两个浓度的二氯喹啉酸降解至第15天时,在土壤中的残留反而较第3、5、7天高。这与简秋等[29]研究发现的二甲四氯、莠灭净、敌草隆在甘蔗(Saccharum officinarum)田土壤中的降解情况相似。这可能与二氯喹啉酸在土壤中迁移有关,但具体原因还有待进一步研究。
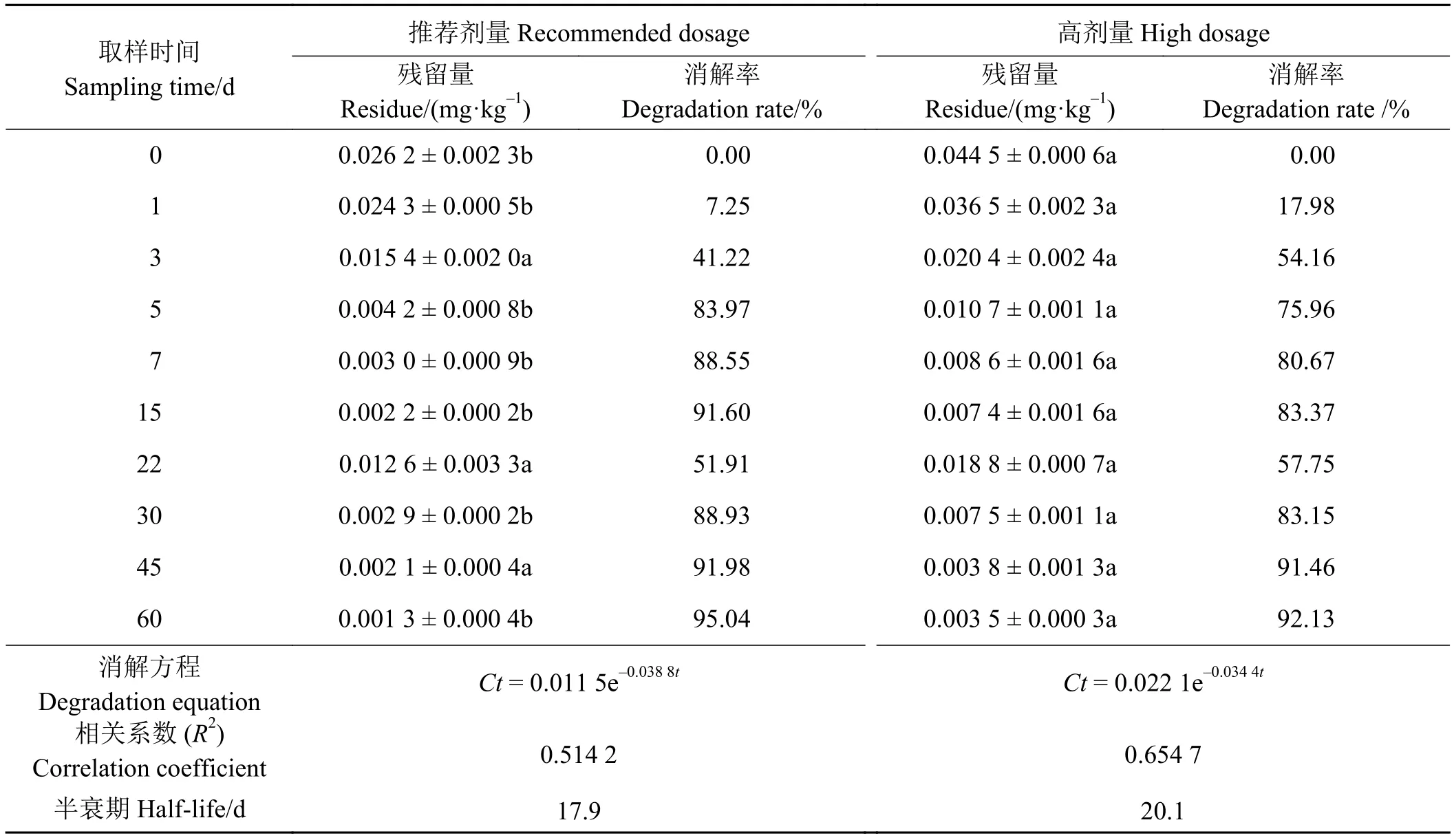
表 5 苄嘧磺隆在土壤中的消解动态Table 5 Degradation dynamic of bensulfuron-methyl in soil

图 4 苄嘧磺隆在土壤中的降解动态曲线Figure 4 Degradation curve of bensulfuron-methyl in soil
3.2 苄嘧磺隆在燕麦田土壤中的降解动态
磺酰脲类除草剂的降解主要包括水溶性光解、化学水解和微生物降解3种途径,其中光解作用较少,最多只对土壤表面的少量底物起作用;在酸性及中性土壤中的降解是化学水解和微生物降解共同作用;在碱性土壤中微生物对其降解起着非常重要的作用[30-31]。大量研究表明,磺酰脲类除草剂有3种不同的降解通路:磺酰脲桥的断裂、氧化作用和脱脂作用[32-33]。磺酰脲类除草剂均呈弱酸性,pH 3.3~5.2。在酸性条件下,其分子的大部分是易水解的中性态,水解迅速;在碱性条件下,负电荷分布于磺酰脲桥,降低了羰基碳原子的亲核反应活性,而不易水解。因此,pH是控制这类除草剂水解速度和水解产物的重要因素之一。程微和陈祖义[34]用核素示踪技术研究了14C-苄嘧磺隆在室内暗培养渍水条件下土壤中的残留动态,结果表明,苄嘧磺隆在碱性土壤中的消解速率比中性土壤缓慢,半衰期分别为129、62 d。磺酰脲类除草剂生物降解的主要途径是通过土壤中微生物对其进行分解,凡能影响微生物活性的因素均影响苄嘧磺隆在土壤中的降解。Salardi等[35]研究发现,在通氧的条件下接种微生物,可迅速有效地去除土壤中的苄嘧磺隆。程玲等[36]探讨了汉江平原渍涝地稻田土壤中单因子控制条件下苄嘧磺隆的残留降解规律,结果表明,苄嘧磺隆的降解速率随土壤温度、土壤含水量、土壤有机质的增加而加快;随土壤pH的升高而降低。本研究测得,苄嘧磺隆在燕麦田土壤(pH 7.72)中的半衰期为17.9~20.1 d,与程玲的研究结果相似。另外与二氯喹啉酸降解情况类似,苄嘧磺隆在降解至中段第22天时残留量也有所升高。
按照《化学农药环境安全评价试验准则第1部分:土壤降解试验》[37]对农药在土壤中残留性的划分,其中农药在土壤中降解半衰期小于1个月的为易降解农药。因此,二氯喹啉酸和苄嘧磺隆均属易降解型农药。农药残留期越短,对环境影响越小,但考虑到农药对病虫草害的控制需要一定的持效期才能发挥作用,多数人认为,理想的农药半衰期以15~30 d为宜。二氯喹啉酸和苄嘧磺隆按推荐剂量和推荐剂量的1.5倍使用,在甘肃榆中燕麦田的半衰期分别为23.6~26.7和17.9~20.1 d。半衰期短,对病虫草害控制的持效期也较为适宜,因此适合在燕麦田土壤中使用。但两种农药对环境的具体影响及其生态效应,还有待进一步研究。

